基于JAK/STAT信号通路探讨复方竹节参片对膝关节骨性关节炎兔的作用机制
彭名行,田春漫,涂 星,谢慧臣,袁丽君,李三宇
(1. 湖北民族大学医学部,湖北 恩施 445000;2. 风湿病性疾病发生与干预湖北省重点实验室,湖北 恩施 445000;3. 达州中医药职业学院,四川 达州 635000)
膝关节骨性关节炎(knee osteoarthritis,KOA)以膝关节疼痛、肿胀、变形及功能障碍为主要临床表现,严重影响患者的生活质量[1]。目前临床上常用非甾体类抗炎药物治疗KOA,虽能在一定程度上减轻疼痛,但长期应用所致的消化道不良反应影响了其治疗依从性[2-3]。中医药治疗本病具有疗效好、不良反应小的优势[4]。复方竹节参片是湖北民族大学附属民大医院治疗KOA的院内制剂,在临床使用10余年,疗效确切,无明显不良反应[5-6]。前期研究证实,复方竹节参片具有调节免疫、抗炎、镇痛、抗风湿等药理作用[7],但其治疗KOA的作用机制尚不明确。本研究拟采用木瓜蛋白酶诱导的KOA兔模型为研究对象,采用复方竹节参片进行干预治疗,考察其对JAK/STAT信号通路上下游相关细胞因子和蛋白表达的影响,初步揭示其作用机制。
1 实验材料与方法
1.1实验材料
1.1.1实验动物 清洁级雄性日本大耳白兔40只,体重(2.0±0.2)kg,购自湖北逸挚诚生物科技有限公司,动物许可证号:SCXK(鄂)2016-0020,实验前适应性喂养7 d。
1.1.2主要药物与试剂 复方竹节参片(购自湖北民族大学附属民大医院,恩施州卫药制准字[2011]03-38,批号:171101);木瓜蛋白酶(南京奥多福尼生物科技有限公司,批号:20160308);白细胞介素-6(IL-6)(武汉博士德生物工程有限公司,批号:EK0412);p-JAK2单抗(xy-3206R,上海信裕生物技术有限公司);ERK1、JAK2、STAT3 单抗均购自武汉三鹰生物技术有限公司。
1.1.3主要仪器 5810R高速冷冻离心机(德国Eppendorf公司);酶标定量测定仪(德国Thermo公司);Western blot电泳及转膜装置(美国Bio-Rad公司);TS-Ⅰ型脱色摇床(江苏海门麒麟医用仪器厂)。
1.2实验方法 取34只兔于第1,4,7天分别于膝关节腔内注射2%木瓜蛋白酶水溶液0.5 mL,另取6只兔作为对照组,同法注射等量生理盐水,参考文献[8]评价其造模是否成功,结果成功模型26只,成功率为76.5%。将造模成功的兔随机分为模型组8只和复方竹节参片高、中、低剂量组各6只。竹节参片高、中、低剂量组分别以150 mg/kg、75 mg/kg、37.5 mg/kg给予浓度为60 mg/mL、30 mg/mL、15 mg/mL复方竹节参片混悬液5 mL灌胃,对照组及模型组同法灌胃等体积蒸馏水,均每天1次,连续14 d。
1.3观察指标及方法
1.3.1兔脚踝周径测定 分别于造模前、造模结束后、灌胃7 d及灌胃14 d,将兔固定于兔台,用细麻线环绕脚踝一周,测量并记录细麻线长度,即为兔脚踝周径。
1.3.2样本采集 于末次灌胃后禁食不禁水12 h,以10%水合氯醛麻醉各组兔后,腹主动脉取血,3 000 r/min离心10 min,取血清,于-80 ℃冰箱中保存;剥离左侧膝关节滑膜,置于EP管中,于-80 ℃冰箱中保存;取右侧膝关节,置于4%多聚甲醛溶液中固定,-80 ℃冰箱中保存。
1.3.3膝关节病理样本制备与形态观察 取4%多聚甲醛溶液中固定的右侧膝关节组织,经常规脱水,脱钙,石蜡包埋,切片,HE染色后,在光学显微镜下观察。
1.3.4血清中IL-6水平测定 取上述待测血清,按照ELISA试剂盒说明书检测血清中IL-6水平。
1.3.5滑膜组织中JAK2、p-JAK、STAT3、ERK1蛋白表达检测 取滑膜组织,常温解冻,称取滑膜组织重量,匀浆后加入蛋白裂解液充分裂解组织、离心、分离上清液,把样品煮沸变性,按照BCA试剂盒操作进行蛋白定量,然后将样品加入电泳凝胶中进行蛋白分离,裁剪出目的蛋白的蛋白胶后进行转膜,封闭后加入浓度均为1∶1 000的JAK2、p-JAK、STAT3、ERK1抗体,孵育过夜后用TBS冲洗,加入二抗后室温下孵育2 h,用TBS(Tris-HCl缓冲盐溶液)清洗条带后进行ECL底物发光。将胶片进行扫描,用凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。

2 结 果
2.1各组兔脚踝关节肿胀程度比较 造模结束后模型组、复方竹节参片各组兔脚踝周径均显著长于对照组及造模前(P均<0.05),各造模组间比较差异均无统计学意义(P均>0.05);灌胃7 d后,复方竹节参片各组兔脚踝周径均有缩短趋势,但与模型组比较差异均无统计学意义(P均>0.05);灌胃14 d后,复方竹节参片各组兔脚踝周径均显著短于模型组(P均<0.05),且复方竹节参片各组间比较差异均无统计学意义(P均>0.05)。见表1。
2.2各组兔膝关节病理形态学表现 对照组滑膜细胞排列整齐,踝关节软骨表面光滑无破坏,滑膜组织结构完整无破坏,无炎性细胞浸润及血管增生等炎性症状;模型组软骨组织结构遭到破坏,滑膜细胞增生变形、纤维化,细胞排列紊乱,有大量炎性细胞浸润增生及滑膜血管翳形成;与模型组比较,复方竹节参片高剂量组膝关节软骨破坏减少,其滑膜组织增生减轻,所观察到的细胞形态未出现紊乱,无血管翳形成;复方竹节参片中、低剂量组炎性细胞浸润明显改善,滑膜细胞排列相对整齐,血管翳明显减少。见图1。

表1 各组兔脚踝周径比较
2.3各组兔血清IL-6水平比较 对照组、模型组及复方竹节参片高、中、低剂量组血清IL-6水平分别为(106.96±14.10)μg/mL、(199.94±14.35)μg/mL、(147.04±5.23)μg/mL、(154.49±7.66)μg/mL、(181.04±11.47)μg/mL,模型组显著高于对照组(P<0.05),复方竹节参片高、中剂量组均显著低于模型组及复方竹节参片低剂量组(P均<0.05),复方竹节参片高、中剂量组间比较差异无统计学意义(P>0.05)。
2.4各组兔滑膜组织中JAK2、p-JAK、STAT3、ERK1蛋白表达量比较 与对照组比较,模型组滑膜组织中JAK2、p-JAK、STAT3、ERK1表达量均显著升高(P均<0.05);与模型组比较,复方竹节参片各组滑膜组织中p-JAK2、STAT3、ERK1蛋白表达量及复方竹节参片高剂量组滑膜组织中JAK2蛋白表达量均显著降低(P均<0.05)。见图2。
3 讨 论
目前KOA发病机制尚不明确,但国内外普遍认为其可能与合成及分解代谢相关的炎症因子、脂蛋白基因、细胞因子和自由氧化因子等有关[9-10]。 JAK/STAT是重要的细胞内信号转导通路,JAK家族与STATs家族成员均存在于人体细胞质中,主要参与炎症反应、氧化应激、细胞损伤、凋亡、介导机体免疫等[11]。IL-6是JAK/STAT信号通路重要上游的细胞因子,是一种具有多种生理功能的炎性细胞因子,KOA发生后,IL-6能与IL-6受体结合,激活下游JAK/STAT信号通路,使得JAK2和磷酸化JAK2(p-JAK)的表达量均显著增加,进而诱导STAT3蛋白表达量增加,间接诱导ERK1蛋白表达上调[12]。研究发现,通过调控JAK/STAT信号通路,可以抑制骨性关节炎炎症反应,抑制软骨细胞凋亡,明显缓解关节软骨的退变[13-15]。

图1 各组兔膝关节HE染色表现(×400)



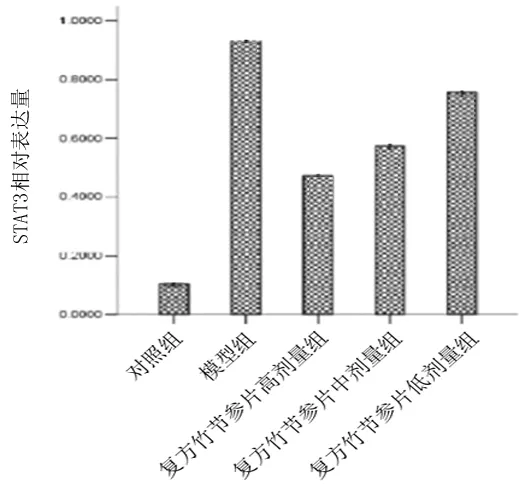
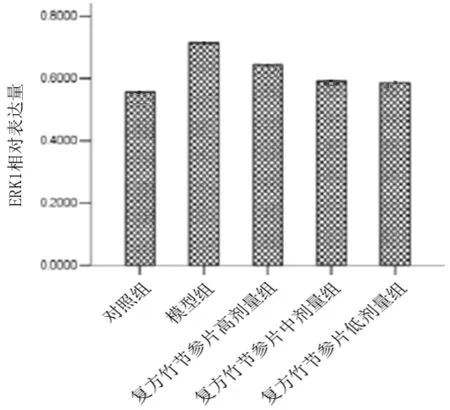
图2 各组兔滑膜组织中JAK2、p-JAK、STAT3、ERK1蛋白表达情况
KOA属于祖国医学“骨痹”“痹证”范畴,该病以中老年患者居多,是由于中年以后,肝肾精血虚亏,筋骨失养,气血运行不畅, 经脉不通,不通则痛,不通则肿。所以治疗重在滋补肝肾、益气活血、舒筋活络[6]。复方竹节参片以益气活血、散瘀止痛的竹节参为君药,以血当归、白芍、淫羊藿为臣药,与君药合用以达养血活血、滋补肝肾、强筋壮骨之效;佐以搜风除湿、散寒逐瘀之青风藤、地蜂子、穿地龙等,共奏滋补肝肾、益气活血、祛风除湿之功,组方用药与KOA中医病机相契合。
本研究采用经典的木瓜蛋白酶膝关节腔注射进行KOA兔模型造模,探讨了复方竹节参片治疗KOA的可能作用机制。结果显示,木瓜蛋白酶诱导的KOA模型家兔关节明显肿胀;膝关节病理切片表现为软骨组织结构破坏,滑膜细胞增生变形,有大量炎性细胞浸润;血清IL-6水平及滑膜组织中JAK2、p-JAK、STAT3、ERK1蛋白表达量显著升高。提示木瓜蛋白酶关节腔注射可以诱导膝关节的炎性反应,从而促进炎性因子IL-6的分泌,进而激活JAK/STAT信号通路,进一步加重关节炎症反应,导致软骨的破坏和滑膜的增生,最终形成KOA。给予模型家兔复方竹节参片干预后,家兔血清IL-6水平及滑膜组织中JAK2、p-JAK、STAT3、ERK1表达量均明显降低,提示复方竹节参片可能通过抑制炎性因子IL-6表达,从而抑制JAK/STAT信号通路,进而减轻关节炎症反应,减少软骨细胞的破坏,最终达到治疗KOA的目的,分析IL-6、JAK2、p-JAK、STAT3、ERK1是复方竹节参片的主要作用靶点。
目前尚未见经典的治疗KOA的成药,故本研究未设置阳性药物对照,在治疗作用的比较上尚存在一定的局限性。此外,以木瓜蛋白酶诱导的KOA动物模型是否具有相应的中医证候属性,是否符合复方竹节参片的组方特色,还有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。

