铜铝氧化物的制备及其脱硫性能研究
吴 婷,李丹丹,程 锴,夏明桂
(武汉纺织大学 化学与化工学院,湖北 武汉 430200)
硫化氢(H2S)是一种无机化合物,标准状态下是一种易燃酸性气体,低浓度状态下无色,臭鸡蛋味,高浓度下无色无味,有剧毒性[1]。H2S 的来源较广泛,包括火山喷气、天然气、煤炭矿井、细菌作用下动植物蛋白的腐蚀等。同时,冶炼厂、煤化工、石油精炼、硫酸等制造工业也会产生大量含有H2S 的废气。H2S会导致设备管道的腐蚀、催化剂的中毒,并造成严重的环境污染等问题[2]。因此,工业生产中进行脱硫刻不容缓。
铜锰氧化剂具有高温热稳定性,有很好的机械性能,脱硫精度高,硫容大。CuO 形成的尖晶石结构,能大大提高对H2S 的吸附能力[3]。氧化铜直接用于煤气脱硫时会发现其对于硫化氢的脱除能力很差,这是因为氧化铜的比表面积很小,严重限制它与硫化氢接触反应,而且纯的氧化铜在和硫化氢反应的过程中,会生成硫化铜覆盖在氧化铜的表面,阻止反应进一步的发生。后研究发现,氧化铜脱硫剂的使用必须依附在载体上进行,脱硫能力才会明显增强[4]。
1 实验部分
1.1 实验药品和实验仪器
药品:三水合硝酸铜,六水氯化铝,氢氧化钠,无水乙醇;
仪器:ME204E 电子天平,FE20K pH 计,HH-2 数显恒温水浴锅,多功能电搅拌器,多功能电搅拌器,DD-5M 低速大容量离心机,小容量离心机,ST2BCII 电热恒温干燥箱,JW-BK112 比表面及孔径分析仪,JW-BK112 比表面及孔径分析仪,标准实验筛,马弗炉,脱硫评价系统。
1.2 脱硫剂制备方法
本实验主要采用共沉淀法:以三水合硝酸铜、六水氯化铝为原料配制成一定浓度的硝酸铜和氯化铝混合溶液,再滴加配置成一定浓度的碳酸钠溶液,随着反应的进行,反应体系的澄清溶液逐渐出现沉淀并产生大量气泡。用碳酸钠作沉淀剂,采用碱法使用高于理论量的碳酸钠,将铜离子形成碱式碳酸铜沉淀,最后进行离心、洗涤、干燥、焙烧等一系列步骤,制成氧化铜脱硫剂。
1.3 性能分析与测试
铜基脱硫剂X 射线衍射表征在Bruker D8-X 射线衍射仪表征合成的。铜靶Kα(λ=1.5418nm)衍射源,电压40kV,电流40mA,扫描范围2θ=10°-90°,扫描速度10°/min。
采用北京精微高博科学技术有限公司JW-BK112 比表面测定仪测定比表面。测试条件:在液氮(78K)条件下,测定不同相对压力下吸附质在固体表面的吸附量,后根据BET 多层吸附理论公式和BJH 方程式计算样品的比表面积和结构参数。
2 实验结果与讨论
2.1 焙烧温度对铜基脱硫剂脱硫影响的探究
我们分别考察了焙烧温度为200℃、300℃、400℃、500℃和600℃时,铜铝氧化物脱硫剂的脱硫效果。
从图1 可以看出,焙烧温度在400℃时脱硫剂的脱硫效果最好,其穿透硫容量最大为10wt%。
为探究焙烧温度对脱硫剂的内部结构及脱硫效果的影响,对其进行BET 比表面分析和X-射线衍射(XRD)表征。测得实验数据如表1 所示:

图1 不同焙烧温度下脱硫剂的H2S 穿透硫容

表1 不同焙烧温度下脱硫剂物理化学性质
对表1 数据进行分析可知,焙烧温度至400℃阶段,最佳比表面积在50-60m2/g 之间,最高比表面积则为59m2/g。从孔容孔径数据可得,其趋势先增大后减小,在焙烧温度为400℃时达到最大[5]。
从图2 可以看出,脱硫剂主要出现归属于CuO 的衍射峰,未检测到氧化铝的特征峰,这是由于氧化铝存在形式为无定型。同时,增加焙烧温度使得CuO 晶粒尺寸逐渐缓慢变大。说明氧化铝作为载体能够抑制CuO 晶粒的长大[6]。因此,焙烧温度为400℃时,所制备的脱硫剂孔容最大,此时脱硫效果最佳。
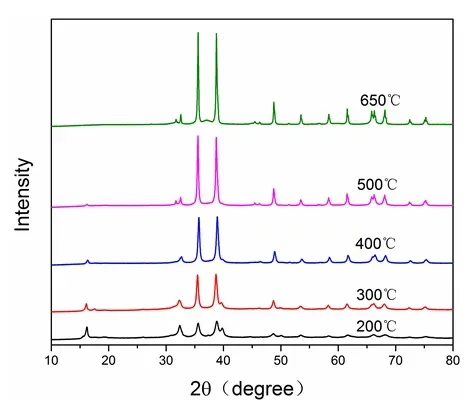
图2 不同焙烧温度下脱硫剂XRD 衍射图
2.2 正交试验分析评价
在确定脱硫剂前驱体的焙烧温度为400℃后,通过设计正交试验,考察最佳反应温度、盐碱比、铜铝摩尔比。正交实验水平设计表如表2 所示:
从表3 可以看出,因素B(铜铝组分摩尔比)是影响铜基脱硫剂硫容的决定性因素。从脱硫剂穿透硫容角度出发,应将nCu/nAl摩尔比放在首要考虑和重点控制的对象。其次因素C(盐碱摩尔比)对铜基脱硫剂的硫容也有较大影响。因此,各因素对铜基脱硫剂穿透硫容的影响程度为:铜铝摩尔比>盐碱摩尔比>反应温度。

表2 正交试验因素水平表
2.3 单因素试验分析
2.3.1 铜铝摩尔比对铜基脱硫效果的影响
在nNaOH/n金属盐=1:1,反应温度60 ℃条件下,改变nCu/nAl摩尔比的比例R=(0.25:1、0.375:1、0.5:1、0.625:1、0.75:1),得到五份铜基脱硫剂样品。从图3 中的结果可以看出,随着铜铝摩尔比的升高,比表面关系与穿透硫容呈负相关。随着铜铝摩尔比比例增大,活性组分含量增加,穿透硫容增大,脱硫剂脱硫效率提高。
当活性组分较低时,随着含量的逐渐升高,穿透硫容增加;当占比逐渐增加,反应生成硫化铜膜超过脱硫剂负载量极限值导致多层覆盖,开始时多层覆盖程度较小,硫化氢气体尚能通过载体孔道与活性组分反应,随着多层覆盖程度增加,孔隙被堵塞,硫化氢无法通过孔道,因此导致了脱硫效果降低[7]。因此,最佳活性组分比nCu/nAl=0.625:1。
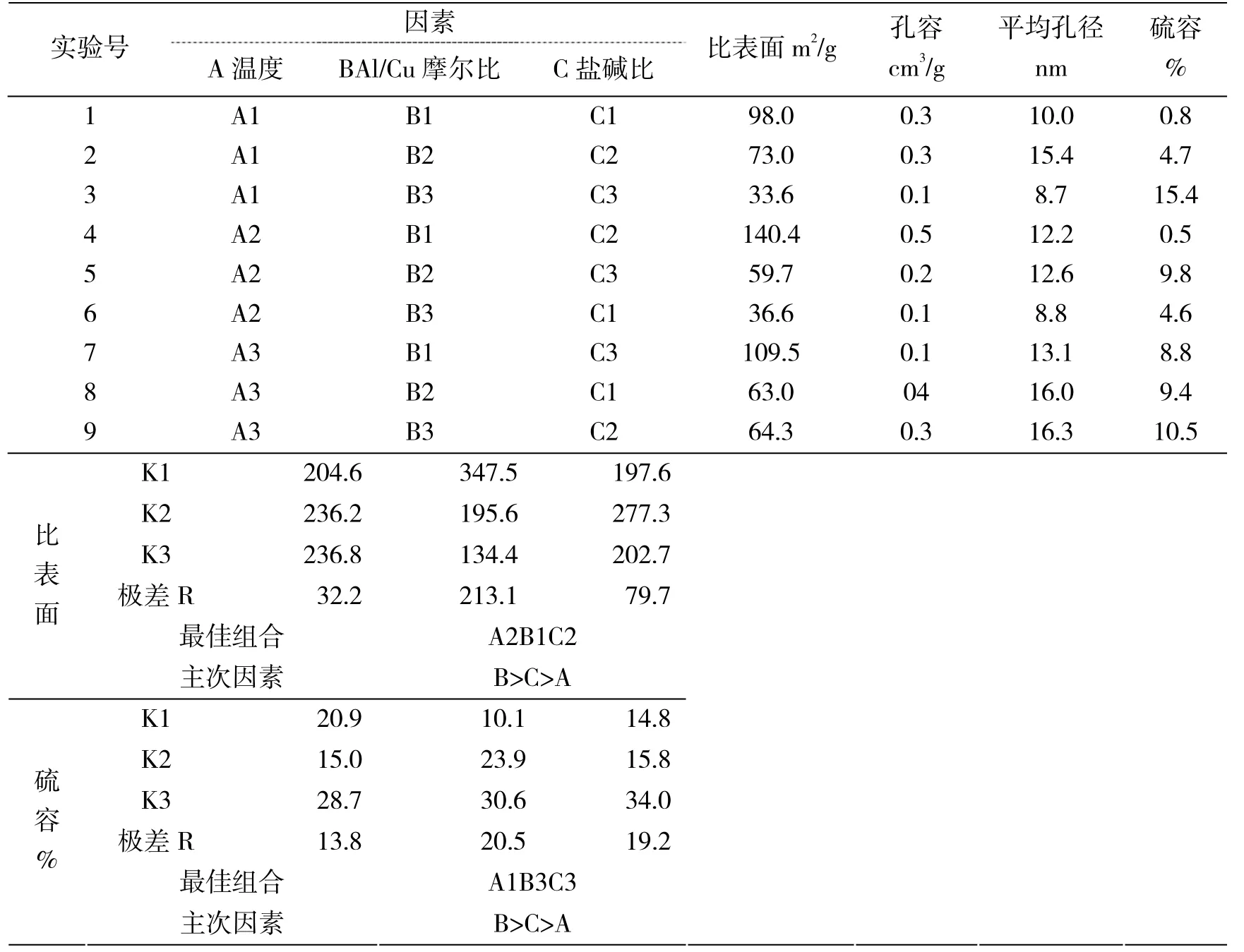
表3 三因素三水平正交试验表
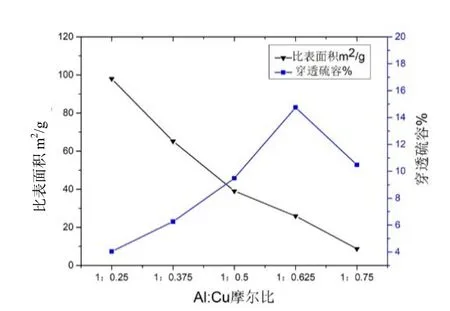
图3 不同铜铝摩尔比硫容及比表面积变化关系
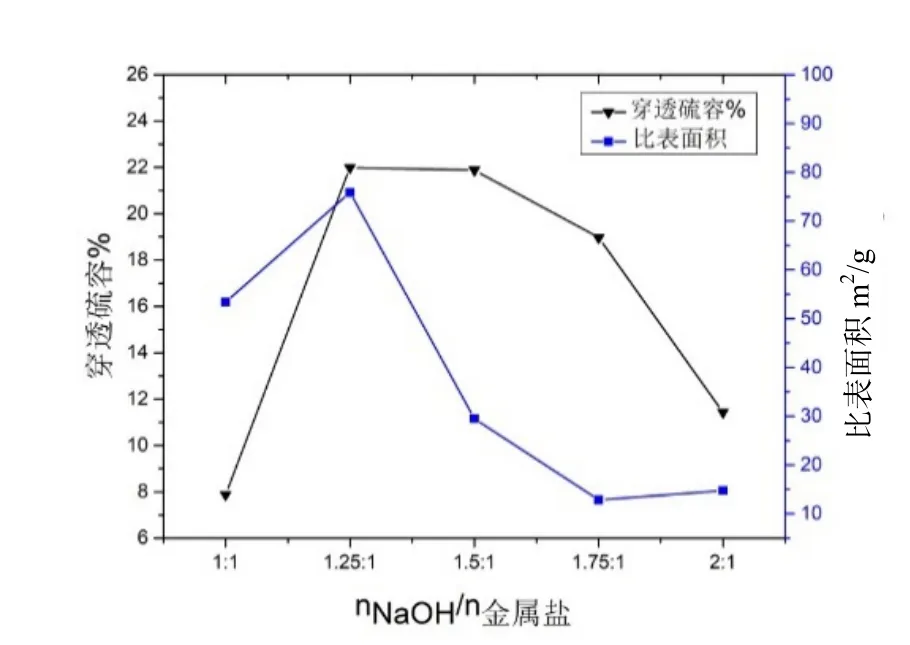
图4 不同盐碱比比表面积及硫容变化关系
2.3.2 盐碱摩尔比对脱硫活性的影响
在铝铜摩尔比为0.625:1,反应温度为60℃的条件下,改变沉淀剂与金属盐摩尔比nNaOH/n金属盐=(1:1、1.25:1、1.5:1、1.75:1、2:1)得到五份铜基脱硫剂样品。
由图4 可知,在盐碱比小于1.25:1 时,随着碱量的增加,反应逐渐充分,极大程度上促进了酸性气体H2S 的吸收,从而使穿透硫容增大;当盐碱摩尔比大于1.25:1 后,碱浓度变大,载体组分与活性组分不能将碱液完全利用,造成孔道内部分物质碱性较强,物质不均匀使脱硫效果变差。因此在盐碱比实验中可选择摩尔比为1.25:1。
2.3.3 反应温度对脱硫活性影响
在铝铜摩尔比为0.625:1,盐碱比1.25:1 的条件下,改变反应温度T=(50℃、60℃、70℃、80℃、90℃),得到五份铜基脱硫剂样品。
从图5 可以看出,五份样品在检测后数据变化趋势为先增长后下降中间出现陡增。反应温度较低时,沉淀物反应活性较低,脱硫剂脱硫效率低;而在反应温度在70℃后继续增加,穿透硫容突然下降,到90℃时,硫容下降到3.21%。在一定的温度反应下,可以加快晶核生成速率,而温度的持续升高过程中氧化铜颗粒过度活跃使得脱硫剂内部发生团聚,溶质分子剧烈运动,晶核稳定性减弱,从而使得脱硫效果降低。沉淀物颗粒剧烈运动造成颗粒团聚形成致密氧化铜,因此比表面积下降。因此,脱硫效率最高时反应温度为70℃,此时比表面积80.394m2/g,穿透硫容为13.22%。
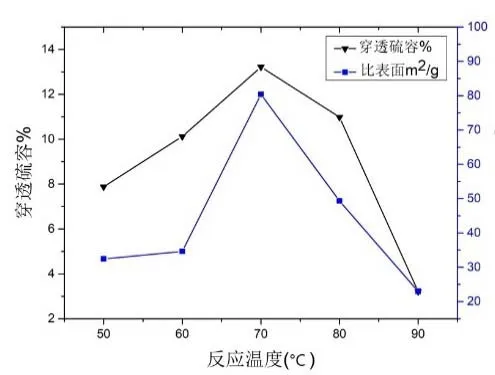
图5 不同反应温度比表面积及硫容变化关系
3 结论
本课题采用共沉淀法制备得到铜铝氧化物脱硫剂,并考察其脱硫性能分别考察了焙烧温度、铜铝摩尔比、盐碱比和反应温度多种因素对脱硫剂脱硫效果的影响。实验得到以下的结论:
(1)铜基脱硫剂制备过程中,烧结过程复杂,与多种因素有关。最佳焙烧温度为400℃,穿透时间为570min,H2S 穿透硫容为10wt%。
(2)通过设计的三因素正交试验中,其影响因素主次为:nCu/nAl摩尔比>盐碱比>反应温度。
(3)在nCu/nAl摩尔比为0.625:1 时,脱硫效果最好。
(4)在盐碱比为1.25:1 时,效果最佳,穿透硫容与比表面都到达峰值分别为21%和75m2/g。
(5)温度在70℃时,效果最佳,并且温度太高或者太低在制备脱硫剂过程中都不利于发挥主活性组分的最大效用。

