hsa-miR-125a的靶基因预测及生物信息学分析*
杨一秋 李 兰 赵 娜 解继胜
1 右江民族医学院免疫学专业在读硕士研究生,广西百色市 533000; 2 右江民族医学院基础医学院组织胚胎学教研室
骨质疏松症(Osteoporosis,OP)是一种常见的骨骼疾病,以降低骨量,破坏骨微结构为特征,最终引起骨骼脆弱并增加骨折风险[1]。骨质疏松症是一种与年龄密切相关的骨骼疾病。最严重的后果是骨折,骨质疏松性骨折危害巨大,给老年患者的生活带来巨大痛苦并且对于家庭和社会来说也是一个沉重的负担。MicroRNA(miRNA)是一种内源性非编码小分子RNA,可以降解或抑制靶基因的蛋白表达,在转录后水平调控中发挥重要作用[2]。前期通过miRNA芯片技术分析人外周血单核细胞向破骨细胞分化过程中差异表达的miRNA,并通过实时荧光定量PCR验证芯片结果中上调或下调的miRNA。发现hsa-miR-125a下调最为明显,结果提示hsa-miR-125a可能是诊断骨质疏松症的生物标志物,但其具体调控机制还不清楚。因此,本研究拟通过生物信息学分析方法预测hsa-miR-125a的靶基因及信号通路,为进一步分析hsa-miR-125a在骨质疏松发生、发展中的调控机制提供理论基础。
1 材料和方法
1.1 hsa-miR-125a的物种保守性分析 利用miRBase(http://www.mirbase.org)数据库检索hsa-miR-125a的序列并分析其物种保守性。
1.2 hsa-miR-125a的靶基因预测 通过TargetScan(http://www.targetscan.org)、miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/php/index.php)、miRDB(http://mirdb.org)这三个靶基因数据库在线预测hsa-miR-125a的靶基因,对三者所预测的结果绘制venny图,得到交集靶基因。
1.3 hsa-miR-125a预测靶基因的GO及KEGG信号通路富集分析 将hsa-miR-125a预测的靶基因集合,通过DAVID数据库,进行基因本体(Gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析。GO分析包括细胞组分(Cellular component,CC)、分子功能(Molecular function,MF)和生物过程(Biological process,BP)三个部分,P<0.01为差异有统计学意义。通过Fisher确切概率法计数基因集合生物通路的P值,P<0.05为差异有统计学意义。
2 结果
2.1 hsa-miR-125a的物种保守性分析 利用miRBase数据库在线检索人类、小鼠、大鼠等各种物种的miRNA序列进行比对,发现miR-125a-5p序列“UCCCUGAGACCCUUUAACCUGUGA”、miR-125a-3p“ACAGGUGAGGUUCUUGGGAGCC”在各物种间高度保守。
2.2 hsa-miR-125a的靶基因预测 TargetScan、miRTarBase、miRDB等3个靶基因预测数据库结果显示,hsa-miR-125a靶基因分别有3 821、432、132个;三者交集靶基因有122个。 结果见图1。
2.3 hsa-miR-125a预测靶基因的GO及KEGG分析 利用DAVID数据库对预测的122个交集靶基因进行GO和KEGG富集分析。GO分析结果表明,hsa-miR-125a的靶基因主要富集在细胞质基质、细胞核、细胞质等细胞组件。参与金属离子结合、蛋白质结合等分子功能。涉及细胞对DNA损伤刺激的反应、蛋白质泛素化的正调控等生物过程,结果见表1~3。KEGG信号通路分析结果表明hsa-miR-125a的靶基因信号通路显著富集于endocytosis signaling pathway、adherens junction signaling pathway、TGF-β signaling pathway、HIF-1 signaling pathway,结果见表4。
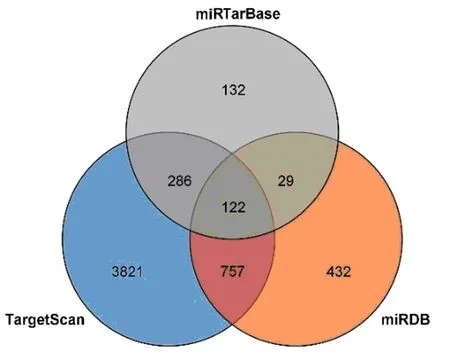
图1 miRTarBase、TargetScan、miRDB数据库交集靶基因

表1 has-miR-125a预测靶基因的细胞组分

表2 hsa-miR-125a预测靶基因的分子功能

表3 hsa-miR-125a预测靶基因的生物过程
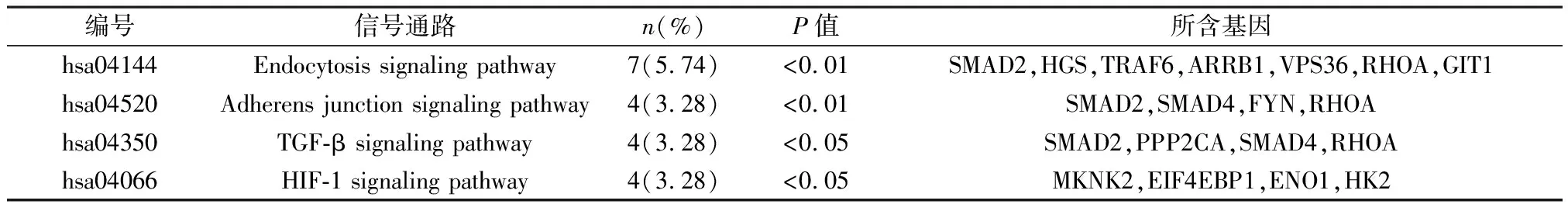
表4 hsa-miR-125a预测靶基因的KEGG信号通路分析
3 讨论
miRNA是小的非编码RNA,通过抑制mRNA翻译或促进mRNA降解在转录后水平调节基因的表达,在多种生理病理过程中发挥重要作用(包括肿瘤、心血管疾病、代谢性疾病等)[3]。多项研究[4-8]表明miRNA通过靶向不同的基因调节成骨细胞和破骨细胞的分化,从而参与骨质疏松疾病进程。前期研究证实hsa-miR-125a在破骨细胞分化过程中低表达,表明hsa-miR-125a可能是检测骨质疏松疾病的生物标志物。但是其具体的调控机制仍然不明确。因而,本研究通过miRBase数据库对hsa-miR-125a物种的序列保守性进行在线分析,检索发现其在多个物种中均高度保守,说明这一段序列可能对于生物体有重要的生物学功能。再利用miRTarBase、TargetScan、miRDB数据库预测hsa-miR-125a的靶基因,并通过DAVID数据库进行GO和KEGG富集分析,结果表明其生物过程主要集中在细胞对DNA损伤刺激的反应、蛋白质泛素化的正调控等方面。
在KEGG信号通路分析结果中发现,hsa-miR-125a主要富集在endocytosis signaling pathway、adherens junction signaling pathway、TGF-β signaling pathway、HIF-1 signaling pathway,其中TGF-β signaling pathway在骨重塑过程中发挥重要作用。在骨吸收过程中,先前埋在骨基质中的大量因子会释放到骨髓微环境中,从而导致骨髓间充质干细胞(MSC)的募集和分化,以用于随后的骨形成,在时间和空间上耦合骨重塑。破骨细胞骨吸收过程中基质TGF-β的释放与活化将MSC吸引到骨吸收部位,也就是说TGF-β的失调会改变MSC的命运,使骨骼重塑失衡引起诸如骨质疏松之类的骨骼疾病[9]。破骨细胞的分化主要受M-CSF信号、RANKL-RANK信号和基于免疫受体酪氨酸的活化基序(ITAM)依赖的共刺激信号这三个重要信号通路的调节[10]。除了这三个典型的信号通路之外,TGF-β1信号在动态骨环境中起着关键作用,以很大程度上取决于细胞分化阶段,TGF-β1浓度和其他培养条件的不同将会影响成骨细胞和破骨细胞的生长。例如,发现TGF-β1抑制成骨细胞分化,而TGF-β1的阻断导致成骨细胞数量增加[11]。另一项研究报道,TGF-β1诱导破骨细胞凋亡[12]。但是,TGF-β1在破骨细胞形成中的确切作用仍然很复杂。前人研究表明,在低浓度(1~100pg/ml)下,TGF-β1促进破骨细胞的形成,而在高浓度(0.1~10ng/ml)下,TGF-β1抑制破骨细胞的形成[13-14]。鉴于此,我们得知不同浓度的TGF-β1和培养方式将会影响破骨细胞的活性,所以hsa-miR-125a是否可以通过靶向TGF-β信号通路中不同的基因如:SMAD2、PPP2CA、 SMAD4、RHOA等来促进破骨细胞的形成和分化,进而加速骨质疏松症的进程,我们不得而知,还需要进一步的实验证明。
综上所述,本研究应用生物信息学分析方法预测了hsa-miR-125a的靶基因及信号通路,发现靶基因富集的信号通路TGF-β signaling pathway与破骨细胞分化密切相关。后期将以此作为理论及实验基础,进一步探索hsa-miR-125a在骨质疏松发生、发展过程中的调控机制。

