初发系统性红斑狼疮并发人巨细胞病毒感染的临床特点
罗欣,赵甲维,孙凯,王长燕,尤欣,宋红梅,张奉春,曾小峰
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种多系统受累的自身免疫性疾病,常累及脑、肾、血液、皮肤、关节等[1]。人巨细胞病毒(human cytomegalovirus, HCMV)是一种双链DNA病毒,属于人疱疹病毒5型家族,人群普遍易感,在世界范围内,成年人HCMV血清抗体阳性率在45%~100%之间[2]。在SLE患者中,HCMV血清阳性率高达90%[3];本中心HCMV感染是住院SLE患者最常见的机会性感染,约占61.1%[4]。
数十年来,不断有学者提出病毒感染可能诱发SLE发生和/或活动[5-6]。初发SLE患者并发HCMV感染的情况,目前国内尚未见报道。本研究筛选出65例初发SLE患者,比较了初发SLE并发单纯HCMV感染与未并发感染患者的临床特点和实验室检查的差异。
1 对象与方法
1.1 研究对象
2012年7月至2020年9月在北京协和医院住院的所有SLE患者中凡符合初发SLE定义, 且无任何一项排除标准, 纳入本研究。SLE的诊断需符合1997年美国风湿病学会修订的SLE分类标准[7]或2019年欧洲抗风湿病联盟(The European League Against Rheumatism,EULAR)和美国风湿病学会(American College of Rheumatology,ACR)修订的SLE分类标准[8]。初发SLE定义:(1)发病≤6个月;(2)初次诊断。
排除标准:(1)病史资料不全者;(2)接受糖皮质激素、免疫抑制剂或生物制剂治疗时间>7 d者;(3)除外病史资料中明确诊断的细菌、寄生虫、螺旋体、支原体、立克次体、衣原体感染以及并发其他病毒感染者;(4)外周血CMV DNA或CMV特异性IgM抗体或CMV pp65抗原检测,任意一项缺失者。
1.2 分组
根据是否并发HCMV感染分为初发SLE患者并发单纯HCMV感染组(感染组)和初发SLE未并发感染组(非感染组)。HCMV感染的定义[9-10]:CMV DNA检测阳性和/或CMV pp65抗原检测阳性或病理学活组织检测到典型的CMV包涵体,有或没有临床症状。通过实时荧光定量聚合酶链反应技术进行CMV DNA载量检测,CMV DNA检测阳性定义为病毒载量≥500拷贝/mL。通过单克隆抗体间接免疫荧光法检测CMV pp65抗原阳性的外周血白细胞,pp65抗原检测阳性定义为CMV pp65抗原阳性的外周血白细胞计数≥1个/2×105白细胞。因为CMV特异性IgM抗体常提示近期感染[11],所以非感染组应进一步除外单纯CMV特异性抗体阳性者。
1.3 数据采集
1.3.1 流行病学数据
性别、发病年龄、病程。
1.3.2 临床数据
(1)是否加用激素和/或免疫抑制剂;(2)开始用药距离入院时间;(3)临床表现:包括神经精神狼疮、视网膜病变、血管炎、肌炎、狼疮肾炎、皮肤黏膜病变、浆膜炎、发热、关节痛、肺间质改变、肺动脉高压、自身免疫性溶血性贫血,以及消化系统、心肌和平滑肌受累等临床表现;(4)SLE疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)-2000[12]。
1.3.3 实验室数据
(1)感染情况:外周血CMV DNA拷贝数、CMV pp65抗原、CMV特异性IgM抗体;(2)外周血白细胞计数、血小板计数、24 h尿总蛋白定量、补体水平、血沉、肝酶、直接抗人球蛋白试验、抗核抗体,抗dsDNA抗体滴度(ELISA法)、抗Smith(Sm)抗体,抗β2糖蛋白1抗体、抗心磷脂抗体、狼疮抗凝物。
1.4 统计学处理
2 结果
2.1 一般临床资料
检索2012年7月至2020年9月在北京协和医院住院的共计2 387例SLE患者,其中初发SLE 319例,进一步筛选出符合条件的感染组51例和非感染组14例(图1)。
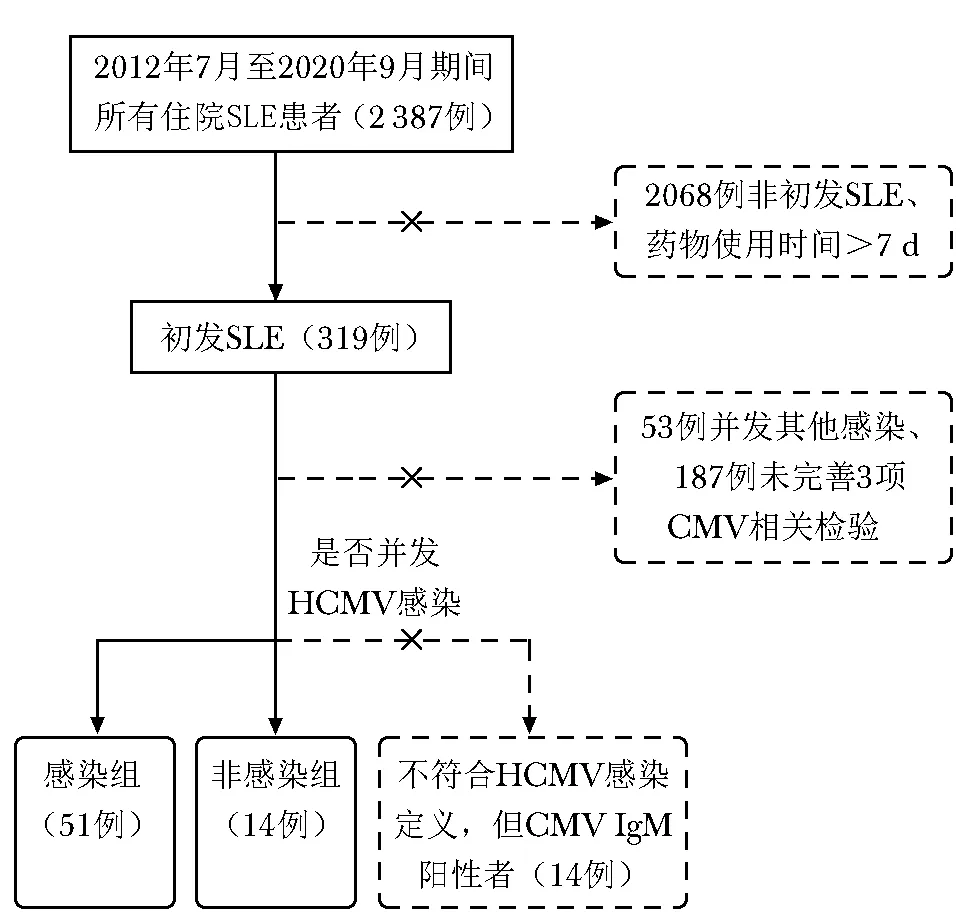
图 1 感染组与非感染组筛选流程
感染组所有患者均因为外周血CMV pp65抗原阳性而诊断HCMV感染,外周血CMV pp65抗原和CMV IgM均阳性占58.8%(30例)。
感染组和非感染组中女性患者比例、药物使用比例,差异无统计学意义(P>0.05)(表1)。感染组和非感染组药物使用平均时间分别为(2.10±2.90)d和(1.29±2.128)d(t=0.976,P=0.333)。两组发病年龄非正态分布,根据直方图判断两组发病年龄分布形状相似,感染组发病年龄中位数为10.0岁,非感染组发病年龄中位数为18.5岁,两组发病年龄差异有统计学意义(U=236.500,P=0.047)(表1)。
2.2 临床表现
感染组关节痛发生率显著高于非感染组(52.9%vs. 7.1%,P=0.002)。比较感染组与非感染组神经精神狼疮、视网膜病变、血管炎、肌炎、狼疮肾炎、浆膜炎、皮肤黏膜受累、肺间质改变、肺动脉高压、消化系统受累、心肌受累、平滑肌受累、发热、自身免疫性溶血性贫血,发生率差异均无统计学意义(P>0.05)(表2)。非感染组无肌炎、肺间质改变、消化系统受累和平滑肌受累情况。
2.3 SLE病情活动度
感染组SLEDAI平均值为(19.00±9.63),非感染组SLEDAI平均值为(11.57±6.19),感染组和非感染组SLEDAI差异有统计学意义(t=2.728,P=0.008)。
2.4 实验室检查
感染组低补体血症发生率(98.0%vs. 71.4%)及抗dsDNA抗体阳性率(94.1%vs. 28.6%)显著高于非感染组(P<0.05)(表3)。在低补体血症的病例中,感染组C3平均值(0.336±0.149)g/L明显低于非感染组(0.505±0.178)g/L(t=-3.162,P=0.003)。但感染组补体C4平均秩次为25.96,非感染组补体C4平均秩次为33.86,Mann-WhitneyU检验结果显示,感染组与非感染组补体C4差异无统计学意义(U=113.000,P=0.207)。感染组抗dsDNA滴度平均值为(576.51±250.50)IU/mL,非感染组抗dsDNA滴度平均值为(66.71±110.06)IU/mL。感染组抗dsDNA抗体滴度平均秩次(1 999.00)明显高于非感染组(146.00)(U=41.000,P<0.001)(图2)。
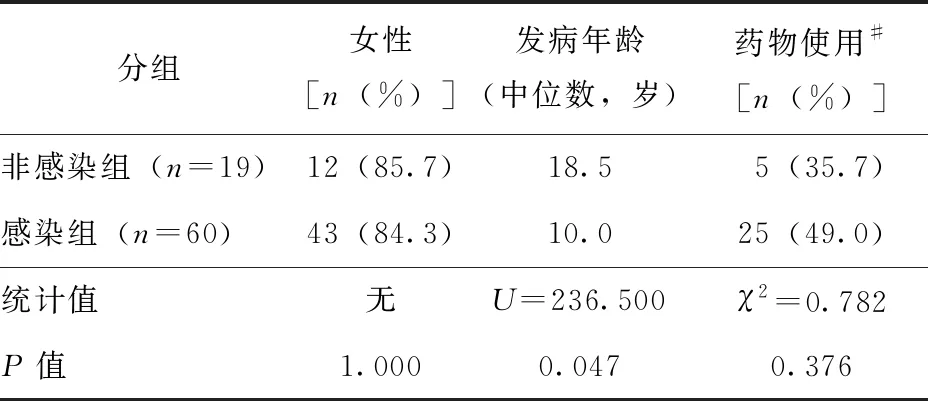
表1 感染组和非感染组一般临床资料
2.5 多因素分析
二项Logistic回归模型具有统计学意义,χ2值=41.303,P<0.001。该模型能够正确分类93.8%的研究对象。模型的敏感度为96.1%,特异度为85.7%,阳性预测值为96.1%,阴性预测值为85.7%。模型纳入的5个自变量中,抗dsDNA抗体滴度有统计学意义,比值比为1.009(95%置信区间为1.002~1.016,P=0.012),抗dsDNA抗体滴度升高,初发SLE并发HCMV感染的发生率明显增加(表4)。
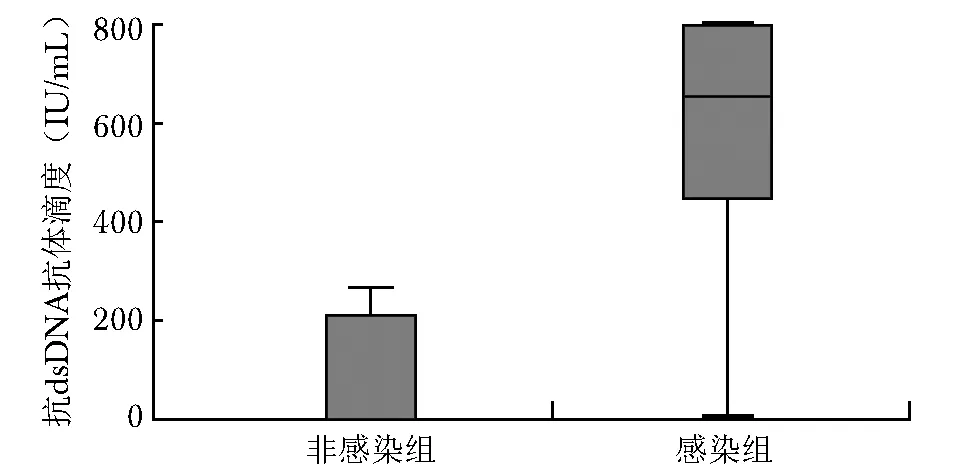
图 2 抗dsDNA抗体滴度箱图
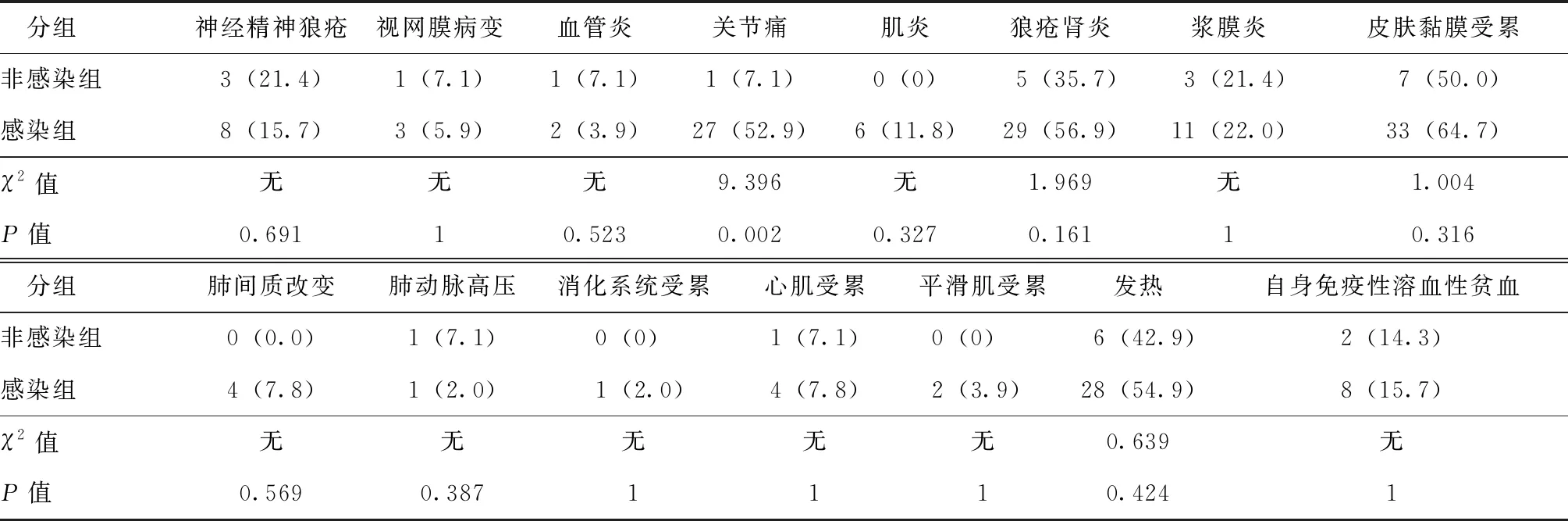
表2 感染组和非感染组临床表现
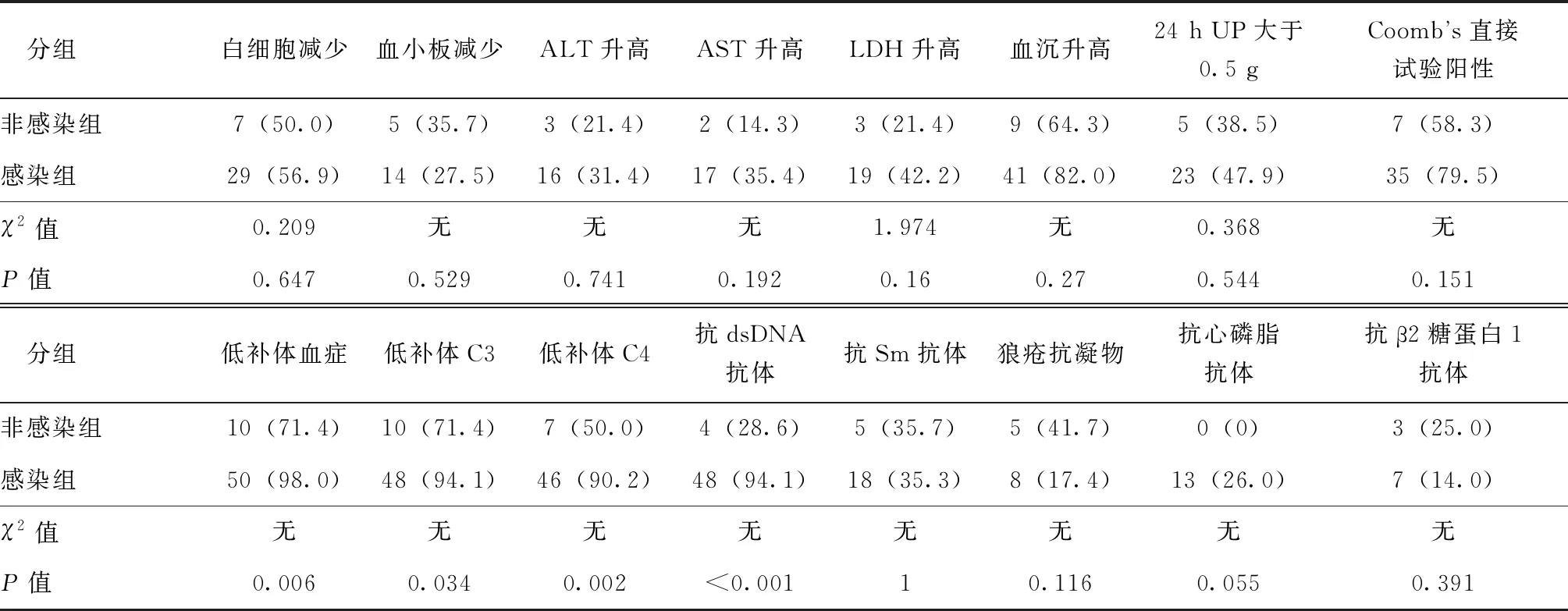
表3 感染组和非感染组实验室检查
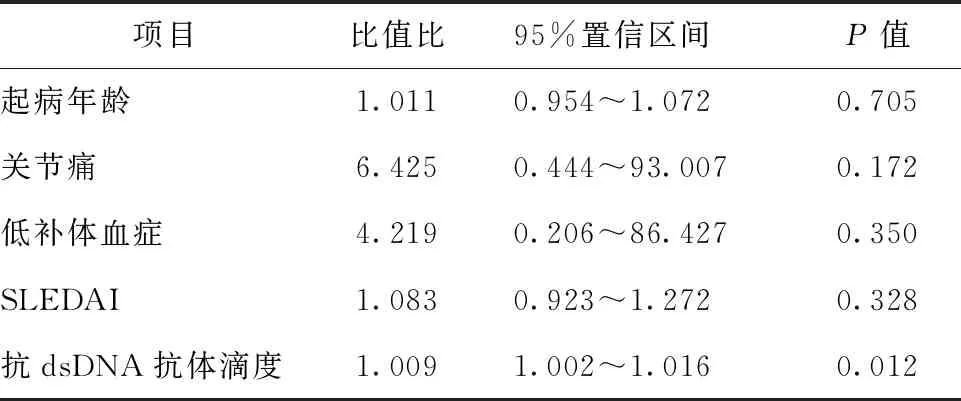
表4 初治SLE并发HCMV感染危险因素的多因素分析
3 讨论
本研究是针对初发SLE并发单纯活动性HCMV感染患者所进行的横断面研究。因激素和免疫抑制使用、并发其他感染是住院SLE患者并发HCMV感染的主要危险因素[9, 13],故本研究除外了激素、免疫抑制剂和或生物制剂使用时间大于7 d,以及并发其他感染的病例,更能够为HCMV感染可能作为环境因素诱发SLE起病提供临床证据支持,同时也为临床医师评估初发SLE提供参考依据。
本研究从319例初发SLE患者中,剔除并发其他感染53例、未完善3项CMV相关检测187例,筛选出初发SLE并发单纯HCMV感染51例,提示初发SLE并发单纯HCMV感染的情况并不罕见。值得注意的是,感染组中无CMV DNA阳性患者。本院另一项回顾性研究显示,在115例诊断HCMV感染的SLE患者中CMV DNA检测阳性者有40例(35.4%),30天内激素累积剂量越大,SLE并发HCMV感染率越高[9]。故本研究中未发现CMV DNA阳性者,考虑与未使用激素、免疫抑制剂等药物或用药时间短相关。在国外一项儿童系统性红斑狼疮回顾性研究中,仅7例患者在初诊SLE的1个月内发现巨细胞病毒感染(7/640,1.04%)[14],此7例因血、尿或肺泡灌洗液检测CMV DNA阳性而诊断。该回顾性研究之所以诊断HCMV感染病例数少,可能与未检测CMV pp65有关。其他关于初发SLE并发HCMV感染相关研究仅为个案报道[5, 15-17]。本研究感染组的所有患者均因为外周血CMV pp65抗原阳性而诊断HCMV感染。既往研究结果亦提示外周血CMV pp65抗原检测的敏感性更高[18]。因此,建议临床医师对于初发SLE患者,应检测外周血CMV pp65抗原,以提高HCMV感染检出率。
本研究感染组发病中位年龄(10岁)小于非感染组(18.5岁)。上述回顾性研究中7例患者平均年龄为14岁[14],其他个案报道分别为12、16、22及43岁[5, 15-17]。在这些报道中,患者年龄普遍为青少年,本研究及既往研究均提示HCMV感染与早发SLE相关。
本研究单因素分析结果显示感染组患者更易出现关节痛(52.9%),既往报道的11例患者中8例出现关节痛[5, 14-17]。有病例报道在肾移植后患者关节积液发现CMV-DNA阳性[19],在一些类风湿关节炎患者的滑膜液也发现了HCMV的早期抗原,提示病毒复制[20]。实际在急性关节炎中,病毒性关节炎仅占1%[21],患者的关节炎临床表现是否为病毒感染直接所致尚未可知。推测HCMV感染可能为SLE关节炎症的诱因之一。
其他脏器受累,感染组和非感染组比较,差异无统计学意义。但有动物实验证明,SLE患者产生的抗CMV pp65422-439抗体能与多种细胞核成分如dsDNA发生交叉反应,使BALB/c小鼠出现早期狼疮肾炎表现,如肾小球可见补体C3和免疫球蛋白沉积[22-23]。本研究感染组中确实观察到抗dsDNA水平更高、补体水平更低。早在上世纪就发现抗dsDNA抗体可与肾小球基底膜结构结合产生致病性,但有学者指出能与dsDNA结合的抗体不等于能够产生致病性的抗dsDNA抗体[24]。故HCMV感染是否能诱发或加剧人体的狼疮肾炎尚有争议。
根据临床经验和既往研究结果[18],当SLE患者出现白细胞减少、血小板减少、发热、肝功能异常时应高度怀疑巨细胞病毒感染。但在本研究中未发现感染组较非感染组存在以上差异。可能与初发SLE本身处于疾病活动期,原发病尚未控制,与HCMV感染临床表现呈现出相似性有关。此外,也与本研究的样本量尚少有关。
关于SLE疾病活动度,本研究采用SLEDAI进行评估。结果显示感染组SLEDAI平均值大于非感染组[(19.00±9.63)vs. (11.57±6.19)],与既往关于SLE患者并发HCMV感染研究结果[25-26]一致。结合单因素分析结果,HCMV感染可能诱发关节炎症,同时使抗dsDNA抗体水平升高和低补体血症发生率增加,所以使SLEDAI总评分增加,即疾病活动度增加。另一方面,重度活动的初发狼疮是否存在机体免疫功能紊乱加重,从而对HCMV感染更加易感或潜伏HCMV感染更易激活的情况,目前尚无相关总结。今后需通过分析外周血淋巴细胞亚群的数目和功能,以及免疫球蛋白水平等全面评估免疫紊乱的程度,以进一步探究。
多因素分析提示抗dsDNA抗体升高为初发SLE并发HCMV感染的独立危险因素。结合单因素分析结果及箱图(图2),感染组与非感染组抗dsDNA抗体滴度在数值分布上存在明显差异,提示当初发SLE合并高水平抗dsDNA抗体滴度时,应注意筛查有无HCMV感染。
综上,本研究发现SLE起病前或起病时即出现HCMV感染这一情况并不罕见。但在初发SLE并发HCMV感染患者中,CMV DNA阳性率低,可通过检测外周血CMV pp65抗原以提高HCMV感染的检出率。这些患者起病更早,关节痛更加常见,同时实验室检查抗dsDNA抗体滴度更高、补体C3水平更低,这可能与并发HCMV感染时SLE患者病情更严重相关。

