IgE高亲和力受体在树突状细胞和单核细胞的表达和意义
郑峥妮,刘文英,冯树晶,宋志强
IgE高亲和力受体(high affinity IgE receptor,FcεRI)在人肥大细胞和嗜碱性粒细胞稳定表达,对IgE具有高亲和力(Kd =10-10M),FcεRI单体形式即可结合IgE[1]。致敏物质可引起细胞表面IgE/FcεRI复合物交联,从而引起细胞内信号级联反应,使肥大细胞和嗜碱性粒细胞向外释放多种炎症介质,是导致变态反应疾病的重要因素。研究者还发现FcεRI也在树突状细胞(dendritic cells,DCs)和单核细胞上表达[2]。FcεRI在DCs和单核细胞的表达与肥大细胞和嗜碱性粒细胞不同,在DCs和单核细胞中,由于基因表达调控的差异以及其他因素的影响,FcεRI容易发生内吞或表达下调,在细胞膜表面难以维持长期稳定[3]。这也决定了FcεRI介导DCs和单核细胞免疫反应的机制与肥大细胞和嗜碱性粒细胞不尽相同。 FcεRI 在DCs和单核细胞表面的稳定性和激活状态对于其介导下游免疫反应具有十分重要的影响,多种因素决定着FcεRI在细胞膜的表达。本文主要归纳FcεRI在DCs和单核细胞细胞表面的表达及相关机制,同时还总结FcεRI参与DCs和单核细胞介导的免疫反应及其在疾病中的作用。
1 FcεRI在DCs及单核细胞表面的表达及其分子结构
DCs是最有效的抗原提呈细胞(antigen presenting cells,APCs),一般分为传统树突状细胞(conventional dendritic cells,cDCs)和浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)两种亚型[4]。DCs广泛分布于皮肤、气道、淋巴器官等部位,不同组织中的DCs有不同的名称。如分布于皮肤基底层和棘细胞之间的DCs称为朗格汉斯细胞(langerhans cells,LCs),特应性皮炎(atopic dermatitis,AD)患者皮损内还发现炎症性树突状表皮细胞(inflammatory dendritic epidermal cells,IDECs)[5]。单核细胞是机体血液中单个核吞噬细胞,可分为经典型、中间型、非经典型3种亚型[6],在机体免疫应答和炎症反应中具有重要作用。
FcεRI最早被发现主要在肥大细胞及嗜碱粒细胞的表面表达,可结合IgE并产生一系列变态反应症状。1992年,Bieber等[7]通过免疫组化和流式细胞学研究发现:表皮细胞中被抗CD1a抗体(LCs标志物)标记的细胞也可以被抗FcεRIα抗体和IgE标记;免疫胶体金标记电子显微研究也表明,细胞液中含有LCs特异性标志Birbeck颗粒的表皮细胞可同时被抗FcεRI抗体结合金颗粒修饰,从而首次发现FcεRI在人类LCs表面表达。随后,研究者们在呼吸道、口腔黏膜、呼吸道黏膜及胃肠道等周围组织中的LCs都检测到了FcεRI的表达[8]。1994年,Maurer等发现过敏体质者血液中的单核细胞可以结合单体IgE,从而证实单核细胞表面表达FcεRI[9],后来健康者的血液单核细胞表面也发现FcεRI的表达。
人类肥大细胞和嗜碱性粒细胞表面的FcεRI是四聚体, 而DCs和单核细胞表面的FcεRI是三聚体结构,由1个α亚基和2个γ亚基组成,无β亚基。α亚基是跨膜蛋白,结合IgE形成1∶1复合体IgE-FcεRI。结合到FcεRIα上的IgE有独特的弯曲构象变化,使IgE从FcεRI离解速率非常缓慢。γ亚基连接Fc受体(如FcγRⅠ),通过N端的半胱氨酸二硫键连接形成二聚体,γ亚基N端氨基酸有ITAM基序,ITAM基序磷酸化后激活Syk酶,通过Lyn-Syk-LAT1和Fyn-PI3-K-Akt途径,产生促炎因子或其他细胞因子[10]。
虽然距发现FcεRI能在DCs和单核细胞表达已有20余年,其机制功能仍未完全清楚。人类DCs和单核细胞表面表达FcεRI,而啮齿类动物的DCs和单核细胞不表达FcεRI。研究者使用基因工程技术培养出小鼠品系[11],可以在DCs和或单核细胞表达人类FcεRI,可以帮助研究者进一步研究人体DCs和单核细胞上FcεRI的功能。
2 影响FcεRI在DCs和单核细胞表达的因素
FcεRIα亚基在细胞内合成后,需要一定条件才能被转运到细胞表面。FcεRI在DCs和单核细胞表面并不稳定,容易发生内吞。多种因素影响FcεRI在细胞表面的表达,包括DCs和单核细胞的成熟度、类型、组织分布,以及DCs和单核细胞所处局部微环境中的刺激因子如IgE、IL-4、血浆总IgE水平等[12]。
2.1 FcεRI的表达调控
研究表明,人脐带血干细胞中的CD34+祖细胞可诱导培养LCs(CD34+LC),该细胞表面模式识别受体TLR1/2或TLR2/6的激活可显著下调FcεRI的α亚基及γ亚基的 mRNA和蛋白水平[13]。进一步对可能调控FcεRI基因的转录因子分析发现,CD34+LCs中PU.1的表达较高,而其他转录因子如ELF1和YY1的表达较弱。同时,TLR2激活后PU.1的表达明显降低,ELF1和YY1没有明显变化。说明TLR2激活后通过下调转录因子PU.1进而下调FcεRI基因的表达。此外,该研究团队还观察到TLR2、TLR4的激活可诱导CD34+LC产生miRNA-155,可靶向降低FcεRI的转录因子PU.1,从而进一步降低DCs上的FcεRI水平[14]。也有研究认为TLR2激动剂Pam3CSK4通过诱导p38磷酸化,上调重度AD患者体内的单核细胞上FcεRI的表达[15]。IL-4诱导CD1a+LCs或 DCs细胞质中FcεRIα亚基表达,还能增强CD1a+LCs或 DCs的生成,并增强皮肤归巢结构E-钙黏蛋白和皮肤淋巴细胞抗原的表达。IFN-γ是IL-4的强力拮抗剂,能够抑制E-钙黏蛋白的表达,并抑制CD1a+细胞的产生[16]。此外,体外培养条件下添加高剂量外源性TGF-β1(10 ng/mL)会使CD1a+DCs表面FcεRI降低,而低剂量TGF-β1(0.5 ng/mL)可稳定CD1a+DCs上的表面FcεRI表达;TGF-β1浓度的增加会导致类LCs的DCs的产生[17]。Herrmann等[18]通过体外细胞实验发现,维生素D3通过抑制转录因子与其启动子的结合直接降低树突状细胞上FcεRI的表达,进而抑制IgE介导的信号传导。FcεRI的表达调控尚未完全阐明,还需要深入的研究探索。
2.2 FcεRI的合成与转运
FcεRIγ亚基能促进内质网上FcεRIα亚基的释放,促使α亚基在细胞表面表达,因此γ亚基影响细胞膜上FcεRI的数量。AD患者外周血中单核细胞发育而来的DCs表面可检测到大量FcεRI,这可能是因为该DCs也高表达FcεRIγ亚基,促进了FcεRIα亚基从内质网移出,使FcεRI转运至细胞膜。而同样条件下健康患者外周血单核细胞培育的DCs则低表达FcεRIγ亚基,因此表面的FcεRI也较低[19]。人体外周血的血液树突状细胞抗体(blood dendritic cell antigen,BDCA)1+DCs同时表达FcεRIα和FcεRIγ,其细胞膜表面FcεRI的表达水平很高[3],而BCDA1+DCs内质网和高尔基体中均未发现FcεRIα或FcεRIα前体,因此认为BCDA1+DCs内FcεRI合成运输效率很高,迅速成熟并且迅速转运至细胞膜。
2.3 FcεRI的内吞
IgE结合嗜碱性粒细胞细胞FcεRI后可抑制FcεRI内吞和降解,使细胞表面FcεRI表达增加。DCs和单核细胞的FcεRI与IgE抗体结合后迅速发生内吞,并运输至溶酶体并分解。DCs有可能以不依赖交联的方式使FcεRI-IgE结合体进入细胞。在肥大细胞或嗜碱性粒细胞中未观察到这种IgE的内吞作用,因此DCs和单核细胞可能有运行独特的机制内吞FcεRI并运送至溶酶体,从而促进血清IgE清除。有研究分析27名1-15岁健康儿童血液DCs发现:DCs表面结合的IgE和cDCs上FcεRI的表达存在复杂的关系,血清IgE值达到一定水平后才与cDCs表面的FcεRI有关联[20]。成人体内DCs和嗜碱性粒细胞上FcεRI的表达因血清IgE水平的不同而变化。嗜碱性粒细胞上的FcεRI表达会因为血清IgE的水平增高急剧增多,而DCs上的FcεRI变化相对平稳[3],说明嗜碱性粒细胞FcεRI完全取决于细胞外IgE水平,而DCs表面FcεRI的水平相对稳定。
3 FcεRI/IgE的信号传导
肥大细胞中FcεRI介导的信号传递已经明确,FcεRIγ亚基介导、β亚基放大Syk酪氨酸激酶激活[21]。而DCs和单核细胞由于缺乏FcεRIβ亚基, FcεRI信号传导需要大量FcεRI交联。生理情况下,由于健康人体内DCs和单核细胞持续的FcεRI内吞,大量FcεRI交联很难实现。研究发现,过敏性疾病个体内特异性IgE(sIgE)增高,LCs表面表达FcεRI数量较健康者大量增多,在这种特殊情况下FcεRI交联增多,增高的sIgE结合FcεRI后又同时识别统一抗原发生交联,可引起LCs酪氨酸激酶磷酸化、钙动员并激活LCs[22],同时也可激活LCs、单核细胞及单核细胞来源的DCs胞内的NF-κB,介导TNF-α和MCP-1(CCL-2)的合成和释放,从而促进炎症反应。健康者血液体外实验表明,单核细胞和DCs表面FcεRI的交联能促进TNF-α和IL-6合成[23]。仙台病毒感染诱导特应性小鼠模型、过敏性个体及非过敏性个体血液体外实验均发现cDCs表面FcεRI交联后可释放CCL-28[14]。体外实验发现,AD患者血液中单核细胞来源的炎性DCs表面FcεRI交联后产生 IL-12及IL-18[24]。DCs和单核细胞的FcεRI交联信号传导可能通过释放炎症因子和趋化因子招募和激活多种炎症细胞,促进炎症反应(图1A)。
此外,FcεRI信号传导可能还具有抗炎和免疫抑制作用(图1A)。体外实验发现,血液高IgE浓度人群单核细胞表面IgE交联后,细胞的吞噬作用降低。DCs和单核细胞的FcεRI交联能产生高剂量抗炎性细胞因子IL-10,降低TNF-α的生成。体外实验发现,有过敏性疾病家族史个体血液单核细胞在FcεRI交联后的一段时间上吲哚胺2,3-双加氧酶(IDO)增加,色氨酸分解代谢增加,抑制T细胞的增殖,而培养中加入色氨酸或者IDO抑制剂则不再抑制T细胞增殖[25]。也有体外实验发现FcεRI交联可使过敏性个体及非过敏性个体血液pDCs中IFN-α和IFN-β合成减少,TLR7或TLR9转录减少[26]。体外单核细胞来源DCs的FcεRI交联可抑制TLR 4配体脂多糖(LPS)介导的CCL-2合成[27]。对脐带血(cord blood, CB)中mDCs(CB mDCs)的体外研究发现,当抗FcεRI抗体与LPS共同刺激CB白细胞时,CB mDCs产生的促炎因子TNF-α明显减少,抗FcεRI抗体数量越多,FcεRI交联增多,TNF-α的下降越明显[28]。Leon等[29]发现,感染幽门螺杆菌的儿童患特应性疾病的可能性和严重程度降低,可能是因为感染幽门螺杆菌后,患儿外周血DCs表面 FcεRI表达增多,进而诱导Treg细胞生成,从而调节并缓解过敏反应。
因此,IgE /FcεRI在DCs 炎症信号传递中既存在促炎作用,还存在抑制炎症的作用,这可能与DCs表面的FcεRI表达量有关,也可能与组织部位、邻近细胞、细胞因子及信号传导中所处局部微环境中的刺激因子有关,尚需进一步研究。
4 FcεRI和免疫耐受
将人类IgE Fc段与OVA多肽抗原共价结合组成OVA-Fcε二聚体并注射至hFcεRIα-Tg小鼠体内,DCs可将该抗原呈递给未成熟的T细胞,引起T细胞短暂增殖。随后小鼠体内抗原特异性T细胞减少直至消失,且对后续的抗原刺激耐受,未发生T细胞迟发型超敏反应[30]。这说明FcεRI可促进DCs对IgE结合的抗原的提呈。如果IgE结合的抗原没有进一步与FcεRI交联,这一抗原提呈将引起抗原特异性T细胞耐受(图1B)。无FcεRI交联的抗原-Fcε提呈可引起特异性T细胞耐受。这一观点有待进一步证实,它可能与组织损伤后IgE产生及其在免疫调节中的潜在作用有关,可能是也可能与DCs的成熟状态有关。从抗原-IgE与DCs上FcεRI靶向结合这来研究诱导人体抗原特异性T细胞免疫耐受的方法,可能会发展新的治疗策略。
脱敏治疗是目前临床上治疗过敏性疾病的一种手段,通过患者反复接触小剂量变应原刺激,提高对变应原的耐受程度。Berings等[31]发现,屋尘螨过敏患者在皮下免疫治疗(SCIT)中血清IgE一过性增加,与DCs的FcεRI表达峰值同时出现。过敏性疾病患者皮下注射过敏原特异性免疫治疗(AIT)1年后,外周血CD123+DCs较非过敏性个体增多,且其表面FcεRI表达增多,而CD141+DCs的CD206和Dectin-2的表达降低,同时CD1c+DCs的CD206和Dectin-1的表达也降低。过敏性疾病患者CD141+DCs上的DNGR1/CLEC9A表达增加,达到了与非过敏个体中的细胞相似的水平[32]。脱敏治疗观察到的DCs表型改变、特定DCs亚群的出现及细胞表面FcεRI表达增加表明DCs亚群与变应原相互作用的能力发生了改变,DCs表面FcεRI表达与免疫耐受的建立有关[33]。脱敏治疗诱导DCs表面FcεRI表达的增加,可能是对DCs上IgE /FcεRI信号转导在变应原脱敏治疗的潜在致耐受作用研究的一个切入点。
5 DCs和单核细胞表面表达FcεRI与临床疾病的关系
5.1 特应性皮炎
特应性皮炎(AD)是一种慢性复发性、炎症性、瘙痒性皮肤病,通常伴有高水平的总IgE和过敏原特异性IgE[34]。FcεRI信号传递在AD的炎症反反应中起到重要的促进作用,AD患者皮损处浸润的LCs和IDEC都高表达FcεRI。同时,AD患者血液中单核细胞FcεRI的表达也较健康人高,可能是皮损处DCs的来源[35-36]。FcεRI可协助LCs进行抗原的吞噬和呈递,通过FcεRI捕获特异性变应原并活化后,LCs可招募和激活T细胞,介导炎症反应的起始[37]。大量IDEC在炎症急性期浸润皮肤,FcεRI交联介导IDEC激活后可释放前炎症因子(如IL-12及IL-18)[24],扩大炎症反应。有研究者发现通过6-甲酰基吲哚并[3,2-b]咔唑(FICZ)激活芳烃受体(AhR)会降低表皮LCs上的FcεRI,并上调LC中色氨酸降解酶吲哚胺2,3双加氧酶(IDO)的表达,这种AhR介导的抗炎反馈机制可能会减轻过敏原引起的AD炎症[38]。还有研究发现,AD患者血液中单核细胞FcεRIγ基因调控序列的乙酰化,使单核细胞表面的FcεRI表达上调,促进AD的发生发展[39]。
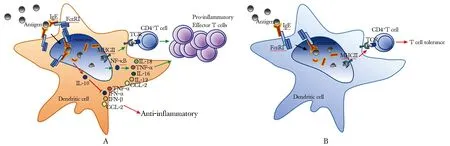
图 1 FcεRI介导树突状细胞信号传导通路示意图
5.2 哮喘
哮喘(asthma)是一种慢性肺部炎症疾病,以气道的高反应性和过量黏液产生为特点。Leffler等[40]对7~15岁学龄儿童的研究发现,与非过敏性个体相比,过敏性个体体内表达FcεRI的DCs比例增多,在调整血清IgE水平后,伴有哮喘的过敏性个体pDCs及cDCs表面FcεRI的表达较不伴有哮喘的过敏性个体升高。哮喘炎症反应与血清总IgE和抗原特异性IgE正相关,也与气道中表达FcεRI的DCs和单核细胞正相关[41]。表达FcεRI的DCs的浸润与Th2高反应型哮喘有关,Th2高反应型哮喘与Th2低反应性哮喘相比,嗜酸性粒细胞浸润以及皮下纤维化更明显,FcεRI可能促进了Th2炎症和哮喘的相关病理改变。
5.3 变应性鼻炎
变应性鼻炎(allergic rhinitis)是一种过敏性上呼吸道疾病,以阵发性打喷嚏、鼻塞、流清涕为特点。DCs在调节过敏性气道炎症中起重要作用,过敏原刺激鼻黏膜后,鼻黏膜单核细胞分化为DCs或未成熟DCs募集,使DCs增高,捕获抗原并加工呈递给T细胞。Berings等[31]发现变应性鼻炎患者接受皮下免疫疗法,血清IgE与DCs上FcεRI峰值同时出现,说明DCs表面FcεRI信号传导在变应性鼻炎治疗中发挥重要作用。
5.4 肿瘤
肿瘤是机体局部组织的某类细胞异常增生形成的新生物。近年来有观点认为,肿瘤的发生发展与机体免疫失调有关,位于肿瘤微环境中的DCs和单核细胞分化和成熟能力受损,导致抗肿瘤的适应性免疫反应减弱,引起肿瘤细胞的免疫逃逸[42]。有体外研究发现,IgE与DCs表面FcεRI介导肿瘤抗原摄取,并交联呈递至幼稚T细胞,T细胞的局部活化,能够诱导抗肿瘤适应性免疫反应[43]。越来越多的证据证实,识别肿瘤的癌症相关抗原的抗IgE抗体有望用于临床肿瘤治疗,此类独特的效应机制能为治疗癌症提供新的方向。
DCs和单核细胞表面FcεRI增高已经被证实与多种变应性疾病正相关,此外,DCs表面FcεRI与IgE交联还能够诱导抗肿瘤作用。还有近年投入临床使用的奥马珠单抗是一种抗IgE抗体,能够针对IgE/FcεRI信号传递通路,特异性地结合IgE,从而下调血清游离IgE及DCs表面FcεRI表达水平[44-45],对重度AD、重度过敏性哮喘、慢性荨麻疹(CSU)等疾病起到积极治疗作用[46-47]。抗IgE抗体作为一种新型治疗方式,在肿瘤治疗中也具有潜在的应用价值[48]。
6 小结
FcεRI可在人类DCs和单核细胞表面表达,IgE/FcεRI复合体与抗体结合后被快速内吞入胞至溶酶体降解。当抗原-IgE与FcεRI结合,可增强DCs和单核细胞内吞、处理、提呈抗原的能力。抗原提呈过程中如果没有FcεRI交联,抗原提呈后将清除自身反应性T细胞或产生免疫抑制性调节性T细胞,从而有助于建立和保持免疫耐受;相反,如果伴有FcεRI交联,抗原提呈后则可诱导幼稚T细胞增殖分化成Th1、Th2、或Th17细胞,启动、促进免疫反应。除了抗原提呈外,FcεRI交联还介导细胞内信号传导,根据组织位点、邻近细胞、细胞因子在内的环境因素的不同,进而促进或抑制免疫反应。DCs和单核细胞表面的FcεRI参与多种变应性疾病的发生发展,最近有研究报道FcεRI还可以协助DCs发挥抗肿瘤作用。然而,DCs和单核细胞表面FcεRI的功能尚未完全阐明,随着未来更多研究探索,将为变应性疾病及肿瘤的个体化治疗提供新的方向。

