青龙衣化学成分和药理作用研究进展及质量标志物的预测分析
陈乐乐,李珩玉,周祥禄,陈曙光,展照双,王加锋
青龙衣化学成分和药理作用研究进展及质量标志物的预测分析
陈乐乐,李珩玉,周祥禄,陈曙光,展照双*,王加锋*
山东中医药大学,山东 济南 250355
查阅近年来国内外相关文献,在对青龙衣化学成分及现代药理作用研究的基础上,根据中药质量标志物(Q-Marker)概念,从化学成分与亲缘关系、传统药效与药性及成分可测性、采收时期和干燥方法等方面,对青龙衣Q-Marker成分进行预测分析,发现胡桃醌、胡桃酮、绿原酸、核桃素A、核桃素B、马尾树素可作为青龙衣的Q-Marker,后续可选择以上成分作为指标,为青龙衣质量评价体系的建立提供参考。
青龙衣;胡桃醌;胡桃酮;绿原酸;核桃素A;核桃素B;马尾树素;Q-Marker;预测分析
青龙衣为胡桃科(Juglandaceae)胡桃属L.植物核桃L.和核桃楸Maxim未成熟果实的干燥外果皮,最早记载于《开宝本草》,名为“胡桃青龙”,《救急方》中称之“青胡桃皮”,《山东中草药手册》中称其为“青龙衣”,后多沿用此名。其味苦、涩,性平;归肝、脾、胃经,具有止痛、止咳、止泻、解毒、杀虫等功效,可用于脘腹疼痛、痛经、久咳、泄泻久痢、痈肿疮毒、顽癣、秃疮、白癜风等[1]。现代药理研究表明青龙衣具有抗肿瘤[2]、抗病毒[3-4]、抗氧化[5-6]、抗菌[7]、杀虫[8]、镇痛[9]等作用。化学研究表明,青龙衣含有萘醌类[10]、二芳基庚烷类[11]、黄酮类[12]、萜类[13]和多酚类[14]等成分。其中,萘醌类化合物具有抗炎、抑菌及较为显著的抗癌活性,被认为是青龙衣的主要活性成分[10]。近年来青龙衣因其广泛的生物活性而备受关注,但由于研究基础薄弱,对药材和制剂质量控制体系等相关研究不完善,导致青龙衣药效物质基础不明确,药材质量难以得到保障,现代临床应用和推广受到极大限制。本文在对青龙衣化学成分及药理作用进行综述的基础上,结合中药质量标志物(Q-Marker)定义,从化学成分与亲缘关系、传统功效、中药药性及成分可测性等方面分析预测青龙衣的Q-Marker,以期为青龙衣质量控制标准研究提供科学依据。
1 化学成分
青龙衣含多种化学成分,主要包括萘醌类、黄酮类、二芳基庚烷类、多酚类、萜类等成分。
1.1 萘醌类化合物
萘醌类化合物有α(1,4)、β(1, 2)及amphi(2,6)3种结构类型,但天然存在的大多为α-萘醌类衍生物,具有抗癌、抑菌、杀虫等多种药理活性。萘醌类化合物是青龙衣主要的抗癌活性成分[10],目前,已从青龙衣中分离鉴定出多种萘醌类衍生物,按结构骨架可分为A、B、C、D 4种类型,其中A型为主要化学成分,其1、4位均为羰基,2、3位为双键;B型结构化合物,其1位是羰基,3、4位是双键;C型结构化合物,1位为羰基;D型结构化合物含碳1(2)和碳3(4)共轭双键,且1位和4位均为含氧基团。具体结构骨架见图1,化合物名称及取代基见表1。

图1 青龙衣中萘醌类化合物结构骨架
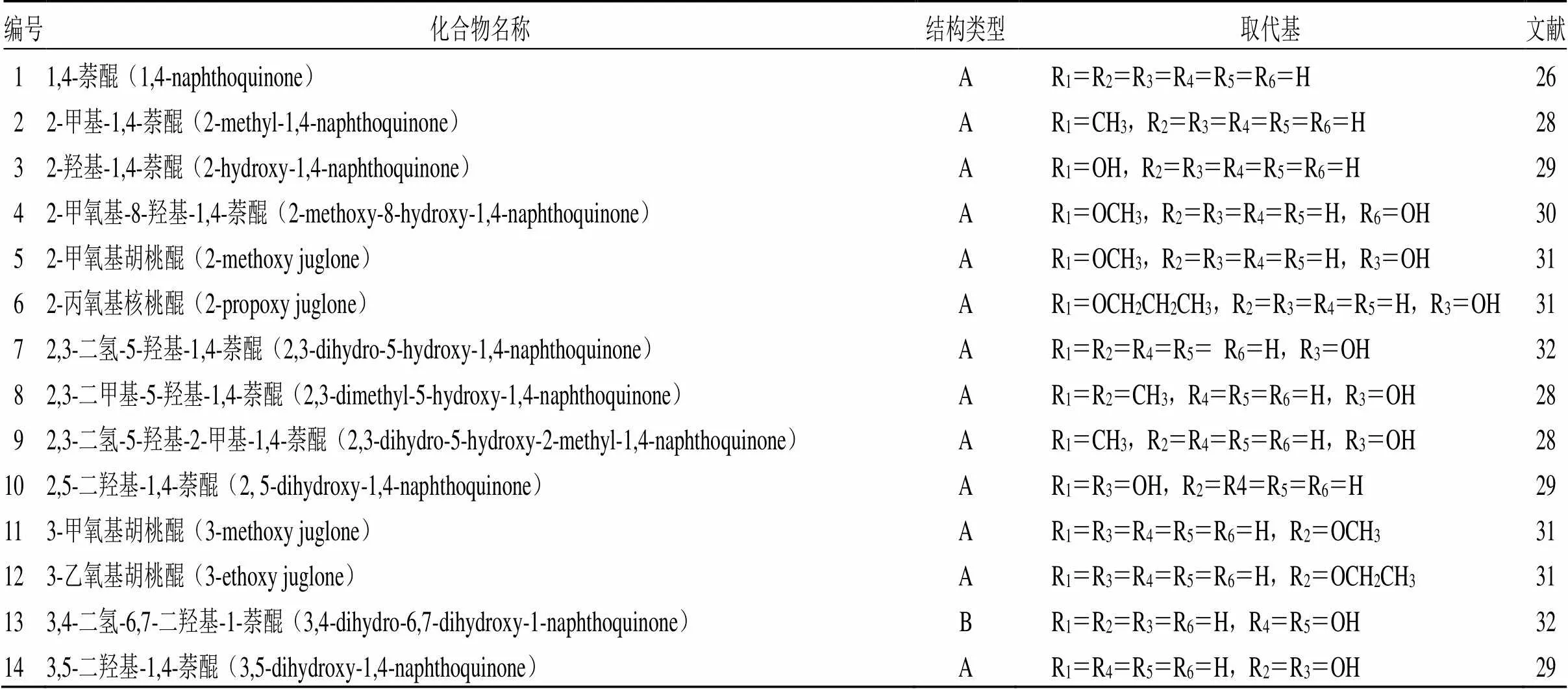
表1 青龙衣中萘醌类成分

续表1
A-萘醌类结构 B-1-萘醌结构 C-萘酮类结构 D-羟基萘类结构 Glc-吡喃葡萄糖基
A-naphthoquinones structure B-1-naphthoquinone structure C-naphthones structure D-hydroxy naphthalenes structure Glc-glucopyranosyl
1.2 黄酮类化合物
黄酮类化合物主要是以2-苯基色原酮为基本母核的化学成分,其广泛存在于自然界,具有抗肿瘤、抗氧化、抗炎等多种生理活性。已从青龙衣中分离鉴定出41种黄酮类化合物,主要包括黄酮(A)、二氢黄酮(B)、黄烷酮(C)3大类,结构骨架见图2,化合物名称及取代基见表2。

图2 青龙衣中黄酮类化合物结构骨架

表2 青龙衣中黄酮类成分

续表2
A- 黄酮类结构 B-二氢黄酮类结构 C-黄烷酮类结构 Glc-吡喃葡萄糖基 Rut-芸香糖基 Ara-阿拉伯糖基 Xyl-木糖基 Rha-鼠李糖基 Gal-半乳糖基 Ga-葡萄糖醛酸基
A-flavonoids structure B-dihydro-flavonoids structure C-flavanones structure Glc-glucopyranosyl Rut-rutinglycoside Ara-arabinosyl Xyl-xyloside Rha-rhamnoside Gal-galactoside Ga-glucuronic acid
1.3 二芳基庚烷类成分
二芳基庚烷类化合物是以庚烷为母体,且具有1,7-二取代芳基的化合物,其为青龙衣的抗肿瘤活性成分之一,具有极高的研究价值。迄今已从青龙衣分离得到19种二芳基庚烷类化合物,结构上主要分为环氧庚醇(A)、环氧庚酮(B)、链状庚醇(C)和链状庚酮(D)4类,其结构骨架见图3,化合物名称及取代基见表3。
1.4 多酚类化合物
研究表明,多酚类化合物是青龙衣主要的抗氧化活性成分,青龙衣中含有的多酚类化合物有绿原酸(chlorogenic acid,1)、阿魏酸(ferulic acid,2)、咖啡酸(caffeic acid,3)、香豆酸(coumaric acid,4)、鞣花酸(ellagic acid,5)、香草醛(vanillin,6)、丁香酸(syringic acid,7)、没食子酸(gallic acid,8)、肉豆蔻酸(myristic acid,9)、对苯二酚(hydroquinone,10)、间-甲氧基苯酚(m-methoxyphenol,11)、原儿茶醛(protocatechuic aldehyde,12)、表儿茶素(epicatechin,13)、1,3,6-三没食子酰葡萄糖(1,3,6-trigalloyl glucose,14)、4-羟甲基-2-甲氧基苯酚(4-hydroxymethyl- 2-methoxyphenol,15)、4-羟基-2,6-二甲氧基苯酚- 1--β--吡喃葡萄糖苷(4-hydroxy-2,6- dimethoxyphenol-1--β--glucopyranoside,16)、6--咖啡酸--葡萄糖(6--caffeic acid--glucose,17)、4′-羟基-2′-甲氧基苯酚-1--β-(6--紫丁香酰)吡喃葡萄糖苷(4′-hydroxy-2′-methoxyphenol- 1--β-(6--syringoyl) glucopyranoside,18)[14, 39, 27, 43, 49, 55-58]。青龙衣中部分多酚类化合物结构见图4,化合物名称及分子式见表4。

图3 青龙衣中二芳基庚烷类化合物结构骨架

表3 青龙衣中二芳基庚烷类成分
A-环氧庚醇类结构 B-环氧庚酮类结构 C-链状庚醇类结构 D-链状庚酮类结构
A-epoxy heptanol structure B-epoxy heptanone structure C-chain heptanol structure D-chain heptanone structure
1.5 萜类化合物
萜类化合物是由甲戊二羟酸衍生,且分子骨架以异戊二烯(C5单元)为基本结构单元的化合物,根据分子结构中异戊二烯单位的数目可分为单萜、倍半萜、二萜和三萜等。目前已从青龙衣中发现20余种萜类化合物,主要为五环三萜和四环三萜,其中,五环三萜在结构上主要分为乌苏烷型(A)、齐墩果烷型(B)、羽扇豆烷型(C)三类,四环三萜的结构类型主要是达玛烷型(D)。具体结构骨架见图5,化合物名称及取代基见表5。
1.6 其他类成分
青龙衣中还发现多种其他类成分,如甾体类成分谷甾醇[39]、-谷甾醇[22]、过氧化麦角甾醇[62]、胡萝卜苷[22]等;糖类如果糖、鼠李糖、阿拉伯糖、葡萄糖和半乳糖[63];酯类如苹果酸-1-单乙酯、苹果酸-1-单丁酯、葡萄糖乙苷[64]以及钾、钙、锌、铜、镁、铁等矿物类[65]。
2 药理作用
现代药理学研究表明,青龙衣具有抗肿瘤、抗氧化、抑菌、抗病毒、抗炎镇痛、杀虫等多种药理作用。
2.1 抗肿瘤作用
近年来,青龙衣因其显著的抗癌活性受到广泛关注,国内外学者对青龙衣的研究不断深入,从中发现了愈来愈多新的化学成分,在抗肿瘤方面也取得了较大进展。文献报道显示[10],萘醌类化合物是青龙衣的主要抗癌活性成分,其可抑制肝癌、胃癌、乳腺癌等多种癌细胞的增值。周媛媛等[66]通过MTT法发现,核桃青皮提取物中具有2,3-不饱和键和酚羟基取代的萘醌类化合物对人肝癌细胞HepG-2具有较强的细胞毒活性,可以抑制癌细胞增殖。另有研究表明,核桃青皮提取物对肺癌细胞的生长有明显的抑制作用,其作用机制是下调cyclinD1蛋白抑制肺癌细胞增殖和上调TNF-α蛋白促使肺癌细胞凋亡[67]。青龙衣含药血清对胃癌SGC-7901细胞的增殖有抑制作用[68]。研究还发现,核桃青皮乙醇提物可通过下调G1/S-特异性周期蛋白-D1(cyclin D1)、上调P53和磷酸化P53蛋白质的表达,将KYSE150食管癌细胞周期阻滞在G0/G1期,从而抑制食管癌的发展[69]。胡泽成[70]实验表明,青龙衣多糖在体外可直接抑制或杀伤人结肠癌HCT-116细胞,其抗肿瘤机制可能与抑制PI3K/Akt信号通路激活有关。Zhai等[71]体外实验发现,核桃青皮提取物胡桃醌可激活c-Jun氨基末端激酶(JNK/c-Jun)、线粒体和死亡受体3条途径中凋亡分子的表达,从而诱导宫颈癌Hela细胞凋亡。此外,核桃青皮提取物对血癌[72]、前列腺癌[73]、乳腺癌[74]也有一定的抑制作用。

图4 青龙衣中多酚类成分化学结构

表4 青龙衣中多酚类成分
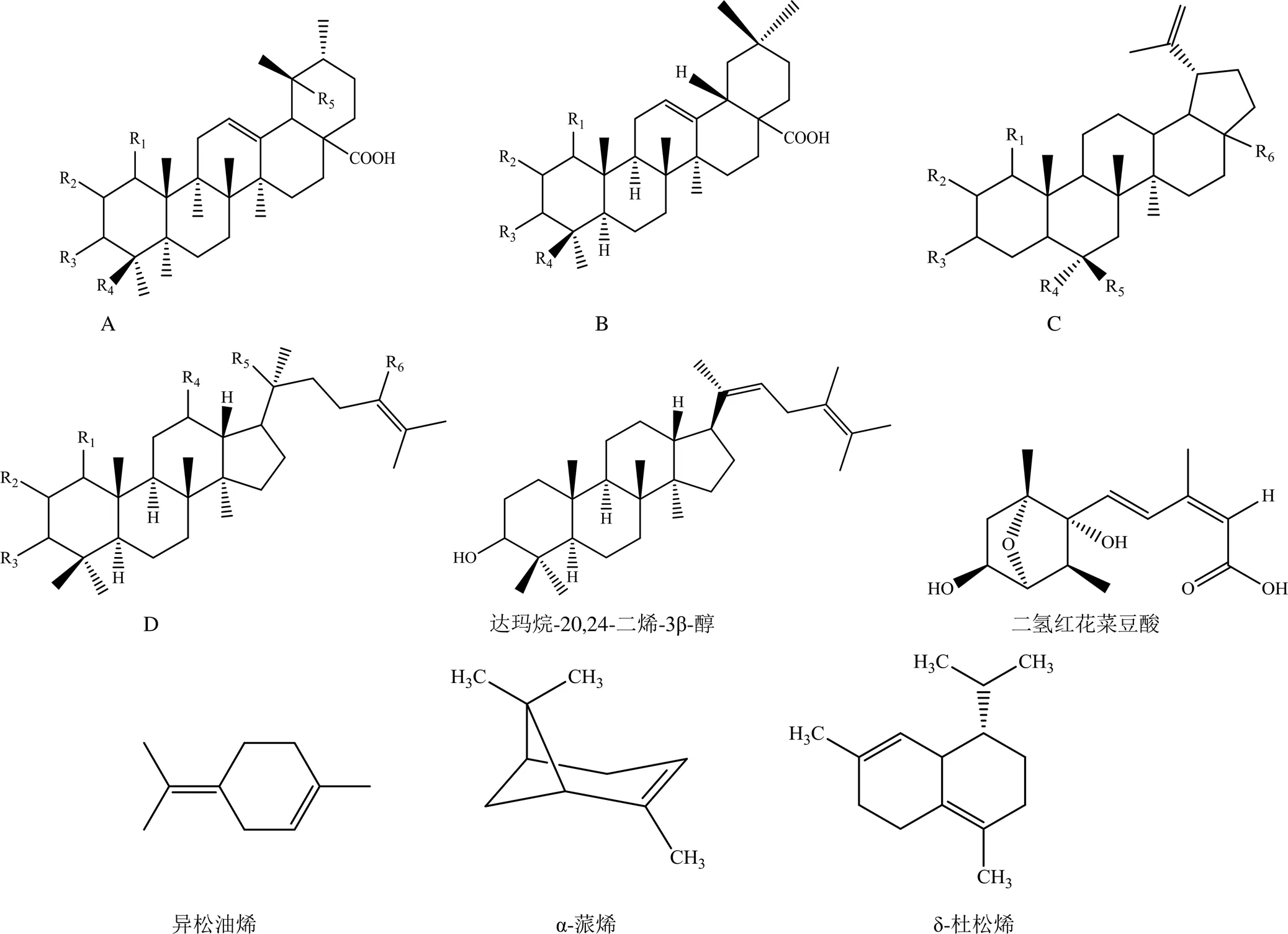
图5 青龙衣中萜类化合物结构骨架
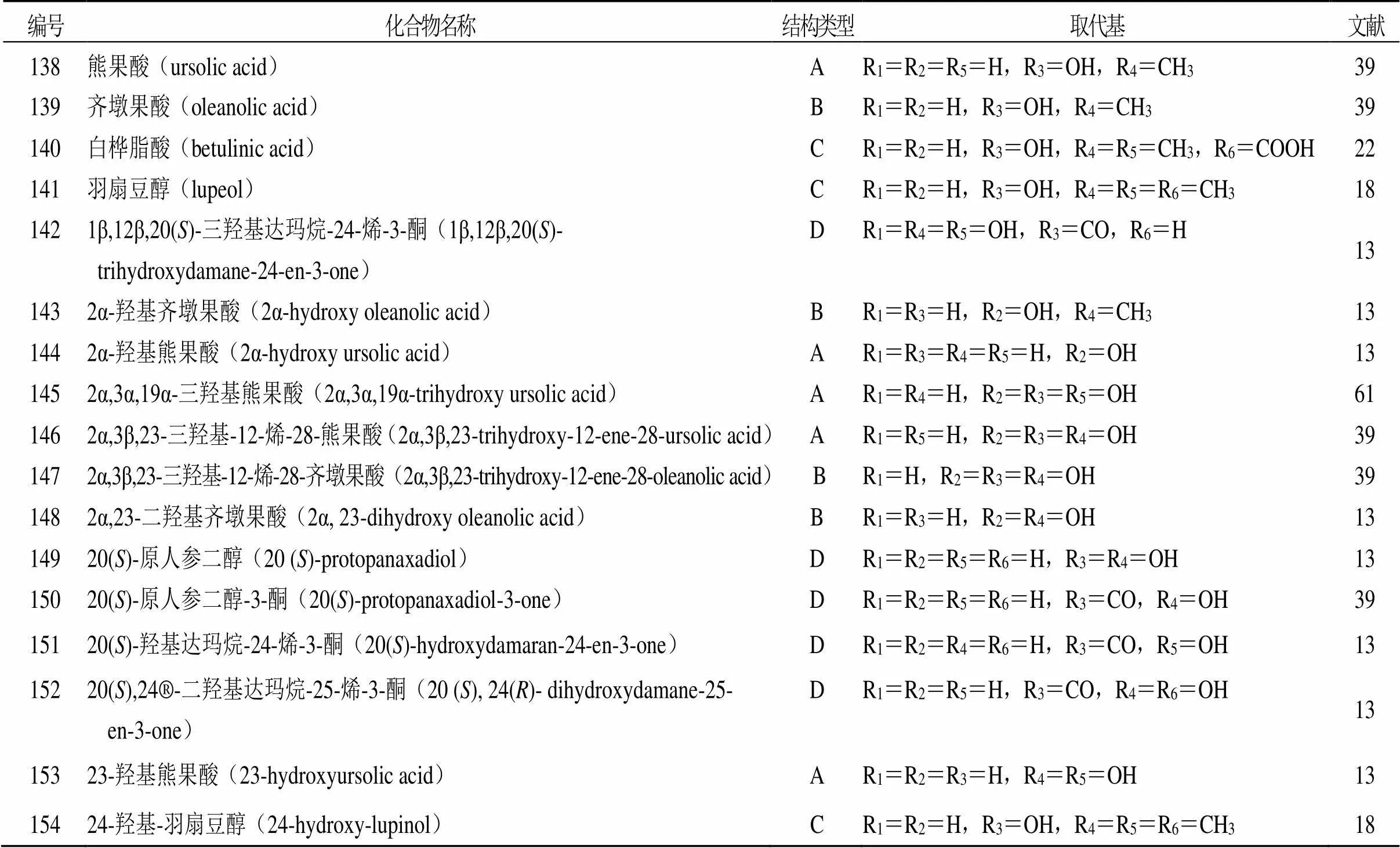
表5 青龙衣中萜类成分
A-乌苏烷型结构 B-齐墩果烷型结构 C-羽扇豆烷型结构 D-达玛烷型结构
A-ursane type structure B-oleanane type structure C-lupane type structure D-dammarane type structure.
2.2 抗氧化作用
生物机体中活性氧自由基(ROS)积累过多会对正常的组织细胞、核酸结构产生损害,诱发基因突变及细胞凋亡等,应从自由基的源头抑制、直接清除自由基、提高机体抗氧化酶系的活性3个方面来防止ROS过多积累。Moghaddam等[75]通过DPPH自由基清除和Fe3+还原能力,分析核桃青皮水、甲醇、醋酸乙酯及二氯甲烷提取物抗氧化活性,发现核桃青皮甲醇提取物抗氧化活性最强,且比阳性对照二丁基羟基甲苯(BHT)的抗氧化能力强。刘迪等[76]体内实验发现,核桃青皮多酚类提取物可以通过降低机体丙二醛(MDA)含量来降低机体由脂质自由基引起的损害,同时,还可通过提高超氧化物歧化酶(SOD)活性提高机体清除自由基的能力。谢东雪等[77]研究结果显示,核桃青皮多糖成分也具有较强的抗氧化活性,其抗氧化能力与样品的质量浓度呈正相关。另有研究发现,核桃青皮提取物可通过氧化应激作用来抑制Lewis肺癌细胞生长[78]。
2.3 抑菌、抗病毒作用
研究表明,青龙衣提取物对细菌、真菌、病毒等病原微生物均有广泛的抑制作用。Sharma等[79]研究核桃青皮水、乙醇、醋酸乙酯、氯仿和石油醚提取物的抗菌活性,结果表明,乙醇提取物对大肠杆菌、枯草芽孢杆菌、气单胞菌和金黄色葡萄球菌的抑制作用最强。张卫星等[80]用牛津杯法测定不同极性溶剂的核桃青皮提取物抗菌能力,发现核桃青皮醋酸乙酯相和氯仿提取物对细菌的抑制能力强,而核桃青皮石油醚提取物对真菌的抑制能力强。此外,任先伟等[81]实验得出,核桃青皮乙醇提取物不同极性萃取相对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、普通变形杆菌、肺炎克雷伯菌、肠炎沙门菌、铜绿假单胞菌均有抑制作用(醋酸乙酯相>氯仿相>正丁醇相>石油醚相),其作用机制与破坏菌体的细胞壁或膜结构有关。何念武等[82]研究发现,核桃青皮提取物对烟草花叶病毒(TMV)和烟草黄瓜花叶病毒均有一定的生长抑制作用,其作用强度依次为醋酸乙酯提取物>氯仿提取物>乙醇提取物>丙酮提取物>乙醚提取物。另有研究表明,核桃青皮醋酸乙酯萃取相中的三萜类化合物和黄酮类化合物、石油醚萃取相中的木质素类化合物是抗TMV高活性成分,其作用机制主要是在体外对TMV钝化、预防TMV初侵染、抑制TMV复制增殖以及增强植物对TMV侵染的抵抗力[3-4]。
2.4 抗炎、镇痛作用
Hu等[83]发现,核桃青皮中黄酮类衍生物花青素-7--β--葡萄糖醛酸苷(AG)可通过抑制诱导型一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)、肿瘤坏死因子-α(TNF-α)的mRNA表达和减少一氧化氮(NO)、前列腺素E2(PGE2)、TNF-α促炎细胞因子的释放,产生抗炎作用。止痛是青龙衣的传统功效,杜旭等[9, 84]研究发现,青龙衣无机盐是镇痛作用的有效成分,其作用机制是增加小鼠脑内钾离子含量、降低钙离子含量,从而增高K+/Ca2+的比值,提高小鼠的基础痛阈值。另外,从神经和递质方面来说,青龙衣无机盐可以通过增加神经递质5-羟色胺含量、阻断神经干及感觉神经末梢的传导来提高脑内钙与钾的比值,最终发挥镇痛作用。
2.5 杀虫作用
研究报道,核桃青皮对多数昆虫都具有触杀、胃毒以及抑制生长发育的作用,可用于农业害虫的防治。何念武等[82]研究核桃青皮提取物对烟青虫的毒杀和拒食活性,结果显示,5种提取物均对烟青虫具有毒杀作用,且呈剂量依赖性,其对烟青虫的杀虫活性顺序依次为醋酸乙酯提取物>氯仿提取物>乙醚提取物>乙醇提取物>水提取物。刘妍等[85]对朱砂叶螨触杀毒性研究,首次发现核桃青皮中胡桃醌对朱砂叶螨具有触杀毒性,作用强度中等偏弱,而核桃石油醚提取物-脂肪酸酯棕榈酸甲酯(MP)具有强杀螨活性,在10mg/mL处理浓度下,朱砂叶螨成虫的死亡率高达97.9%,虫卵的死亡率达57.2%[86]。Hu等[87]实验显示,从青龙衣氯仿提取物中分离得到的胡桃酮和白花丹素对棉铃虫和菜青虫有杀虫活性,其作用机制为降低昆虫中关键酶-苯酚氧化酶的活力。
2.6 化感作用
化感作用广泛存在于自然界,它是植物或微生物防御和生存竞争的有力武器。Nowicka等[88]实验表明,胡桃中的胡桃醌是一种化感物质,它产生毒性的主要方式是形成半醌自由基,将O2还原为超氧物。有研究发现,核桃青皮中水溶性化感活性物质主要集中在醋酸乙酯相,且随着醋酸乙酯萃取物浓度的降低,抑制作用也逐渐减弱[89]。朱天慧[90]发现,核桃青皮水提液石油醚萃取相中分离得到的3β-羟基-乌苏-12-烯,对绿豆、小麦、萝卜、油菜、黑麦草及高羊茅的发芽率和幼苗生长均有较好的抑制作用,其化感作用机制是破坏受体细胞的结构,抑制细胞器功能的正常作用,使细胞生长活力降低。
2.7 其他作用
青龙衣对痤疮[91]、白癜风[92]、寻常疣及扁平疣[93]等皮肤病具有明显的治疗作用。此外,Javidanpour等[94]研究发现,青龙衣对糖尿病也有一定的治疗效果,其作用与核桃青皮提取物对胰岛β细胞具有一定的保护和再生作用有关。孙桂君等[95]临床应用表明,青龙衣糖膏可治疗浅表性胃炎,其解除胃脘疼痛有效率高达87.7%。
3 Q-Marker的预测分析
青龙衣为多基原药材,分布范围广,化学成分多样,且由于生长环境、采收、储藏加工等不同,导致其质量参差不齐。但在质量评价方面的研究较少,且未被《中国药典》收录,青龙衣药材、炮制品、组方等缺乏统一的质量控制标准,严重阻碍了青龙衣药材的开发和运用。由此,为青龙衣建立合理的质量评价方法意义重大。Q-Marker是由刘昌孝院士[96]提出的,它是指存在于中药材和中药产品(中药饮片、中药煎剂、中药提取物、中成药制剂等)中固有的或加工制备过程中形成的,与中药的功能属性密切相关的化学物质,能作为反映中药安全性和有效性的标示性物质进行质量控制。中药Q-Marker的提出和运用,为中药质量监控体系的建立奠定了重要基础,可弥补现有质量控制方法的不足,保证中药质量标准一致性、溯源性和可传承性。以下将通过文献研究,围绕中药Q-Marker理论,对青龙衣的Q-Marker进行预测,以期为其建立科学的质量控制方法。
3.1 基于植物亲缘学及化学成分特有性证据的Q-Marker预测分析
青龙衣来源于胡桃科(Juglandaceae)胡桃属L.植物核桃L.和核桃楸Maxim.。胡桃属植物全世界约有21种,我国产8种,分别是胡桃、野核桃、核桃楸Maxim.、铁核桃Doda、麻核桃、吉宝核桃sieboldiana Max、心形核桃Max、黑核桃nigra Max[97-98],主要分布于河北、山东、山西、陕西、东北等地区[99],其中,主产于东北地区黑龙江省的称为北青龙衣。目前已从胡桃属植物中分离得到多种化合物,包括醌类、黄酮类、二芳基庚烷类、多酚类、萜类等成分。其中,萘醌类成分是胡桃属植物的主要有效成分,二芳基庚烷类成分是胡桃树植物的特征性成分,两者也被视为核桃青皮的主要活性物质[100]。孙墨珑等[101]采用超声波法测定了核桃楸的不同药用部位中胡桃醌含量,发现胡桃醌含量为外果皮>树叶>树皮。张海燕等[102]对13个产地的北青龙衣进行红外光谱鉴定分析,结果表明,胡桃醌为北青龙衣中的主要有效成分,但因地域和生长环境不同,各产地的北青龙衣中胡桃醌含量存在差异。周媛媛等[45]从青龙衣中分离鉴定出1′-(4′-羟基苯基)-7-(3′′-甲氧基-4′′-羟基苯基)-4-烯-3-庚酮和1-(4′-羟基苯基)-7-(3′′-甲氧基-4′′-羟基苯基)-5-甲氧基-3-庚酮2种线型二芳基庚烷类化合物,以及1-(4′-羟基苯基)-7-(3′′-甲氧基苯基)-2-羟基-3′,4′′-环氧-3-庚酮、4′′-epoxy-1-(4′-羟基苯基)-7-(3′′-甲氧基苯基)-3′, 4′′-环氧-3-庚醇、galleon、胡桃宁A、茸毛香杨梅酮5种环氧型二芳基庚烷类化合物。通过对萘醌类成分和二芳基庚烷类成分分布差异性和特有性分析,可将其作为确定青龙衣Q-Marker的重要参考依据。
3.2 基于传统功效的Q-Marker预测分析
传统功效是中药有效性的概括,也是临床用药的依据[103]。《中华本草》记载,青龙衣具有止痛、止咳、止泻、解毒、杀虫等功效,可用于脘腹疼痛、痛经、久咳、泄泻久痢、痈肿疮毒、顽癣、秃疮、白癜风等。现代药理学研究表明,青龙衣的传统功效“止痛”主要体现在镇痛药理作用;传统功效“解毒”则主要体现在抗炎、抗菌、抗病毒等药理作用;“杀虫”作用多应用于农业害虫防治。研究发现,青龙衣无机盐具有明显的镇痛作用,黄酮类化合物具有抗炎、抑菌、抗病毒的作用,胡桃醌、脂肪酸酯棕榈酸甲酯、胡桃酮及白花丹素有较强的杀虫作用。以上所述成分与青龙衣的传统功效相应,是青龙衣传统功效的主要药效物质基础,可作为青龙衣药材Q-Marker筛选的重要依据。
3.3 基于传统药性的Q-Marker预测分析
性味归经是中药的基本属性,是指导中医临床用药的重要依据,也应作为确定青龙衣Q-Marker的依据之一。青龙衣味苦、涩,性平;归肝、脾、胃经。中药药性理论指出,“苦味”“涩味”的物质基础应具有“苦味”“涩味”的味觉特征及功能属性。现代研究发现[104],苦味药的化学成分主要包括生物碱、皂苷类、黄酮类等,涩味药化学成分多以鞣质为主。青龙衣性平,平性药作用缓和,寒热之性不明显,所含化学成分多样,主要包括糖类、无机物、生物碱、黄酮类、氨基酸、苷类等成分[105]。基于以上分析,青龙衣中的黄酮类、苷类和多酚类成分是表达其“性味”的主要物质基础,可作为青龙衣Q-Marker选择的重要参考。
3.4 基于化学成分可测性的Q-Marker预测分析
化学成分的可测性也是中药Q-Marker筛选的重要原则之一。青龙衣中的化学成分复杂多样,可采用HPLC、TLC、指纹图谱等分析方法对青龙衣的Q-Marker进行定性和定量分析。侯栋等[106]对核桃青皮中的胡桃醌采用HPLC检测,得到新鲜核桃青皮中胡桃醌含量为1.66 mg/g,冷冻青皮含量为1.54 mg/g,并证明该法可作为青龙衣中胡桃醌分析测定的有效手段。高树赢等[46]采用TLC和HPLC对2-(4)-4,5-二羟基-α-四氢萘酮-4--β--吡喃葡糖苷进行了定性和定量分析,为青龙衣质量控制标准方法的建立提供了科学参考。孟敏[107]建立了高效液相色谱-二极管阵列检测器(HPLC-DAD)联用方法,对核桃青皮中核桃素A、核桃素B、马尾树素以及核桃酮进行了定量分析,且发现主要产区不同季节4种化合物含量差异较大。以上成分既具有药理活性又可进行定量分析,可将其作为Q-Marker进行选择。
3.5 基于不同采收时期成分含量的Q-Marker预测分析
采收时期是影响药材的有效成分和质量的重要因素之一。霍金海等[35]通过UPLC-Q-TOF-MS/MS技术对北青龙衣不同采收期有效成分的差异进行了研究,结果表明,随着采收时间的变化,大部分萘醌类成分含量逐渐下降,当内核基本形成但不坚硬,此时萘醌类成分含量较高,产量最大,为适宜采收期。曹贵阳等[108]建立不同采收期青龙衣药材HPLC指纹图谱,发现7~8月份为青龙衣最佳采收时期。任晓蕾等[109]采用硝酸铝-亚硝酸钠比色法,测定不同采摘时间的青龙衣中总黄酮的含量,结果表明初伏前黄酮总含量较低,初伏后总黄酮含量逐步增加,伏天过后含量又会有所下降。由以上分析,萘醌类和黄酮类成分能够反映不同采收时期青龙衣的质量变化,可选择为预测青龙衣Q-Marker的重要参考。
3.6 基于不同干燥方法的Q-Marker预测分析
不同的干燥方法对青龙衣药材活性成分有很大影响。洪晓琴等[110]对北青龙衣进行阴干、晒干、烘干、微波干燥、冷冻干燥及烘干方法下不同干燥温度(40、50、60 ℃)处理,从胡桃醌和胡桃酮的含量、抗肿瘤活性及实用性综合分析,认为北青龙衣最宜采用在40 ℃烘干的方法。孙国东等[111]采用UPLC-Q-TOF/MS技术,分析不同干燥方法对萘醌类有效成分含量的影响,确定了40 ℃烘干为最适宜干燥方法。因此,萘醌类化合物可作为考察青龙衣不同干燥方法的Q-Marker。
4 结语
青龙衣作为传统中药,其化学成分多样,药理活性广泛,具有广阔的开发和利用前景。但目前对青龙衣化学成分与药理作用的研究不系统,如活性成分的研究多为青龙衣有效部位的药理活性,缺失具体有效成分的确定,导致青龙衣的药效物质基础不明确,作用机制不清楚,严重影响了青龙衣的新药开发及临床应用推广。在质量控制方面,青龙衣未被《中国药典》收录,质量评价相关研究也较少,当前多将青龙衣中胡桃醌作为质量评价指标,但因胡桃醌的挥发性和升华性,使其提取分离和质量监控过程中不能稳定存在,且青龙衣化学成分多样,仅用胡桃醌做质量控制指标难以表征其复杂体系质量的整体性。因此,为青龙衣建立科学、合理的质量控制方法,对保证青龙衣质量和促进其开发利用具有重要意义。
本文在对青龙衣化学成分及主要药理作用系统研究的基础上,以中药Q-Marker的定义为指导,从化学成分特异性、传统药效与药性、成分可测性、采收时期、干燥方法6个方面,对青龙衣Q-Marker进行预测分析,发现胡桃醌、胡桃酮、绿原酸、核桃素A、核桃素B、马尾树素可作为青龙衣Q-Marker的主要选择对象,为进一步开展青龙衣的质量分析和评价研究提供了思路和方法,有利于建立科学、完善的青龙衣质量控制体系。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家中医药管理局《中华本草》编委会. 中华本草 [M]. 上海: 上海科学技术出版社, 1998, 2·380.
[2] 孙冬雪, 郭雄飞, 阿拉腾图雅, 等. 青龙衣中化学成分及其体外抗肿瘤活性研究 [J]. 中国中药杂志, 2019, 44(11): 2278-2282.
[3] 李鹏影. 核桃青皮中次生物质抗烟草花叶病毒作用机制研究(I) [D]. 杨凌: 西北农林科技大学, 2009.
[4] 黄海玲. 核桃青皮中次生物质抗烟草花叶病毒作用机理研究(II) [D]. 杨凌: 西北农林科技大学, 2009.
[5] 刘迪, 宋晓宇, 李婧, 等. 超临界二氧化碳萃取核桃青皮多酚及其体内抗氧化性 [J]. 食品工业, 2019, 40(5): 144-148.
[6] 赵国超, 周欣, 李容, 等. 青胡桃总黄酮含量测定及抗氧化活性分析 [J]. 南方农业学报, 2019, 50(2): 357-363.
[7] 唐春丽, 杨冰, 方自扬, 等. 核桃青皮提取物的抑菌和协同抑菌作用 [J]. 中国药师, 2018, 21(4): 577-580.
[8] 王宏虬, 缪福俊, 李彪, 等. 核桃青皮提取物对马铃薯蚜虫与瓢虫的杀虫活性 [J]. 江苏农业科学, 2012, 40(7): 112-114.
[9] 杜旭, 王明晶, 姜力伟, 等. 中药青龙衣镇痛作用机理的研究 [J]. 中国中医药科技, 1997, 4(3): 155-156.
[10] 张宇驰, 葛鹏玲, 陈家红, 等. 青龙衣萘醌类化学成分及其抗癌活性研究进展 [J]. 中草药, 2019, 50(9): 2251-2256.
[11] Jahanban-Esfahlan A, Ostadrahimi A, Tabibiazar M,. A comprehensive review on the chemical constituents and functional uses of walnut (spp.) husk [J]., 2019, 20(16): E3920.
[12] 周媛媛, 宋红娟, 陈晗, 等. 青龙衣黄酮类化学成分研究 [J]. 中草药, 2019, 50(15): 3588-3592.
[13] 杨炳友, 孟颖, 刘兆熙, 等. 青龙衣中三萜类化合物的分析 [J]. 中国实验方剂学杂志, 2015, 21(2): 49-52.
[14] 刘瑞, 谢辰阳, 吴水霞, 等. 核桃青皮不同极性酚类物质组成分析 [J]. 食品科学技术学报, 2019, 37(6): 88-93.
[15] 王艳秋. 北青龙衣抗氧化活性谱效关系的研究 [D]. 哈尔滨: 黑龙江大学, 2013.
[16] Machida K, Matsuoka E, Kasahara T,. Studies on the constituents ofspecies. I. Structural determination of (4)-and(4)-4-hydroxy-ALPHA.- tetralone derivatives from the fruit ofMaxim. var.Makino [J]., 2005, 53(8): 934-937.
[17] 李海洋. 核桃青皮有效化学成分及抑菌性研究 [D]. 杨凌: 西北农林科技大学, 2012.
[18] 董梅, 袁日, 齐凤琴, 等. 青龙衣中细胞毒活性成分的研究 [J]. 天然产物研究与开发, 2011, 23(5): 805-808.
[19] 曲中原. 青龙衣抗肿瘤活性成分及其作用机制研究 [D]. 北京: 北京中医药大学, 2010.
[20] Zhou Y Y, Yang B Y, Liu Z X,. Cytotoxicity of triterpenes from green walnut husks ofMaxim in HepG-2 cancer cells [J]., 2015, 20(10): 19252-19262.
[21] 黄柳舒. 山核桃果皮活性成分的研究 [D]. 杭州: 浙江工商大学, 2011.
[22] 张建斌. 甘肃青龙衣(核桃青皮)化学成分的研究 [D]. 兰州: 西北师范大学, 2009.
[23] 王红萍, 尹江艳. 核桃青皮的有效成分及综合利用 [J]. 安徽农业科学, 2013, 41(24): 10129-10131.
[24] Hirakawa K, Ogiue E, Motoyoshiya J,. Naphthoquinones from Juglandaceae [J]., 1986, 25(6): 1494-1495.
[25] Binder R G, Benson M E, Flath R A. Eight 1, 4-naphthoquinones from[J]., 1989, 28(10): 2799-2801.
[26] 王海香, 申照静, 杜艳丽, 等. 胡桃属植物青皮的化学成分及作用机理研究进展 [J]. 生物质化学工程, 2008, 42(1): 47-52.
[27] 周媛媛, 刘兆熙, 孟颖, 等. 青龙衣有效部位化学成分研究 [J]. 中草药, 2014, 45(16): 2303-2306.
[28] 林君阳, 马良进, 陈安良, 等. 山核桃外果皮化学成分及抑菌活性初步研究 [J]. 浙江林学院学报, 2009, 26(1): 100-104.
[29] 殷田田, 石伟峰, 闫福林. 核桃青皮化学成分及其抗肿瘤活性研究 [J]. 天然产物研究与开发, 2018, 30(12): 2104-2109.
[30] 王艳梅. 核桃楸青果皮生物活性及活性成分研究 [D]. 哈尔滨: 东北林业大学, 2008.
[31] Liu L J, Li W, Koike K,. New.ALPHA.-tetralonyl glucosides from the fruit of[J]., 2004, 52(5): 566-569.
[32] Chen G, Pi X M, Yu C Y. A new naphthalenone isolated from the green walnut husks ofMaxim [J]., 2015, 29(2): 174-179.
[33] 王宏歌. 核桃楸外果皮活性成分的研究 [D]. 哈尔滨: 东北林业大学, 2013.
[34] 高小宁, 孙晓飞, 黄国兴. 核桃楸青皮中的一个新四氢萘酮化合物 [J]. 中成药, 2013, 35(7): 1487-1489.
[35] 霍金海, 都晓伟, 孙国东, 等. 基于UPLC-Q-TOF/MS分析北青龙衣成分 [J]. 中草药, 2016, 47(19): 3379-3388.
[36] 刘丽娟, 齐凤琴, 龚显峰. 北青龙衣中萘醌类衍生物的细胞毒活性研究 [J]. 中国现代应用药学, 2010, 27(7): 574-577.
[37] Min B S, Lee S Y, Kim J H,. Anti-complement activity of constituents from the stem-bark of[J]., 2003, 26(7): 1042-1044.
[38] 张建斌, 柳军玺, 查飞, 等. 青龙衣的化学成分研究 [J]. 中草药, 2009, 40(6): 847-849.
[39] 周媛媛, 蒋艳秋, 孟颖, 等. 青龙衣活性部位的化学成分研究 [J]. 中成药, 2015, 37(2): 332-335.
[40] 周媛媛, 王栋. 青龙衣化学成分的研究 [J]. 中医药信息, 2010, 27(2): 18-20.
[41] 李静, 徐康平, 邹辉, 等. 胡桃楸青果皮化学成分研究 [J]. 中南药学, 2013, 11(1): 1-3.
[42] 周媛媛, 刘雨新, 蒋艳秋, 等. 青龙衣抗肿瘤有效部位的化学成分研究 [J]. 中草药, 2016, 47(17): 2979-2983.
[43] 周晔, 王伟, 王成章, 等. 核桃属(Juglans)植物多酚类物质研究进展 [J]. 南京林业大学学报: 自然科学版, 2013, 37(5): 146-152.
[44] 刘元慧. 山核桃外果皮的化学成分及生物活性研究 [D]. 杭州: 浙江林学院, 2009.
[45] 周媛媛, 王栋. 青龙衣中二芳基庚烷类成分研究 [J]. 中国实验方剂学杂志, 2011, 17(22): 92-93.
[46] 高树赢. 北青龙衣的化学成分及质量标准的研究 [D]. 哈尔滨: 黑龙江大学, 2009.
[47] Min B S, Nakamura N, Miyashiro H,. Inhibition of human immunodeficiency virus type 1 reverse transcriptase and ribonuclease H activities by constituents of[J]., 2000, 48(2): 194-200.
[48] 张丽杰. 北青龙衣细胞毒活性部位谱效关系的研究 [D]. 哈尔滨: 黑龙江大学, 2011.
[49] 杨炳友, 蒋艳秋, 孟颖, 等. 青龙衣正丁醇部位化学成分研究 [J]. 中草药, 2015, 46(4): 481-485.
[50] 吴晓骏, 吴威, 赵余庆. 山核桃化学成分和生物活性研究进展 [J]. 食品研究与开发, 2013, 34(12): 127-130.
[51] 周媛媛, 王栋. 青龙衣中二芳基庚烷类化学成分的研究 [J]. 时珍国医国药, 2009, 20(8): 1936-1937.
[52] 李冬梅, 彭友伦, 刘光明. 漾濞泡核桃青皮中二芳基庚烷类成分研究 [J]. 中国中药杂志, 2017, 42(18): 3553-3556.
[53] Liu J X, Meng M, Li C,. Simultaneous determination of three diarylheptanoids and an α-tetralone derivative in the green walnut husks (L.) by high-performance liquid chromatography with photodiode array detector [J]., 2008, 1190(1/2): 80-85.
[54] 周媛媛, 宋红娟, 李健, 等. 青龙衣化学成分的研究 [J]. 中成药, 2020, 42(2): 375-381.
[55] 万政敏. 核桃青皮中多酚类物质及其抗氧化性的分析 [D]. 呼和浩特: 内蒙古农业大学, 2007.
[56] 司传领, 刘忠, 惠岚峰, 等. 核桃楸树皮提取物的化学成分及其抗氧化活性研究 [J]. 林产化学与工业, 2008, 28(1): 29-32.
[57] 周媛媛, 刘兆熙, 孟颖, 等. 青龙衣醋酸乙酯部位的化学成分研究 [J]. 中医药信息, 2015, 32(3): 20-22.
[58] 周媛媛, 刘雨新, 蒋艳秋, 等. 青龙衣的化学成分 [J]. 中成药, 2015, 37(12): 2669-2673.
[59] 魏欢, 杨建文, 颜小捷, 等. 核桃青皮的化学成分研究: 酚类化合物 [J]. 广西植物, 2018, 38(4): 463-468.
[60] Machida K, Yogiashi Y, Matsuda S,. A new phenolic glycoside syringate from the bark ofMAXIM. var.MAKINO [J]., 2009, 63(2): 220-222.
[61] 周媛媛, 孟颖, 蒋艳秋, 等. 青龙衣化学成分研究 [J]. 中药材, 2014, 37(11): 1998-2001.
[62] 白少娟, 田玉欣, 王炎, 等. 北青龙衣氯仿部位化学成分的分离与鉴定 [J]. 中国药物化学杂志, 2017, 27(1): 52-56.
[63] 季宇彬, 陈海继, 汲晨锋. 青龙衣多糖的提取及单糖组分和质量分数测定 [J]. 哈尔滨商业大学学报: 自然科学版, 2006, 22(4): 1-4,7.
[64] 邱继莹, 王伟明, 李军, 等. 青龙衣化学成分研究 [J]. 中草药, 2017, 48(12): 2385-2389.
[65] 周靖, 尹泳彪, 邵艳秋. 山核桃青果皮中矿物元素的测定 [J]. 牡丹江师范学院学报: 自然科学版, 2001(4): 19-20.
[66] Zhou Y Y, Yang B Y, Jiang Y Q,. Studies on cytotoxic activity against HepG-2 cells of naphthoquinones from green walnut husks ofMaxim [J]., 2015, 20(9): 15572-15588.
[67] 曹志友, 王树鹏, 杨淑艳, 等. 核桃青皮提取物通过cyclinD1和TNF-α调控肺癌细胞的生长 [J]. 中国农村卫生事业管理, 2017, 37(7): 873-874.
[68] 高启龙, 朱亚楠, 石变, 等. 青龙衣含药血清抑制胃癌SGC-7901细胞生长和诱导凋亡 [J]. 中国实验方剂学杂志, 2017, 23(13): 111-115.
[69] Li C, Zhang Z, Zhang S,. Inhibitory effects of the extracts ofgreen husks on the proliferation, migration and survival of KYSE150 and EC9706 human esophageal cancer cell lines [J]., 2019, 71(1): 149-158.
[70] 胡泽成. 青龙衣多糖对结肠癌HCT-116细胞增殖、凋亡及PI3K/Akt信号通路的影响 [J]. 中国实验方剂学杂志, 2016, 22(18): 136-139.
[71] Lu Z, Chen H, Zheng X M,. Experimental study on the apoptosis of cervical cancer Hela cells induced by juglone through c-Jun N-terminal kinase/c-Jun pathway [J]., 2017, 10(6): 572-575.
[72] 张梅, 陈永春. 青龙衣醇提物对人白血病K562细胞的基因芯片表达的影响 [J]. 中医药导报, 2015, 21(18): 20-22,32.
[73] Alshatwi A A, Hasan T N, Shafi G,. Validation of the antiproliferative effects of organic extracts from the green husk ofL. on PC-3 human prostate cancer cells by assessment of apoptosis-related genes [J]., 2012, 2012: 103026.
[74] Sun Z L, Dong J L, Wu J. Juglanin induces apoptosis and autophagy in human breast cancer progression via ROS/JNK promotion [J]., 2017, 85: 303-312.
[75] Moghaddam P Z, Mohammadi A, Feyzi P,.antioxidant and antibacterial activity of various extracts from exocarps and endocarps of walnut [J]., 2017, 30(5): 1725-1731.
[76] 刘迪, 宋晓宇, 李婧, 等. 超临界二氧化碳萃取核桃青皮多酚及其体内抗氧化性 [J]. 食品工业, 2019, 40(5): 144-148.
[77] 谢东雪, 陆娟, 王月, 等. 长白山区核桃青皮多糖分离纯化、鉴定及抗氧化活性分析 [J]. 食品科学, 2019, 40(18): 281-286.
[78] 王爽, 于洪泉, 王玮瑶, 等. 核桃青皮提取物通过氧化应激作用抑制Lewis肺癌细胞生长 [J]. 中国老年学杂志, 2014, 34(5): 1325-1326.
[79] Sharma P, Ravikumar G, Kalaiselvi M,.antibacterial and free radical scavenging activity of green hull of[J]., 2013, 3(4): 298-302.
[80] 张卫星, 何开泽, 蒲蔷. 核桃青皮提取物的抗菌和抗氧化活性 [J]. 应用与环境生物学报, 2014, 20(1): 87-92.
[81] 任先伟, 魏晓璐, 黄鑫, 等. 核桃青皮提取物抑菌活性及抑菌机理研究 [J]. 食品工业科技, 2015, 36(18): 93-98.
[82] 何念武, 黄金辉, 张永锋, 等. 核桃青皮提取物对烟草病毒的生长抑制作用 [J]. 价值工程, 2016, 35(34): 209-211.
[83] Hu W C, Wang X F, Wu L,. Apigenin-7--β--glucuronide inhibits LPS-induced inflammation through the inactivation of AP-1 and MAPK signaling pathways in RAW 264.7 macrophages and protects mice against endotoxin shock [J]., 2016, 7(2): 1002-1013.
[84] 杜旭, 王美村, 孔令民, 等. 中药青龙衣镇痛机制研究: 青龙衣无机盐及其模拟成分对小鼠脑内5-羟色胺含量的影响 [J]. 哈尔滨医科大学学报, 1996, 30(1): 44-46.
[85] 刘妍, 王有年, 成军, 等. 核桃青皮中胡桃醌对朱砂叶螨触杀毒性的研究 [J]. 北京农学院学报, 2015, 30(4): 59-62.
[86] Wang Y N, Wang H X, Shen Z J,. Methyl palmitate, an acaricidal compound occurring in green walnut husks [J]., 2009, 102(1): 196-202.
[87] Hu W Y, Du W X, Bai S M,. Phenoloxidase, an effective bioactivity target for botanical insecticide screening from green walnut husks [J]., 2018, 32(23): 2848-2851.
[88] Nowicka B, Żądło A, Pluciński B,. The oxidative stress in allelopathy: Participation of prenyllipid antioxidants in the response to juglone in[J]., 2017, 144: 171-179.
[89] 王婷, 翟梅枝, 贾彩霞, 等. 核桃青皮中次生代谢物质的化感活性研究 [J]. 西北林学院学报, 2008, 23(3): 160-162.
[90] 朱天慧. 核桃青皮化感活性及作用机理研究II [D]. 杨凌: 西北农林科技大学, 2009.
[91] Kılıç S, Okullu S Ö, Kurt Ö,. Efficacy of two plant extracts against acne vulgaris: Initial results of microbiological tests and cell culture studies [J]., 2019, 18(4): 1061-1065.
[92] 赵瑞亭, 陈晓明, 侯晓军. 补骨脂-青龙衣酊的制备工艺研究 [J]. 中国药房, 2008, 19(30): 2349-2350.
[93] 李笃学, 刘周雄, 王新生. 胡桃青皮外用治疗寻常疣及扁平疣 [J]. 中国社区医师, 2004, 20(12): 41.
[94] Javidanpour S, Fatemi Tabtabaei S R, Siahpoosh A,. Comparison of the effects of fresh leaf and peel extracts of walnut (L.) on blood glucose and β-cells of streptozotocin-induced diabetic rats [J]., 2012, 3(4): 251-255.
[95] 孙桂君, 苑淑莉. 青龙衣糖膏治疗浅表性胃炎疗效观察 [J]. 中医药学报, 2002, 30(3): 16.
[96] 刘昌孝, 陈士林, 肖小河, 等. 中药Q-Marker (Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[97] 欷荣庭, 张毅萍. 中国核桃 [M]. 北京: 中国林业出版社, 1992.
[98] 李志美. 核桃的开发利用 [J]. 林业调查规划, 2004, 29(S1): 199-201.
[99] 江苏新医学院. 中药大辞典-上册 [M]. 上海: 上海人民出版社, 1977, 1552.
[100]李艳, 邓玲玲, 黄胜阳. 胡桃属植物化学成分及生物活性 [J]. 智慧健康, 2016, 2(1): 14-21.
[101]孙墨珑, 宋湛谦, 方桂珍. 核桃楸总黄酮及胡桃醌含量测定 [J]. 林产化学与工业, 2006, 26(2): 93-95.
[102]张海燕, 霍金海, 董文婷, 等. 不同产地北青龙衣的红外光谱鉴定分析 [J]. 中国实验方剂学杂志, 2016, 22(4): 57-60.
[103]姜程曦, 张铁军, 陈常青, 等. 黄精的研究进展及其Q-Marker的预测分析 [J]. 中草药, 2017, 48(1): 1-16.
[104]臧梓因. 中药化学成分与其药性关系浅析 [J]. 中国中医药信息杂志, 2003, 10(11): 75.
[105]于舒雁, 白明, 苗明三. 药性平特点及其现代研究 [J]. 中医学报, 2013, 28(6): 860-862.
[106]侯栋, 高哲, 何童森, 等. HPLC测定核桃青皮中胡桃醌的含量 [J]. 中国实验方剂学杂志, 2012, 18(15): 70-72.
[107]孟敏. 青龙衣有效成分分析方法与锁阳提取工艺 [D]. 兰州: 兰州大学, 2009.
[108]曹贵阳, 王伟明, 霍金海. 青龙衣HPLC指纹图谱研究 [J]. 黑龙江中医药, 2012, 41(3): 51-52.
[109]任晓蕾, 曹贵阳, 初东君, 等. 核桃楸不同药用部位总黄酮含量测定及变化规律 [J]. 中国实验方剂学杂志, 2012, 18(24): 104-106.
[110]洪晓琴, 张海燕, 霍金海, 等. 多指标评价不同干燥方法对北青龙衣质量的影响 [J]. 中国药房, 2016, 27(16): 2257-2260.
[111]孙国东, 霍金海, 洪晓琴, 等. 基于UPLC-Q-TOF/MS技术的北青龙衣不同干燥方法对萘醌类成分影响研究 [J]. 中药材, 2016, 39(11): 2501-2508.
Research progress on chemical composition and pharmacological effects and predictive analysis on quality markers of Qinglongyi
CHEN Le-le, LI Heng-yu, ZHOU Xiang-lu, CHEN Shu-guang, ZHAN Zhao-shuang, WANG Jia-feng
Shandong University of Traditional Chinese Medicine, Jinan 250355, China
Qinglongyi is plant of genusof Juglandaceae, which is often used to treat skin itching and pain. In recent years, with the in-depth study of Qinglongyi, its various chemical constituents, wide range of pharmacological effects and clinical application development have attracted much attention. In this paper, by consulting the relevant literatures at home and abroad in recent years, on the basis of summarizing the chemical composition and modern pharmacological action of Qinglongyi, and according to the concept of traditional Chinese medicine quality marker (Q-Marker), the composition of Qinglongyi quality marker was predicted and analyzed from the aspects of chemical composition and genetic relationship, traditional efficacy and property, measurability of components, harvest time and drying method. It was suggested that juglone, walnut ketone, chlorogenic acid, Qinglongyi inorganic salt, juglanin A, juglanin B, horseradin and total flavonoids can be used as Q-Marker in Qinglongyi. In the follow-up, the above components can be selected as indicators to provide a scientific basis for the quality evaluation of Qinglongyi.
Qinglongyi; juglone; walnut ketone; chlorogenic acid; juglanin A; juglanin B; horseradin; total flavonoids; quality markers; predictive analysis
R286
A
0253 - 2670(2021)09 - 2785 - 16
10.7501/j.issn.0253-2670.2021.09.027
2020-11-12
山东中医药大学科研创新团队项目(2018-10);山东省中医药科技发展计划项目(2019-0041);山东省中医药科技发展计划项目(2019-0042);齐鲁医派中医学术流派传承项目(齐鲁道地药材炮制存性特色技术)
陈乐乐,女,硕士研究生,从事中药药性理论与临床应用研究。Tel: 15735641875 E-mail: 2940179075@qq.com
展照双,硕士生导师,副教授,研究方向为温病理论与临床研究。E-mail: zzshuang2000@126.com
王加锋,博士生导师,教授,研究方向为中药药性理论与临床应用研究。E-mail: wjfeng2000@126.com。
[责任编辑 时圣明]

