试管类型及标本储存方式对血液甲状旁腺激素的影响
黄回滨
甲状旁腺激素(parathormone,PTH)由甲状旁腺主细胞首先合成PTH前体(前甲状旁腺素原),前甲状旁腺素原在细胞内被酶裂解,全段甲状旁腺激素(intact parathormone,iPTH)在细胞内分泌、储存或裂解[1]。PTH可精细调节骨的合成、分解代谢,对成骨细胞和破骨细胞的分化、成熟、凋亡发挥重要作用,具有升高血钙[2],降低血磷的生理功能,是调节细胞外钙离子浓度的主要激素[3]。甲状旁腺激素作为矿物质代谢异常的评估指标[4-6]、判断肾功能损伤程度[7]、甲状旁腺功能亢进手术治疗效果的评价指标等[8-10],甲状腺癌切除术后甲状旁腺功能监测[11],甚至与认知功能有关等[12],其临床应用研究更加广泛,诊断价值也日趋受到重视,而影响血清iPTH检测结果准确性和可靠性的因素较多,除了检测方法、仪器性能等因素外,标本的采集及处理方式是需要关注的重点,采血管中添加的成份是否对检测项目存在潜在的干扰,不合适的标本储存形式是否导致甲状旁腺激素的降解等问题,是降低患者风险、提高检验质量不容忽视的问题。因此本文按照实验室正常工作流程,就试管类型及标本储存方式对血液全段甲状旁腺激素检测结果的影响进行了研究。
1 资料与方法
1.1 一般资料
1.1.1 标本来源 考虑标本浓度范围能覆盖低、中、高、较高浓度值,故选取2019年1月5日—2月28日于医院就诊的门诊及住院慢性肾功能衰竭患者15例,普外科甲状旁腺术前患者5 例,随机选取的门诊患者及体检者各5例。其中男性15例,女性15例,年龄23~75岁。
1.1.2 设备来源 全段甲状旁腺激素检测仪器为SIEMENS ADVIIA Centaur XP immunoassay System检测仪,使用的试剂为该仪器配套试剂盒及标准品,质控品为BIO-RAD公司的Lyphochek Immunoassay Plus Control;离心机:安徽中科中佳科学仪器公司生产的KDC-1044L大容量低速离心机;试管:日本积水创格生产的INSEPACK真空采血管,包括分离胶、促凝剂、EDTA-K3 、无添加剂的真空采血管。
1.2 研究方法
清晨空腹采集以上患者及体检者的静脉血,分别按顺序采集于无添加剂管、促凝剂管、分离胶管、肝素锂抗凝剂、EDTA-K3抗凝真空采血试管中,除无添加剂管外,将其他各管轻轻颠倒充分混匀,同时静置30 min ,3 500 r/min,离心力2 352xg,离心10 min,查看血清血浆分离情况,分离完全,无纤维丝挂壁现象,所有标本无溶血、黄疸及脂血现象。立即上机检测,后在室温放置4 h、8 h,2~8℃冷藏24 h、48 h、72 h再分别检测,分析其结果。
1.3 观察指标
全段甲状旁腺素。
1.4 统计学方法
应用SPSS 19.0软件进行统计分析,计量资料采用差值配对t检验、P<0.05代表差异有统计学意义,采用Bland-Altman分析和双侧置信区间的一致性检测(LOA 95%上、下限范围检测)。根据卫生部临床检验中心临床实验室室间质量评价标准,iPTH项目可接受范围为25%,LQA上、下限95%可信区间在25%范围内为可接受范围,超出即为不可接受。
2 结果
2.1 不同采血管即刻检测结果
表1结果显示以EDTA-K3抗凝管即刻检测结果为对照管,促凝剂管、肝素管、分离胶管、无添加剂管的即刻检测结果差异无统计学意义(P>0.05),双侧置信区间的一致性检测,在25%误差允许范围内,而分离胶管的P值为0.026,P<0.05,双侧置信区间的一致性检测,LOA下限的95%置信区间为-20.1(-28.0,-12.2),超过25%误差允许范围。
2.2 不同储存条件下iPTH检测结果
2.2.1 EDTA-K3抗凝管iPTH结果 EDTA-K3抗凝管在室温放置4 h、室温放置8 h差异无统计学意义。见表2。
2.2.2 肝素锂抗凝管iPTH结果 肝素锂抗凝管在室温放置4 h检测结果差异无统计学意义,而在室温放置8 h、2~8℃ 24 h、48 h、72 h的检测结果差异无统计学意义。见表3。
2.2.3 分离胶采血管、促凝剂采血管、无添加剂管iPTH结果与即刻检测比较,分离胶采血管、促凝剂采血管、无添加剂试管在室温放置4 h、8 h、2~8℃ 24 h、48 h、72h的检测结果差异均有统计学意义(P<0.05)。见表4~6。
3 讨论
本实验检测iPTH所使用的SIEMENS ADVIA Centaur XP仪器及配套的检测试剂系统,对于样本的要求是推荐使用血清或EDTA血浆;而WHO对于iPTH检测项目样本采血管的要求是EDTA为最佳抗凝剂,血清为可用标本[13]。因此本研究实验以EDTA-K3抗凝管样本为对照,比较不同采血管iPTH即刻检测结果、各种采血管在不同贮存条件下的检测结果差异。结果显示促凝剂管、肝素锂抗凝管、无添加剂管的iPTH即刻检测结果与EDTA-K3抗凝管的检测结果比较,在允许的误差范围内;而分离胶采血管则超过了25%的允许误差。
分离胶是一种具疏水性质的有机化合物,其比重介于血清与血细胞之间。血液经分离胶促凝作用并经一定的离心力离心后,分离胶可在血清与血细胞之间形成隔离层,有效的隔离血清与血细胞间的物质交换,保证血清成分的稳定性,因此备受青睐,广泛应用于各种生化免疫检验。然而,本研究显示,分离胶采血管并不适合血液iPTH检测,原因可能为分离胶在一定条件下可分解,并溶解在血清中,形成“油滴”浮于血清表面[14],本实验的检测数据观察发现分离胶采血管的iPTH总体均值为(276.9±112.3);与EDTA-K3的结果(283.6±113.2)比较,差异不大,但是差值的配对t检验结果P值为0.026,P<0.05,说明个体数据间差异显著,推测分离胶管中可能存在某种物质,促进iPTH的降解或由于“油滴”的影响,当环境温度超过分离胶管保存的温度时,分离胶易溶解在血清中。另外,患者由于高蛋白血症、高钠等导致血清密度升高的因素都会影响血清的分离效果,使分离胶微小分子漂浮于血标本中,而导致检测结果更不稳定。
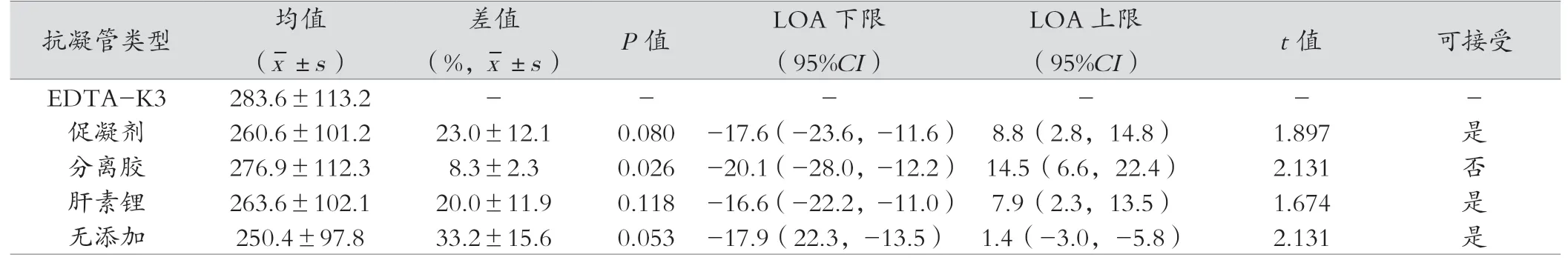
表1 不同采血管iPTH即刻均值及相关统计结果
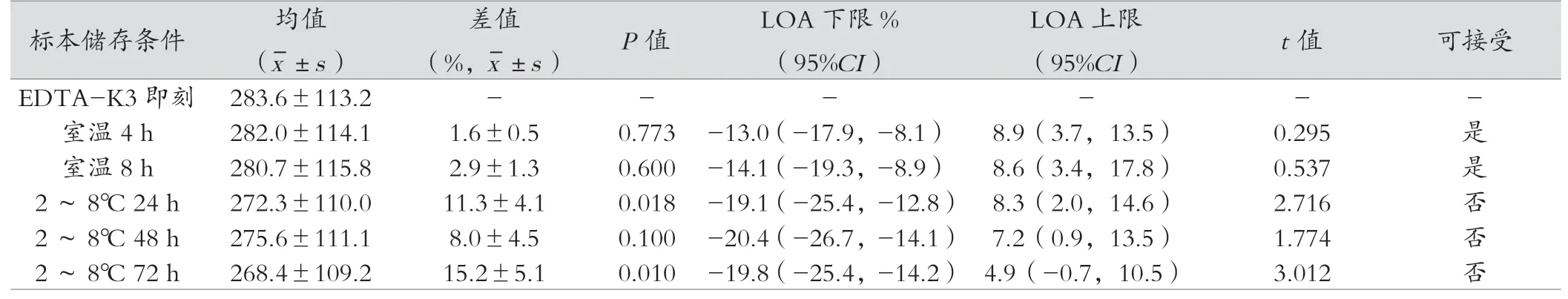
表2 EDTA-K3抗凝管不同储存条件下iPTH均值及相关统计结果

表3 肝素锂抗凝管不同储存条件iPTH均值及相关统计结果
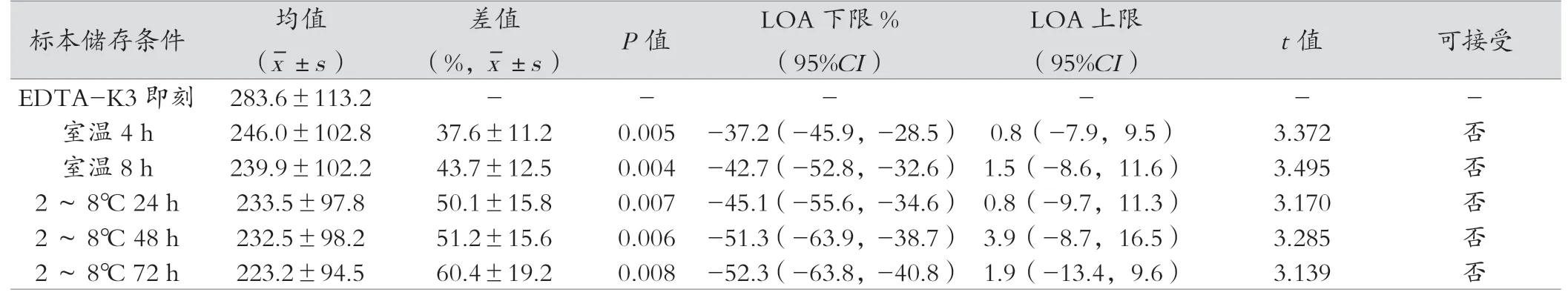
表4 分离胶管不同储存条件下iPTH均值及相关统计结果
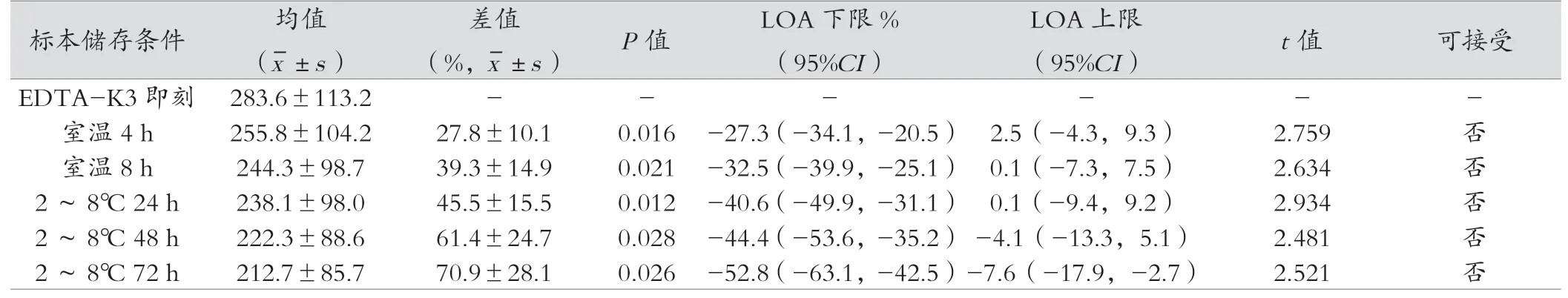
表5 促凝剂采血管不同储存条件下均值及相关统计结果
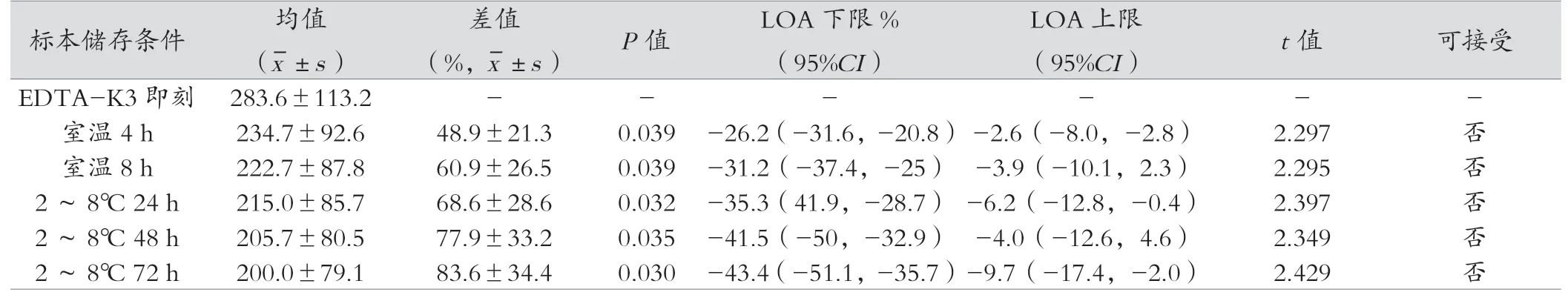
表6 无添加剂试管不同储存条件下均值及相关统计结果
美国国家临床实验室标准化委员会(CLSI)及本实验检测系统关于iPTH检测血液样本处理和保存的建议:EDTA血浆样本稳定性室温8 h,4℃可稳定72 h,血清样本室温稳定4 h,4℃稳定48 h。本实验结果显示EDTA-K3在室温4 h、8 h检测结果均在可接受误差范围内,2~8℃ 24 h、48 h、72 h检测结果均超过允许范围;肝素锂抗凝管在室温4 h的检测结果在允许误差范围内,而室温8h、2~8℃ 24 h、48 h、72 h检测结果均超过允许范围;促凝剂管、无添加剂管在室温4 h、8 h、2~8℃ 24 h、48 h、72 h检测结果均超过允许范围。首先造成结果差异的原因是本实验根据WHO对于iPTH检测项目样本采血管的要求,以EDTA为最佳抗凝剂,因此认为应以EDTA-K3即刻检测结果为标准,进行比较,而试剂说明书是以自身抗凝管为对照作为稳定性判断标准。肝素具有增强抗凝血酶活性的特质,血液标本经肝素抗凝作用后,抗凝血酶III活性增强,血小板聚集被抑制,具有抗凝效果好、离心速度快等优点[15];促凝剂管中添加了含硅石粉、碳素粉等具有非生理性促凝效果的成分,缩短了血液凝固时间,使血清能够快速分离,但其添加剂属于生物制剂,具有生物降解性质,在一定条件下可能产生降解,其降解的产物可能与待检物质产生化学反应[16];无添加剂管血液凝固时间长,血清不能快速分离,推测血液可能在凝固过程中加速了iPTH的分解;有学者的研究显示用肝素锂抗凝管检测,需放于2~8℃保存[17],也有研究表明,添加促凝剂的采血管可以使PTH快速降解[18];用无任何添加剂的采血管采集标本后,放置时间越久,PTH降解越快。本研究结果显示使用这两种采血管与EDTA-K3比较,存在明显差异,推测促凝剂及肝素锂试管中存在的其他物质影响血清里某些酶的活性,从而影响了iPTH的降解过程。但各种采血管在2~8℃ 24 h后降解速度均减缓,推测可能与血液中导致iPTH降解的酶已失活或者细胞死亡有关,低温环境更有利于iPTH的保存。
综上所述,本实验检测过程按照实验室正常工作流程进行检测,更接近于实验室真实的标本稳定性能。检测系统说明书中样本的处理和储存信息仅供用户参考,实验室用户可在行标基础上建立真实可靠,更合适的标本采集及稳定性标准。由于标本需要量大,本研究中无法对冷冻条件下iPTH的变化再进行检测分析,各种采血管条件下iPTH在-20℃、-70℃储存条件下是否更加稳定需要进一步的研究。

