流体剪切力促进大鼠髁突软骨细胞凋亡的实验研究
谢勉姣, 周 鹏, 段 晶, 马 秦, 王美青
(1. 军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔疾病国际联合研究中心,空军军医大学第三附属医院口腔解剖生理学教研室,2. 颌面外科,陕西 西安 710032;3. 佳木斯大学口腔医学院口腔基础医学教研室,黑龙江 佳木斯 154007)
软骨细胞死亡是骨关节炎主要的细胞学变化之一[1],因此,软骨细胞对力刺激的生物学响应规律备受关注。 颞下颌关节髁突软骨的主要功能之一是负重,生理性力刺激可促进髁突软骨的正常代谢活动,而异常力刺激则会影响细胞的正常功能,甚至导致细胞死亡[2]。 我们课题组在以往的研究中发现,不同强度的流体剪切力(FFSS)可以导致大鼠髁突软骨细胞出现不同的生物学响应[3-4]。
整合素(Integrin)是重要的细胞表面跨膜受体,其胞内区可以与骨架蛋白相接形成黏着斑,调节其与细胞外基质(extracellular matrix,ECM)的结合,并介导细胞内外力学信号的转导[5]。 肌动蛋白结合蛋白Talin 1 是细胞黏着斑的重要调节因子, 介导着Integrin 与肌动蛋白(F-actin)的相互联系,从而促进细胞的迁移和斑点附着[6]。 当整合素和Talin 1 与Factin 的结合因力刺激等原因而中断,细胞便失去与ECM 的联系, 过表达Bcl-2 家族中凋亡调节蛋白Bim, 释放线粒体双层膜腔内储存的细胞色素C(cytochrome C,Cyt C), 活化细胞内源性凋亡通路,激活Caspase-3,从而引发凋亡[7]。
Calpain 的活化可以激发其水解多种活性蛋白,参与细胞骨架重构、信号转导以及细胞凋亡等多种生理活动[8-9]。 细胞内钙稳态的失衡可以激活Calpain,而钙内流是细胞对力刺激的早期响应之一,钙内流增加可通过活化Calpain 亚基钙结合位点, 引起Calpain 的构象改变,促进细胞骨架相关蛋白水解等效应[10]。 本研究拟通过对软骨细胞加载FFSS 引发细胞凋亡,观察细胞内钙离子浓度的变化以及Calpain、Talin 和肌动蛋白在此期间的变化情况, 以论证在FFSS 刺激作用下,软骨细胞凋亡的相关分子机制。
1 材料和方法
1.1 原代髁突软骨细胞培养及剪切力加载
取3 周龄雌性大鼠 (购买于空军军医大学动物中心)10 只,体式显微镜下小心剥离髁突表面的组织,暴露软骨本体部分,分离大鼠髁突软骨细胞,于高糖培养基(HyClone 公司,美国)中剪碎后,1 500 r/min 离心5 min,收集组织,使用5 mL 胰酶(HyClone 公司,美国)于37 ℃消化组织20 min,使用2 mg/mL Ⅱ型胶原酶(Thermo 公司,美国)于37 ℃下消化组织120 min,最终收集1 500 r/min 离心5 min后的沉淀, 使用新制含1%双抗(HyClone 公司,美国),10%胎牛血清(Gibco 公司,美国)高糖培养基重悬培养细胞,每2 天换1 次液。
将获得的原代软骨细胞接种于加力专用载玻片(Flexcell 公司,美国)上,随机分为对照组(即0 h组)、加力0.5 h 组、加力1 h 组、加力2 h 组、加力4 h 组;当细胞生长至90%融合时,使用Flexcell 流体力学加载机以16 dyn/cm2(1 dyn/cm2=0.1 Pa)的剪切力进行不同时长的刺激。
1.2 钙离子含量检测
根据试剂盒(Beyotime 公司,中国)说明,制作钙离子含量标准曲线, 然后使用试剂盒中100 μL 细胞裂解液收集细胞,4 ℃、12 000×g离心5 min,取上清液;Bradford 法(Beyotime 公司,中国)进行蛋白浓度定量;设2 个重复孔,每个样本取5 μL,使用去离子水补齐至50 μL;每孔加入150 μL 新制检测工作液(检测缓冲液∶显色液=1∶1),室温避光孵育10 min;酶标仪(Eppendorf 公司,德国)检测575 nm 处吸光度值。 根据标准曲线求出每孔中钙离子的含量,根据蛋白浓度换算1 μg 总蛋白细胞中含有的钙离子量。
1.3 Calpain 活性检测
根据试剂盒(BioVision 公司,美国)说明,使用试剂盒中细胞裂解液100 μL 收集细胞,冰浴20 min后10 000×g离心1 min, 取上清液;Bradford 蛋白浓度定量后,取50 μg 总蛋白,使其体积为85 μL;设3 个重复孔,每个样本内加入10 μL 10×反应液和5 μL Calpain 底物;避光37 ℃孵育1 h;使用荧光酶标仪(Perkin Elmer 公司,美国)读取激发波长400 nm、发射波长505 nm 的荧光值。
1.4 细胞荧光染色
用磷酸缓冲盐溶液 (phosphate buffer saline,PBS)清洗细胞2 次后,4%甲醛溶液室温固定细胞10 min;PBS 冲洗3 次, 每次10 min,0.5% Triton X-100 溶液室温下通透细胞5 min;PBS 冲洗3 次,每次10 min,TRITC 标记鬼笔环肽 (Yeasen Biotech公司,中国)工作液覆盖住玻璃板上细胞,室温避光孵育30 min;PBS 冲洗3 次,每次10 min,含4′6-二脒基-2-苯基吲哚(DAPI)抗荧光淬灭封片剂(赫特生物公司,中国)封片;4 ℃避光保存,共聚焦显微镜(Nikon 公司,德国)下观察细胞。
1.5 蛋白质印迹(Western Blot)
于冰上使用200 μL 裂解液(BioVision 公司,美国)收集各组加载后的细胞,12 000 r/min 转速下离心5 min 后取上清液。 Bradford 法测定蛋白质浓度,取20 μg 总蛋白上样进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE) (BioBrad 公司,美国)分离蛋白,半干转法将蛋白转移至聚偏二氟乙烯膜(polyrinylidene fluoride,PVDF;Millipore 公司,美国)上后置于5%脱脂奶粉-TBST 封闭液中封闭60 min,稀释抗体Talin(1∶2 000)、Integrin β1(1∶5 000)、Bim(1∶2 000)(Abcam 公司,美国),Bcl-2(1∶500)、β-actin(1∶4 000)(Proteintech 公司,美国),Cleaved-Caspase-3(1∶1 000;Affinity 公司,美国)后置于4 ℃过夜孵育PVDF 膜, 次日复温30 min 后TBST 洗膜3 次, 每次10 min,HRP 二抗(Proteintech公司,美国)室温孵育60 min 后TBST 洗膜3 次,每次10 min,ECL 发光液(ZETA 公司,美国)显色发光,使用Image Lab 软件半定量分析图像灰度。
1.6 统计学处理
使用GraphPad Prism 8 软件进行数据分析。 实验独立重复3 次。 所有数据采取均数±标准差(±s)表示。 多组间比较采用单因素方差分析(one-way ANOVA),P<0.05 为差异有统计学意义。
2 结果
2.1 细胞内Ca2+浓度变化情况
使用钙离子检测试剂盒对细胞中钙离子含量的检测结果表明,16 dyn/cm2的FFSS 刺激0、0.5、1、2和4 h 后,蛋白总量为1 μg 的原代软骨细胞中钙离子的含量依次增加,于1 h 时达到峰值,并一直维持在较高水平(P<0.001,图1)。
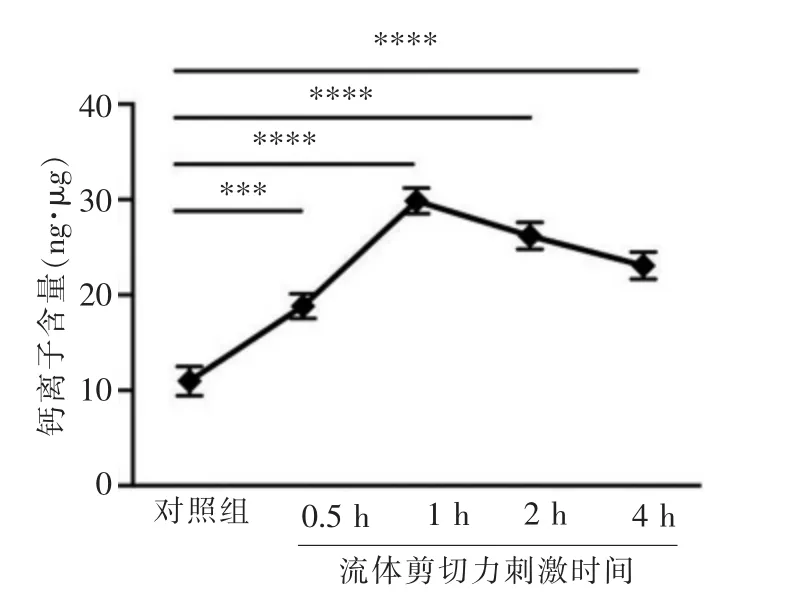
图1 原代软骨细胞在16 dyn/cm2 的FFSS 刺激下,总蛋白含量为1 μg 的细胞中钙离子含量在不同加力时长下的变化情况Figure 1 Stimulated by 16 dyn/cm2 fluid flow shear stress, the changes of calcium content at different time points of 1 μg total protein primary chondrocytes
2.2 Calpain 活性变化
使用Calpain 活性检测试剂盒检测发现,与0 h组相比,加载0.5 h 后Calpain 的水解产物荧光强度便明显升高,1 h 时达到高峰, 2 h 后依然维持在较高的活力水平(P<0.000 1),但4 h 时水解产物的荧光值降至0 h 组水平(P=0.151 8,图2)。
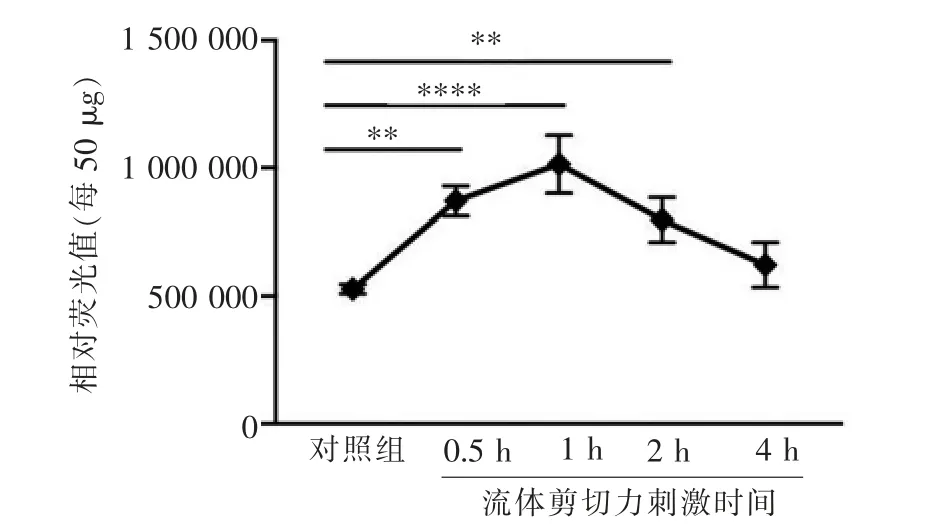
图2 不同时长16 dyn/cm2 的FFSS 刺激下, 每50 μg 总蛋白含量的原代软骨细胞内Calpain 的活性变化Figure 2 Changes of calpain activity of 50 μg total protein primary chondrocytes stimulated by 16 dyn/cm2 fluid flow shear stress at different time points
2.3 细胞骨架变化
使用鬼笔环肽对细胞骨架进行荧光染色观察,与0 h 组比较,剪切力刺激软骨细胞0.5 h 时,细胞骨架表达量减少得并不明显(P=0.1 147);而在刺激1、2 和4 h 后, 细胞骨架的表达量随加力时长的增加而逐渐减少(P<0.001,图3)。
2.4 Western blot 检 测Talin 1、Integrin β1、Bim、Bcl-2、和Cleaved-Caspase-3 的表达变化
Western blot 检测结果显示,Talin 1、Integrin β1和Bcl-2 蛋白的表达水平与0 h 组相比, 逐渐降低(P<0.01),而Bim 及Cleaved-Caspase-3 的蛋白表达水平与0 h 组相比明显升高(P<0.000 1,图4)。
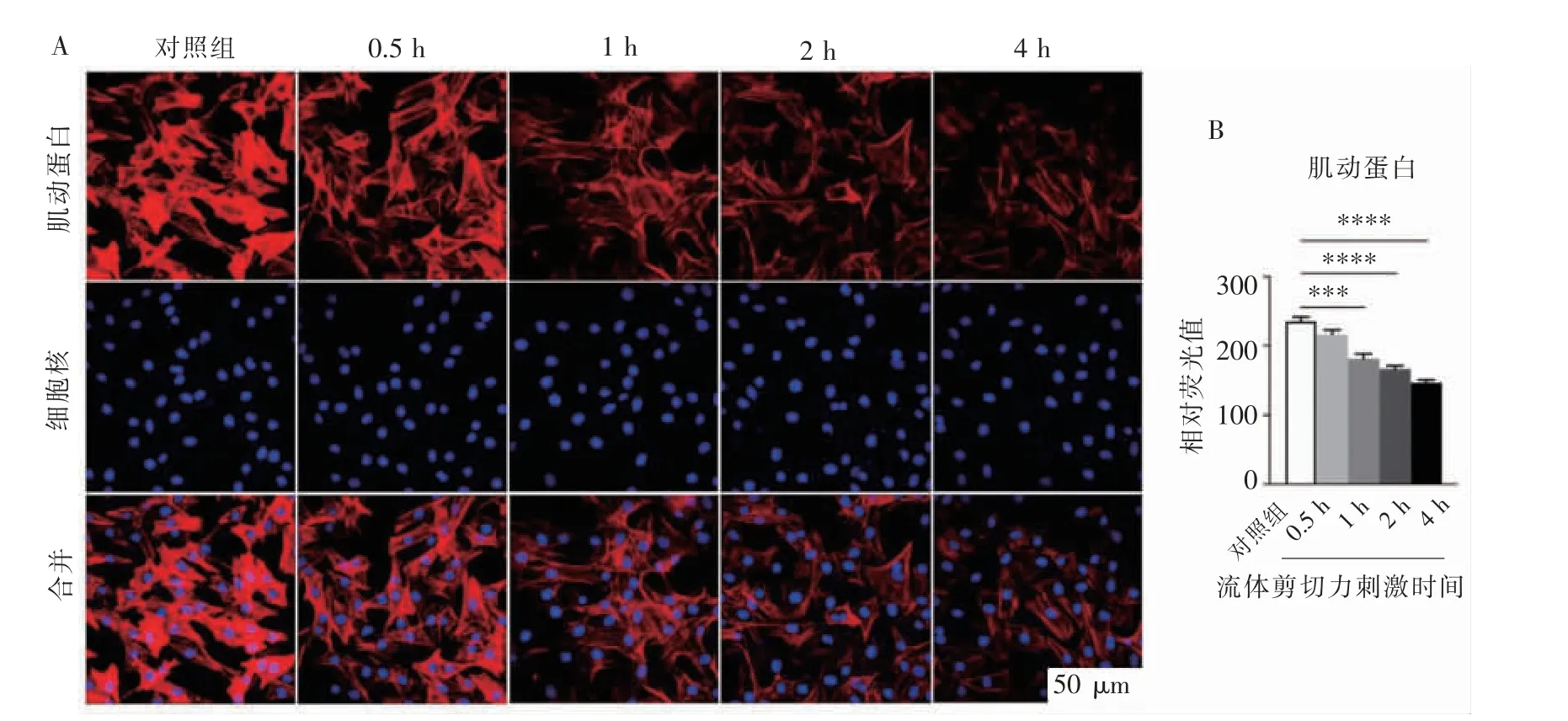
图3 不同时长16 dyn/cm2 的流体剪切力刺激下,细胞骨架F-actin 的变化情况Figure 3 The changes of cytoskeleton protein F-actin stimulated by 16 dyn/cm2 fluid flow shear stress at different time points
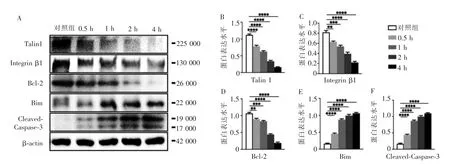
图4 Western blot 检测不同时长16 dyn/cm2 的流体剪切力刺激下,Talin 1、Integrin β1、Bcl-2、Bim 以及Cleaved-Caspase3 的蛋白水平表达情况及其灰度值组间比较Figure 4 Comparison of the expression level and its gray-scale value of Talin 1,Integrin β1, Bcl-2, Bim and Cleaved-Caspase-3 proteins stimulated by 16 dyn/cm2 fluid flow shear stress at different time points observed by Western blot
3 讨论
钙信号是真核细胞中最原始的第二信使,能够调控各种生理、生化过程[11-12]。 我们课题组早期的研究发现,在病理状况下,存在于细胞膜表面的力敏感性半通道蛋白Cx43 会异常活跃[13],使得钙离子以非选择性方式自由出入细胞, 导致细胞离子失衡,出现细胞死亡[14]。
Calpain 是钙信号的主要效应分子之一,广泛分布于细胞质和亚细胞器中,Calpain 常见的家族成员为Calpain1 和Calpain2, 微摩尔水平的Ca2+浓度即可激活Calpain,而毫摩尔水平的Ca2+才能激活Calpain2[15];当Calpain 被过量激活时,它将通过作用于凋亡相关的分子蛋白,参与调控细胞凋亡以及骨组织细胞退变的病理过程,造成相应组织器官的功能障碍[16]。 本研究中,FFSS 刺激组细胞内钙离子的含量明显高于不加力的对照组。
当细胞内钙离子浓度升高后,Calpain 的活性将被过度激活。Calpain 的水解底物包括大多数的细胞骨架蛋白,如桩蛋白(Paxillin)、黏着斑蛋白(Vinculin)和踝蛋白(Talin)[17];细胞骨架为细胞质提供了力学结构, 在机械压力的传导中起到核心作用,它的张力完整性直接影响细胞的形状及功能[18]。 研究的结果表明,加力初期,作为细胞骨架结构,肌动蛋白并未发生明显的变化,1 h 后随着加力时长的推移其含量越来越少,Talin 蛋白的表达水平也呈下降趋势,说明被激活的Calpain 降解骨架蛋白的活动增强。
Talin 是一种黏附分子, 是构成Integrin 和肌动蛋白物理连接的重要成分。Talin 与肌动蛋白相互作用保持黏着斑稳定,Talin 与Integrin 相结合, 诱导Integrin 胞外段亲和力改变,触发Integrin 形成细胞黏附[19]。本文的研究结果表明,在FFSS 刺激下,胞内大量的Talin 蛋白被Calpain 水解, 与其相结合的Integrin 表达水平也明显减少,这可以导致Talin 与Integrin 在胞内膜边缘的黏着斑水解,细胞黏附作用减弱,成为细胞凋亡的重要基础。
Bcl-2 蛋白家族中,Bcl-2 基因是一种原癌基因,具有抑制凋亡的作用, 而Bim 蛋白在Bcl-2 蛋白家族中行使的却是相反的作用——促进凋亡作用,Bcl-2 蛋白的表达量降低, 凋亡相关分子Bim 蛋白高表达, 均利于促进Bax-Bak 复合体于线粒体膜上形成孔道,破坏线粒体外膜的完整性,释放Cyt C,活化细胞内源性凋亡通路,使凋亡执行分子Caspase-3开始工作, 生成大量Caspase-3 执行功能活化形式的Cleaved-Caspase-3[20]。 本文的研究结果表明,FFSS作用下Calpain 的水解作用增强, 使得黏着斑被大量水解,激活细胞内内源性凋亡通路,最终激活凋亡执行分子Caspase-3 而导致细胞凋亡。
本研究中Calpain 活性于加力4 h 时降至与对照组无差异,可能是由于细胞经过长时间异常力刺激后进入凋亡期,细胞合成蛋白的能力受到明显的影响所致。 虽然FFSS 刺激4 h 后Calpain 的活性降低,但凋亡活动一直保持在较高的水平。
综上所述,本研究通过对原代髁突软骨细胞施加不同时长的流体剪切力刺激,使得胞内钙信号持续高度响应,进而活化细胞内Calpain,使其水解功能增强,细胞骨架相关蛋白Talin 被水解,进而引起细胞黏着斑松动,最终导致细胞凋亡。

