α-synuclein对多巴胺能神经元凋亡和氧化损伤影响
王静 苏东风 李岩松 邰旭辉 李迪 刘雨萌


[摘要]目的探讨α-共核蛋白(α-synuclein)对多巴胺能神经元凋亡、氧化损伤和炎症的调节作用。方法用H2O2诱导MES23.5细胞的氧化损伤,并在MES23.5细胞中过表达α-synuclein。用谷胱甘肽(GSH)来抵抗MES23.5细胞氧化损伤。采用流式细胞术检测细胞凋亡,分别采用相关试剂盒检测活性氧(ROS)、超氧化物歧化酶(SOD)、白细胞介素(IL)-6、IL-1β和肿瘤坏死因子-α(TNF-α)的水平,以Western blot法检测细胞中B淋巴细胞瘤-2基因蛋白(Bcl-2)和Bcl-2相关x蛋白(Bax)表达。结果过表达α-synuclein可提高MES23.5细胞凋亡率和ROS、IL-6、IL-1β及TNF-α水平,抑制细胞中的SOD活力(F=188.54~315.52,P<0.05)。H2O2可诱导α-synuclein过表达的MES23.5细胞中α-synuclein的表达、细胞凋亡率和ROS活力增加(F=196.49~251.74,P<0.05)。GSH处理α-synuclein过表达的MES23.5细胞后,α-synuclein表达降低,凋亡率和ROS活力降低(F=149.25~258.96,P<0.05)。结论氧化损伤能够增强α-synuclein促进的细胞凋亡和炎症反应,从而放大多巴胺能神经元的氧化损伤。
[关键词]α-共核蛋白;多巴胺能神经元;氧化还原酶类;细胞凋亡;帕金森病
[中图分类号]R322.8;R345.4[文献标志码]A[文章编号]2096-5532(2021)01-0095-05
[ABSTRACT]ObjectiveTo investigate the regulatory effects of α-synuclein on the apoptosis, oxidative damage, and inflammation of dopaminergic neurons. MethodsWe overexpressed α-synuclein in MES23.5 cells, and used H2O2 to induce oxidative damage and glutathione (GSH) to resist oxidative damage in MES23.5 cells. Flow cytometry was used to detect cell apoptosis. Test kits were applied to measure the levels of reactive oxygen species (ROS), superoxide dismutase (SOD), interleukin (IL)-6, IL-1β, and tumor necrosis factor-α (TNF-α). Western blot was used to determine the expression of B-cell lymphoma-2 protein and B-cell lymphoma-2-associated x protein. Resultsα-Synuclein overexpression increased the apoptosis rate, upregulated the levels of ROS, IL-6, IL-1β, and TNF-α, and inhibited the activity of SOD in MES23.5 cells (F=188.54-315.52,P<0.05). H2O2 increased α-synuclein expression, the apoptosis rate, and the activity of ROS in α-synuclein-overexpressed MES23.5 cells (F=196.49-251.74,P<0.05). GSH decreased the expression of α-synuclein, the apoptosis rate, and the activity of ROS in α-synuclein-overexpressed MES23.5 cells (F=149.25-258.96,P<0.05). ConclusionOxidative damage can enhance α-synuclein-mediated apoptosis and inflammatory response, which further amplifies the oxidative injury of dopaminergic neurons.
[KEY WORDS]α-synuclein; dopaminergic neurons; oxidoreductases; apoptosis; Parkinson disease
帕金森病(PD)病人多见黑质中多巴胺能神经元的选择性丢失[1-2],但不清楚此过程的发病机制。已发现Alzheimer病(AD)病人体内氧化应激反应过度增强以及神经炎症和凋亡级联反应的激活[3],且在PD的多巴胺能神经元变性中起关键作用[3-5]。α-共核蛋白(α-synuclein)异常积聚所参与引起的神经系统变性疾病统称为共核蛋白病,包括PD和AD等,表明α-synuclein可能在PD等神经退行性疾病中起作用[6]。聚集体的α-synuclein蛋白是PD的病理学标志物[7],且在PD病人运动障碍发生前能够检测出α-synuclein表达[8]。已有研究结果显示,抑制α-synuclein的表达有助于改善砷誘导的多巴胺细胞PC12的凋亡[9],表明α-synuclein有潜力成为PD诊疗的关键靶点之一[10]。然而,α-synuclein对多巴胺能神经元氧化应激的影响仍不明确。因此,本文通过在体外多巴胺能神经元细胞中过表达α-synuclein,研究α-synuclein对细胞损伤、炎症、氧化应激的作用,旨在为PD病人认知障碍的治疗提供新靶点和新思路。
1材料与方法
1.1实验材料
多巴胺能神经元细胞MES23.5(MZ-1693,明舟生物,宁波);胎牛血清(Thermo Fisher Scientific,美国);DMEM/F12培养基(Sigma-Aldrich)和2,7-二氯荧光素二乙酸酯(DCFDA,D6883,Sigma-Aldrich)(Merck KGaA,美国);共聚焦显微镜(Carl Zeiss LSM 700 Meta,Zeiss,德国);超氧化物气化酶(SOD)活性检测试剂盒(S0109)和RIPA裂解缓冲液(碧云天生物技术研究所,上海);酶联免疫吸附试验(ELSIA)试剂盒(CSB-E08556m, 华美生物,武汉);BCA蛋白测定试剂盒(Bio-Rad Laboratories,美国);α-synuclein抗体(ab52168,Abcam,美国);B淋巴细胞瘤-2基因蛋白(Bcl-2)抗体(05-826)和Bcl-2相关x蛋白(Bax)抗体(MAB4601)(EMD Millipore,美国);兔抗小鼠IgG-辣根过氧化物酶二抗(sc-358914,Santa Cruz Biotechnology,美国);谷胱甘肽(GSH,70-18-8,Sigma-Aldrich,Merck KGaA,美国);α-synuclein 过表达的重组pcDNA3.1+质粒(pcDNA-α-synuclein)及pcDNA3.1+空质粒阴性对照(pcDNA-NC)构建(吉凯基因医学科技股份有限公司,上海);膜联蛋白V(Annexin V,AV)-异硫氰酸荧光素(FITC)细胞凋亡检测试剂盒(KGA106,江苏凯基生物技术股份有限公司,南京);结合缓冲液(00-4222-57,Thermo)。
1.2實验方法
1.2.1细胞培养和处理分组将MES23.5细胞培养于含有体积分数0.05胎牛血清的DMEM/F12培养基,置37 ℃含体积分数0.05 CO2湿润培养箱。将MES23.5细胞分为5组。空白对照组(①组):无处理。pcDNA-NC组(②组):细胞培养4 h后用空载质粒处理4 h。α-synuclein过表达组(pcDNA-α-synuclein,③组):用细胞培养液培养4 h以重组质粒pcDNA-α-synuclein处理24 h。α-synuclein过表达+H2O2组(H2O2+pcDNA-α-synuclein,④组):用H2O2处理后的细胞培养液培养4 h后再以重组质粒pcDNA-α-synuclein转染24 h。α-synuclein+GSH(GSH+pcDNA-α-synuclein,⑤组):用GSH处理后细胞培养液培养4 h后以重组质粒pcDNA-α-synuclein转染24 h。重复6次。
1.2.2流式细胞术检测凋亡率用AV-FITC细胞凋亡检测试剂盒分析样品凋亡变化。收集细胞,用冰冷PBS洗涤2次,以结合缓冲液(500 μL)悬浮细胞。随后,细胞用AV-FITC试剂和碘化丙啶(PI)染色。在FACS Calibur流式细胞仪上通过Cell Quest软件计算细胞的凋亡率。
1.2.3细胞活性氧(ROS)水平检测使用荧光染料DCFDA检测ROS水平。将MES23.5细胞以每孔2×104的密度接种在96孔细胞板中。将细胞与2.5 μmol/L的DCFDA在37 ℃下孵育15 min。然后,通过Car Zeiss共聚焦显微镜分别在485 nm激发和535 nm发射波长下获得DCFDA荧光。利用共聚焦激光扫描显微镜自带的ZEN 2008软件计算ROS的相对含量。
1.2.4细胞内SOD活力检测收集MES23.5细胞,使用冷的PBS溶液匀浆细胞,4 ℃离心后,取上清作为待测样品,并严格按照总SOD活性检测试剂盒说明检测其活力。
1.2.5ELSIA检测相关细胞因子收集MES23.5细胞培养物的上清液。采用相应试剂盒分别检测白细胞介素(IL)-6、IL-1β和肿瘤坏死因子-α(TNF-α)的含量。
1.2.6Western blot法检测Bcl-2和Bax蛋白的表达使用RIPA裂解缓冲液进行总蛋白提取。使用BCA试剂盒检测蛋白质的浓度。通过SDS-PAGE(120 g/L分离胶,40 g/L浓缩胶)分离蛋白样品(每泳道20 μg),转移到聚偏二氟乙烯膜上。室温下使用50 g/L脱脂牛奶将膜封闭1 h,随后在4 ℃下与α-synuclein抗体(1∶600)、Bax抗体(1∶200)和抗体Bcl-2(1∶500)反应。将膜与兔抗小鼠IgG-辣根过氧化物酶二抗(1∶5 000)在室温下再孵育2 h。随后,将膜用Tris缓冲液和聚山梨醇酯20洗涤7次(每次3 min)。化学发光信号使用增强的化学发光检测试剂进行显色。使用Image J 1.4软件分别计算α-synuclein、Bcl-2及Bax蛋白的相对表达量。
1.3统计学处理
使用Graph Pad Prism 6.0软件进行统计分析。计量资料数据以±s表示,3组间均数比较用单因素方差分析,均数间两两比较采用q检验(SNK法,Student-Newman-Keuls)。以P<0.05为差异具有统计学意义。
2结果
2.1α-synuclein过表达对细胞凋亡的影响
Western blot检测结果表明,与空白对照组和pcDNA-NC组相比较,pcDNA-α-synuclein组中α-synuclein的表达上调,差异具有统计学意义(F=241.251、249.163,q=4.254~36.771,P<0.05),pcDNA-NC组与空白对照组之间无明显差异(P>0.05)。过表达α-synuclein效率检测结果见图1A、表1。细胞凋亡率检测结果表明,与空白对照组和pcDNA-NC组相比较,pcDNA-α-synuclein组凋亡率明显增加,差异具有统计学意义(F=233.214、316.201,q=6.725~41.202,P<0.05);另外,空白对照组与pcDNA-NC组相比,凋亡率差异无显著意义(P>0.05)。见图1B、表1。
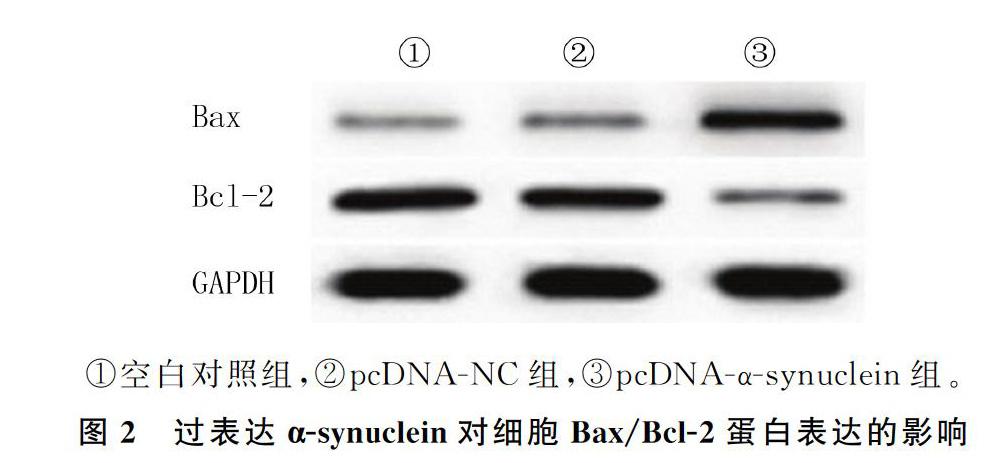
2.2α-synuclein过表达对Bax/Bcl-2表达影响
Western blot的检测结果表明,与空白对照组和pcDNA-NC组相比较,pcDNA-α-synuclein组中Bax表达和Bax/Bcl-2蛋白表达比值上调,而Bcl-2蛋白表达下调,差异有统计学意义(F=266.891~426.347,q=7.044~37.451,P<0.05);空白对照组与pcDNA-NC组的Bax、Bcl-2蛋白表达和Bax/Bcl-2蛋白表达量均无明显差异(F=0.014~0.052,q=2.142~4.477,P>0.05)。见图2、表1。
2.3α-synuclein过表达对细胞SOD活力和ROS含量影响
与空白对照组和pcDNA-NC组比较,pcDNA-α-synuclein组中ROS含量上调,而SOD活力下调,差异具有统计学意义(F=198.523、188.544,q=6.261~35.668,P<0.05);空白对照组与pcDNA-NC组的ROS含量和SOD活力均无明显变化(P>0.05)。见表2。
2.4α-synuclein过表达对细胞IL-6、IL-1β以及TNF-α水平影响
炎症反应检测表明,与空白对照组和pcDNA-NC组相比较,pcDNA-α-synuclein组IL-6、IL-1β和TNF-α水平均明显增加,差异具有统计学意义(F=201.33~315.52,q=3.256~36.214,P<0.05);另外,与空白对照组相比,pcDNA-NC中IL-6、IL-1β、TNF-α水平均无明显变化(F=0.088~0.245,q=1.014~2.331,P>0.05)。见表2。
2.5细胞氧化损伤对细胞α-synuclein表达和凋亡影响
本文的检测结果表明,pcDNA-α-synuclein组、H2O2+pcDNA-α-synuclein组和GSH+pcDNA-α-synuclein组α-synuclein表达量分别为0.999±0.087、1.932±0.207和0.623±0.076,细胞的凋亡率分别为(14.336±2.328)%、(22.667±2.541)%和(15.667±2.541)%。与pcDNA-α-synuclein组比较,H2O2+pcDNA-α-synuclein组α-synuclein表达增加,而GSH+pcDNA-α-synuclein组α-synuclein表达降低,差异有统计学意义(F=268.41,q=11.218、41.205,P<0.05)。与pcDNA-α-synuclein比较,H2O2+pcDNA-α-synuclein组中细胞凋亡增加,差异具有统计学意义(F=159.25,q=21.362,P<0.05),而GSH+pcDNA-α-synuclein组细胞凋亡无明显变化(P>0.05)。
3讨论
PD的特征是黑质中多巴胺能神经元的进行性及不可逆性丢失。该病是继AD之后的第二大最常见的神经退行性疾病[11]。研究表明,α-synuclein参与了多种生物过程,包括神经退行性疾病的发病机制和脑功能异常等[12]。synuclein家族包括α-、β-和γ-synuclein以及突触胶,α-synuclein是其家族中的高丰度蛋白。尽管它们可能在神经可塑性和对神经元细胞损伤的反应中起重要作用[13],但是这些蛋白质的确切生理作用尚不清楚。
α-synuclein是一种具有聚合成低聚物潜力的蛋白质,其过表达可促进多种细胞系和动物模型中凋亡细胞的死亡[14]。α-synuclein的表达被认为是重金属诱导神经毒性的关键因素。在锰处理的小鼠体内发现伴随α-synuclein的积聚增加,氧化应激标志物ROS水平的同时升高并导致SOD活力的减低以及氧化损伤增强。而且研究已表明,氧化应激诱导α-synuclein的翻译后修饰并促進α-synuclein积聚[15]。这表明α-synuclein和氧化应激存在协同调节作用。另有研究结果表明,在表达α-synuclein的神经元细胞中发现了与家族性PD相关的基因突变(A30P和A53T),导致细胞对氧化应激分子的敏感性增加[16]。本文结果显示,过表达α-synuclein的多巴胺能神经元中ROS含量明显升高,而抗氧化剂SOD活力降低。表明α-synuclein可能提高多巴胺能神经元的氧化应激敏感性从而增加氧化伤害。
氧化应激损伤在PD的发病机制中起核心作用[17],而且异常表达的α-synuclein在细胞内的长期积累能促进氧化应激损伤和线粒体改变,可能导致多巴胺能神经元凋亡和死亡增加[18]。本研究结果进一步证实,在多巴胺能神经元中过表达α-synuclein可诱导细胞的凋亡,并导致Bax/Bcl-2比值的升高。Bcl-2和Bax这两种蛋白是细胞凋亡的重要调节剂,Bax/Bcl-2比值的增加可导致促凋亡蛋白从线粒体释放到细胞质,增加细胞的凋亡[19]。此外,最近已证明α-synuclein被miRNA-7靶向抑制后,多巴胺能神经元细胞的凋亡减少[20]。另外,α-synuclein基因敲低可改善脊髓损伤大鼠的神经细胞损伤[21]。在体外和体内的实验结果已表明,抑制α-synuclein的表达可以抑制细胞凋亡并促进神经再生[22]。提示α-synuclein在细胞中的表达增加可能是PD病变中多巴胺能神经元凋亡和死亡的关键原因,且与Bax/Bcl-2比值增加有关。
多种细胞过程如神经细胞凋亡、神经炎症、线粒体功能障碍等的协同作用参与PD病人神经细胞损伤的发展[12,23]。本研究中除证实α-synuclein可以诱导多巴胺能神经元的凋亡和ROS增加外,还显示α-synuclein过表达能增强多巴胺能神经元的促炎症反应,在过表达α-synuclein多巴胺能神经元的培养上清中,观察到IL-6、IL-1β和TNF-α等水平都明显上调。表明α-synuclein不仅诱导氧化应激损伤,而且可能介导多巴胺能神经元的促炎症反应增强,从而加重神经元细胞的损伤。
ROS的过量产生和氧化应激的诱导已被证明与PD相关,并导致多巴胺能神经元细胞死亡和凋亡[24]。近期的研究结果已表明,miRNA-7靶向抑制α-synuclein后可减轻多巴胺能神经元细胞的凋亡和氧化损伤[25]。本文结果也表明,使用GSH处理α-synuclein过表达的多巴胺能神经元细胞,不仅可抑制α-synuclein蛋白表达,而且使细胞凋亡率降低。说明抑制α-synuclein表达与多巴胺能神经元细胞的氧化损伤减弱有关。另外,体外实验结果也表明,体外神经元细胞的氧化损伤中α-synuclein的表达异常增加[26]。而本研究证实,H2O2进一步促进了α-synuclein过表达的多巴胺能神经元细胞中α-synuclein表达水平,提高其凋亡率。表明氧化应激可能具有强化α-synuclein凋亡诱导的功能,进一步加强多巴胺能神经元细胞的损伤。
综上所述,α-synuclein对多巴胺能神经元损伤具有促进作用,而多巴胺能神经元的氧化损伤可加重α-synuclein对细胞内ROS、促炎症因子和细胞凋亡的诱导作用。本研究丰富了PD的发病机制探索的理论基础,为PD的诊断和治疗提供了潜在靶标。但本研究仍存在一些缺陷,今后需要在PD动物模型体内验证α-synuclein对多巴胺能神经元损伤的调节作用。
[参考文献]
[1]袁红,张振文,梁立武,等. 帕金森氏病的治疗策略[J]. 神经科学通报(英文版), 2010,26(1):66-76.
[2]KALIA L V, LANG A E J L. Parkinsons disease [J]. 2015,386(9996):896-912.
[3]ANDICAN G, KONUKOGLU D, BOZLUOLCAY M, et al. Plasma oxidative and inflammatory markers in patients with idiopathic Parkinsons disease[J]. Acta Neurologica Belgica, 2012,112(2):155-159.
[4]MULLIN S, SCHAPIRA A H V. Pathogenic mechanisms of neurodegeneration in parkinson disease[J]. Neurologic Clinics, 2015,33(1):1-17.
[5]MAITI P, MANNA J, DUNBAR G L. Current understanding of the molecular mechanisms in Parkinsons disease: targets for potential treatments[J]. Translational Neurodegeneration, 2017,6:28. doi:10.1186/s40035-017-0099-z.
[6]HIJAZ B A, VOLPICELLI-DALEY L A. Initiation and propagation of α-synuclein aggregation in the nervous system[J]. Molecular Neurodegeneration, 2020,15(1):19. doi:10.1186/s13024-020-00368-6.
[7]DODIYA H B, FORSYTH C B, VOIGT R M, et al. Chronic stress-induced gut dysfunction exacerbates Parkinsons disease phenotype and pathology in a rotenone-induced mouse model of Parkinsons disease[J]. Neurobiology of Disease, 2020,135:104352. doi:10.1016/j.nbd.2018.12.012.
[8]陳艇,程琼,周瑞玲. 帕金森病非痴呆与帕金森病痴呆患者血浆α-突触核蛋白、tau蛋白水平比较及临床意义[J]. 创伤与急诊电子杂志, 2018,6(3):131-135.
[9]WU Y, JIANG X J, YANG K, et al. Inhibition of α-Synuclein contributes to the ameliorative effects of dietary flavonoids luteolin on arsenite-induced apoptotic cell death in the dopa-minergic PC12 cells[J]. Toxicology Mechanisms and Methods, 2017,27(8):598-608.
[10]GIBBONS C H, GARCIA J, WANG N S, et al. The diagnostic discrimination of cutaneous α-synuclein deposition in Parkinson disease[J]. Neurology, 2016,87(5):505-512.
[11]潘峰. 姜黄素对鱼藤酮损伤的多巴胺能神经元的保护作用[J]. 郑州大学学报(医学版), 2016,51(2):271-274.
[12]郑远鹏,臧彩霞,王璐,等. 脂多糖加重α-synuclein基因突变小鼠多巴胺能神经元损伤机制的研究[J]. 药学学报, 2017,52(5):729-736.
[13]唐智伟,张淑坤,吴世政. Tau蛋白与α-突触核蛋白在常见神经系统退行性疾病中的致病机制[J]. 海南医学, 2017,28(3):451-455.
[14]QIAO H H, ZHU L N, WANG Y, et al. Implications of alpha-synuclein nitration at tyrosine 39 in methamphetamine-induced neurotoxicity in vitro and in vivo[J]. Neural Regeneration Research, 2019,14(2):319-327.
[15]PERES T V, PARMALEE N L, MARTINEZ-FINLEY E J, et al. Untangling the manganese-α-synuclein web[J]. Frontiers in Neuroscience, 2016,10:364. doi:10.3389/fnins.2016.00364.
[16]HENDERSON M X, SEDOR S, MCGEARY I, et al. Glucocerebrosidase activity modulates neuronal susceptibility to pathological α-synuclein insult[J]. Neuron, 2020,105(5):822-836.e7.
[17]REKATSINA M, PALADINI A, PIROLI A, et al. Pathophysiology and therapeutic perspectives of oxidative stress and neurodegenerative diseases: a narrative review[J]. Advances in Therapy, 2020,37(1):113-139.
[18]HU D, SUN X Y, LIAO X D, et al. Alpha-synuclein suppresses mitochondrial protease ClpP to trigger mitochondrial oxidative damage and neurotoxicity[J]. Acta Neuropathologica, 2019,137(6):939-960.
[19]HUANG K, ONEILL K L, LI J, et al. BH3-only proteins target BCL-xL/MCL-1, not BAX/BAK, to initiate apoptosis[J]. Cell Research, 2019,29(11):942-952.
[20]JUNN E, LEE K W, JEONG B S, et al. Repression of-synuclein expression and toxicity by microRNA-7[J]. PNAS, 2009,106(31):13052-13057.
[21]ZENG H, YU B F, LIU N, et al. Transcriptomic analysis of α-synuclein knockdown after T3 spinal cord injury in rats[J]. BMC Genomics, 2019,20(1):851.
[22]PERIER C, BOV J, VILA M. Mitochondria and programmed cell death in Parkinsons disease: apoptosis and beyond[J]. Antioxidants & Redox Signaling, 2012,16(9):883-895.
[23]梁丹陽,戴汉川. PINK1/Parkin通路在线粒体自噬氧化损伤中的作用[J]. 中国细胞生物学学报, 2018,40(1):116-123.
[24]YADAVA N, NICHOLLS D G. Spare respiratory capacity rather than oxidative stress regulates glutamate excitotoxicity after partial respiratory inhibition of mitochondrial complex I with rotenone[J]. Journal of Neuroscience, 2007,27(27):7310-7317.
[25]JE G, KIM Y S. Mitochondrial ROS-mediated post-transcriptional regulation of α-synuclein through miR-7 and miR-153[J]. Neuroscience Letters, 2017,661:132-136.
[26]XIE H J, WU J. Silica nanoparticles induce alpha-synuclein induction and aggregation in PC12-cells[J]. Chemico-Biological Interactions, 2016,258:197-204.
(本文编辑 于国艺)

