全程新辅助治疗局部进展期直肠癌疗效和安全性的Meta分析
李干斌 韩加刚 王振军
新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)、全直肠系膜切除术(total mesorectal excision,TME)和术后辅助化疗是中低位局部进展期直肠癌的标准治疗策略[1-3]。“nCRT+TME+术后辅助化疗”诊疗模式显著提高了肿瘤的局部控制率,直肠癌术后局部复发率从35%降至5%~10%[4],但远处转移率仍高达25%~30%,而且是影响生存预后的主要因 素[5]。 CAO/ARO/AIO-94 研 究[2]、 EORTC 22921研究[3]均表明,nCRT并未改善直肠癌患者的长期生存预后,且患者对术后辅助化疗的依从性较差。
为进一步降低直肠癌患者的远处转移率并改善生存,有学者提出了“强化治疗”方案。一是增加放疗剂量;二是在以5-FU为基础的同步化疗方案中加入另外一种细胞毒药物,如奥沙利铂;三是将术后辅助化疗放在TME之前进行,即全程新辅助治疗(total neoadjuvant therapy,TNT)[6]。TNT有诱导化疗和巩固化疗两种模式,诱导化疗是指在nCRT之前行若干周期的全身化疗,而巩固化疗则是在nCRT和TME之间进行。美国国家综合癌症治疗协作网将TNT列为局部进展期直肠癌的推荐治疗策略之一[7]。本研究拟通过对相关研究的Meta分析,进一步探讨TNT的疗效和生存预后情况。
资料与方法
一、文献纳入与排除标准
纳入标准:(1)文献类型:与TNT治疗局部进展期直肠癌有关的临床研究,限定语种为中文和英文;(2)研究对象:经肠镜病理确诊的中低位局部进展期直肠癌患者;(3)干预措施:试验组接受TNT,对照组接受nCRT;(4)观察指标:pCR率、肿瘤降期率、R0切除率、保肛率、3/4级急性毒性反应发生率、围手术期并发症发生率、局部复发和远处转移率、5年OS和DFS等。
排除标准:单臂研究;综述、病例报告或会议摘要等;采取生物治疗的研究,如西妥昔单抗、贝伐单抗等;未报道上述任一观察指标的研究。
二、检索策略
对中文数据库(中国知网、万方、中国生物医学文献数据库)和英文数据库(PubMed、Embase)进行全面检索。中文检索策略:“直肠癌”或“直肠恶性肿瘤”并且“新辅助放化疗”或“全程新辅助治疗”或“诱导化疗”或“巩固化疗”。英文检索策略:“neoadjuvant chemoradiother‐apy”OR“total neoadjuvant therapy”OR“induc‐tion therapy” OR “conslidation therapy” AND“rectal cancer” OR “rectal tumor”。
三、资料收集与数据提取
由两名独立研究员结合纳入和排除标准进行文献筛选。若对检索结果存在争议,则协商解决;若协商后仍存在争议,则交由第三名研究者解决。严格遵循设计的表格进行数据提取,主要内容有作者以及发表年份、国家、研究类型、基线资料、观察指标等内容。
四、文献质量评价
随机对照研究的质量评价采用Cochrane协作网推荐的偏倚评价工具,包括6个方面:随机、分配隐藏、盲法、结果的完整性、研究结果的选择性报告以及其他偏倚来源。每项指标均按“low risk”、“unclear”、“high risk”进行评价。非随机对照研究的方法学评价选择Newcastle-Ottawa Scale(NOS)量表[8]。评价内容包括研究人群选择、可比性、暴露和结果评价四个方面。NOS采用半量化原则的星级系统,满分为9颗星,评分大于5分的研究纳入分析。
五、统计学方法
采用Cochrane协作网提供的RevMan 5.3软件进行统计学分析。二分类计量资料选择比值比(odds ratio,OR)以及95%可信区间(confidence interval,CI)表示;生存资料选择风险比(hazard ratio,HR)以及95%CI表示。异质性检验选择统计量I2和Q检验,若I2>0.5,说明异质性较大,选择随机效应模型;若I2<0.5,则选择固定效应模型。纳入研究的发表偏移分析选择漏斗图。P<0.05表示差异有统计学意义。
结 果
一、纳入文献基本情况及质量评价
研究共纳入符合标准的文献14篇,其中6篇随机对照研究,5篇回顾性病例对照研究,3篇为前瞻性研究[9,11-15,18-25](图 1)。共纳入直肠癌患者3 797例,其中TNT组1 865例,nCRT组1 932例。纳入研究的一般特征见表1,各研究采取的放化疗方案见表2。随机对照研究的质量评价结果见图2,非随机对照研究质量评价得分均不低于5分。

图1 纳入研究流程图
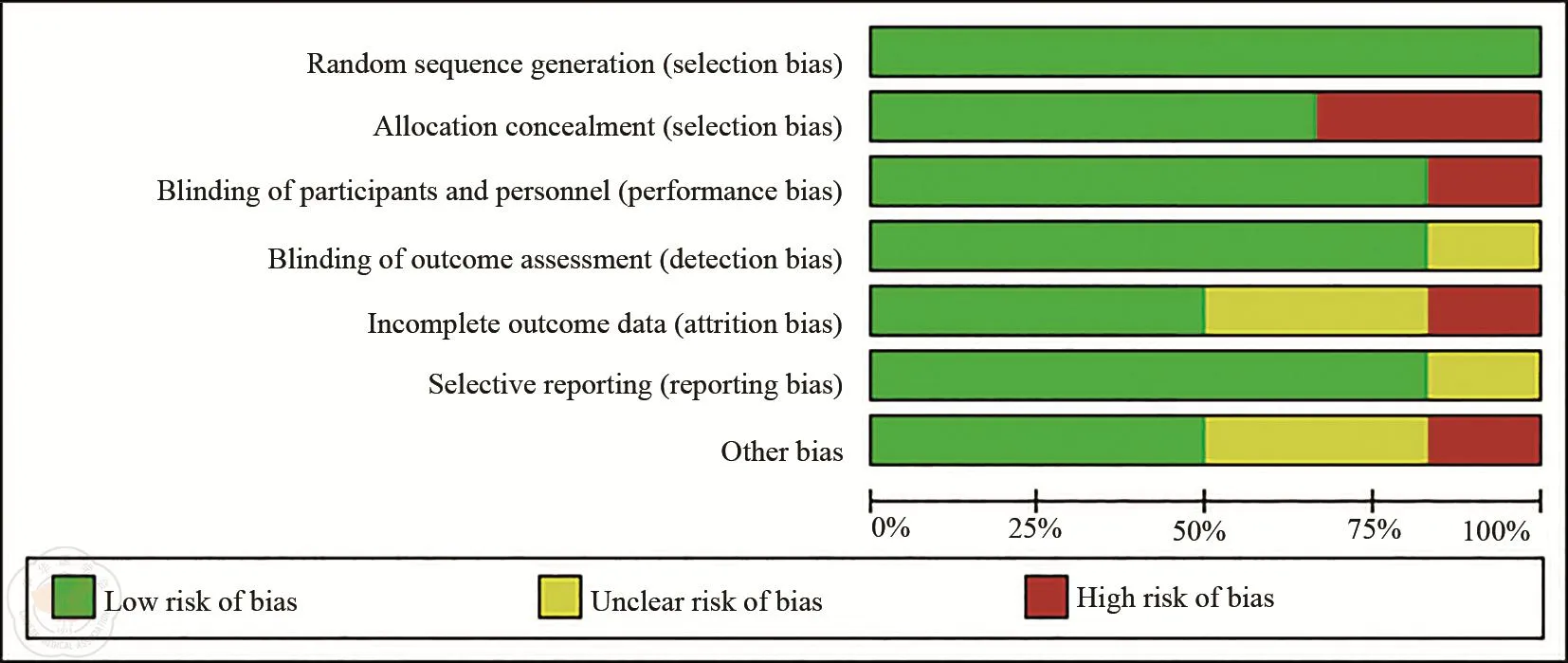
图2 纳入随机对照研究的质量评价表

表1 纳入研究一般特征

表2 TNT组和nCRT组放化疗方案及具体剂量
二、TNT安全性评价
1.3 /4级急性毒性反应共10项研究报道了TNT或nCRT期间3/4级急性毒性反应发生率[9,11,13,15,18-19,21-23,25]。各研究之间异质性较大(I2=80%),选择随机效应模型。Meta分析结果表明,TNT组3/4级急性毒性反应发生率与nCRT组差异无统计学意义(OR=0.79,95%CI:0.47~1.32,P=0.36)。见图3。
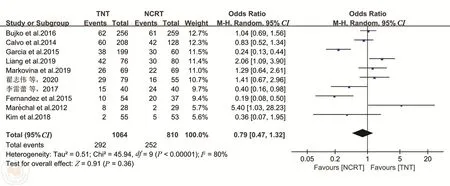
图3 TNT和nCRT组急性3/4级毒性反应的比较分析
2.围手术期并发症共8项研究报道了围手术期并发症情况[7,11,15-19,21,23-24]。各研究之间异质性较小(P=0.62,I2=0%),选择固定效应模型。Meta分析结果表明,两组的围手术期并发症发生率差异无统计学意义(OR=1.02,95%CI:0.78~1.33,P=0.87)。见图4。

图4 TNT和nCRT组围手术期并发症的比较分析
三、TNT围手术期疗效评价
1.pCR率共13项研究将pCR作为主要结局指标[11-18,20-25]。各研究之间异质性较小(P=0.54,I2=0%),选择固定效应模型。Meta分析结果显示,TNT组的pCR率显著高于nCRT组(OR=1.57,95%CI:1.30~1.90,P<0.00001)。见图5。

图5 TNT和nCRT组pCR率的比较分析
2.肿瘤降期率共6项研究报道了T分期降期率[13,18-19,22-23,25]。各研究之间异质性较小 (P=0.26,I2=24%),选择固定效应模型。Meta分析结果显示,TNT组的T分期降期率显著高于nCRT组(OR=2.16, 95%CI: 1.63~2.57,P<0.00001)。见图6。
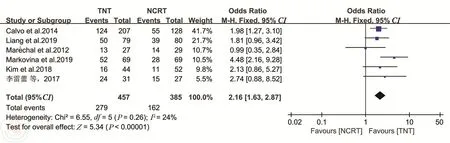
图6 TNT和nCRT组肿瘤T分期降期率的比较分析
3.R0切除率共11项研究报道了TNT或nCRT后的 R0 切除率[7,11,14-19,20-25]。各研究之间异质性较小(P=0.10,I2=38%),选择固定效应模型。Meta分析结果显示,TNT组的R0切除率显著高于nCRT 组 (OR=1.42, 95%CI: 1.09~1.85,P=0.009)。见图7。
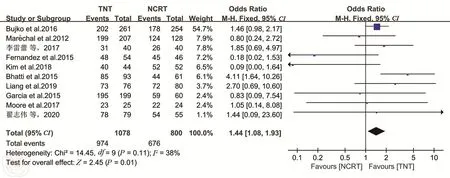
图7 TNT和nCRT组R0切除率的比较分析
4.保肛率共13项研究报道了TNT或nCRT后的保肛率[7,11-13,15-24]。各研究之间异质性较小(P=0.08,I2=41%),选择固定效应模型。Meta分析结果显示,TNT组与nCRT组的保肛率差异无统计学意义(OR=0.99,95%CI:0.82~1.19,P=0.88)。见图8。
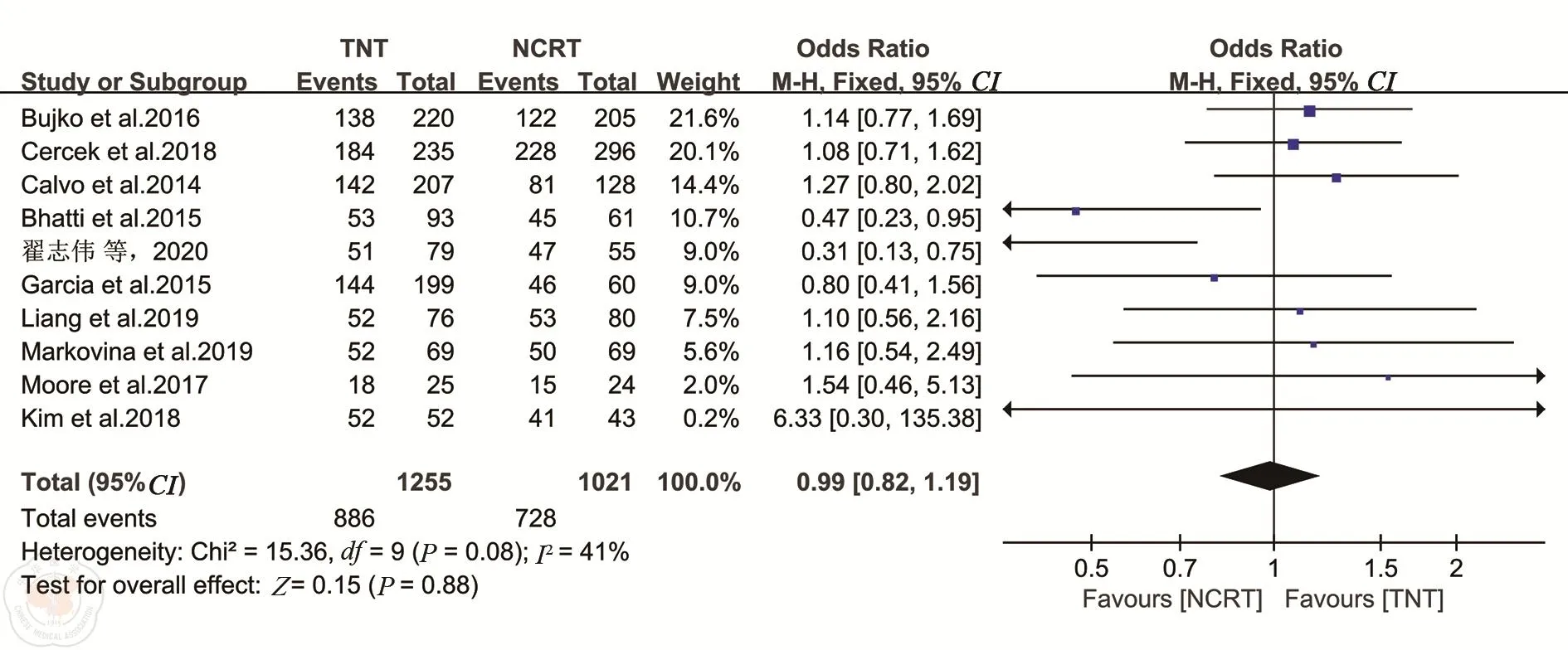
图8 TNT和nCRT组保肛率的比较分析
四、TNT生存预后分析
1.局部复发和远处转移各有4项研究报道了随访期间肿瘤的局部复发[16,20,23,25]和远处转移[16,20,22,25]情况。各研究之间异质性较小(均I2=0%),选择固定效应模型。Meta分析结果表明,TNT组与nCRT组的局部复发率差异无统计学意义(OR=0.89,95%CI:0.47~1.69,P=0.73)(图9);两组的远处转移率相近(OR=1.11,95%CI:0.81~1.52,P=0.5)。见图10。
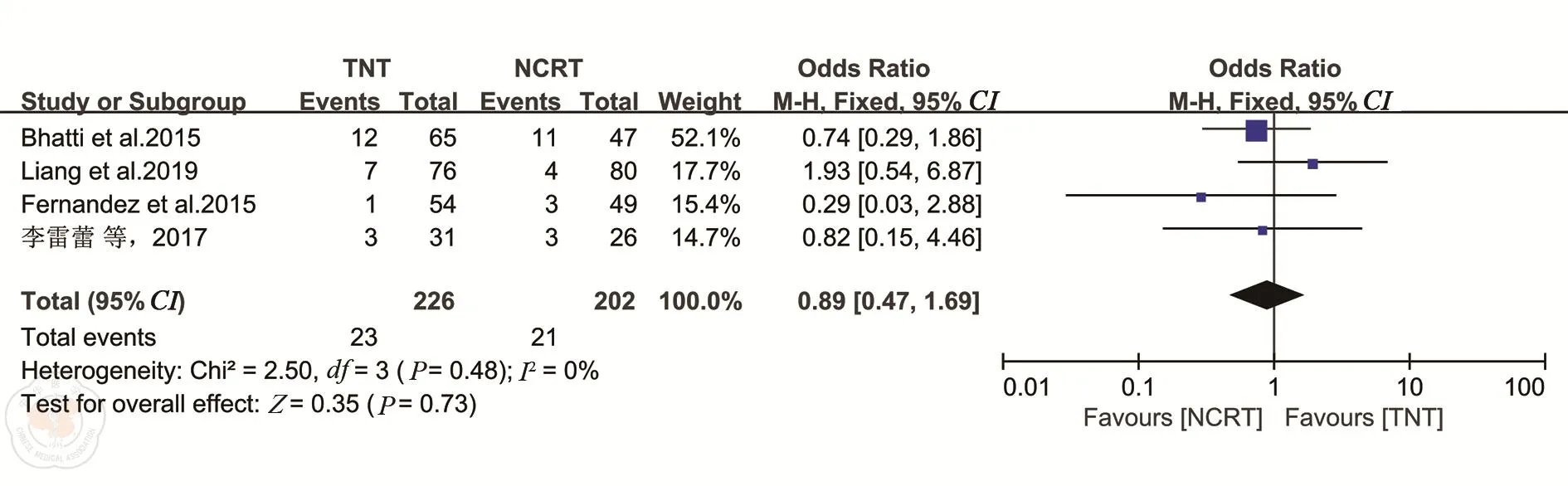
图9 TNT和nCRT组局部复发情况的比较分析
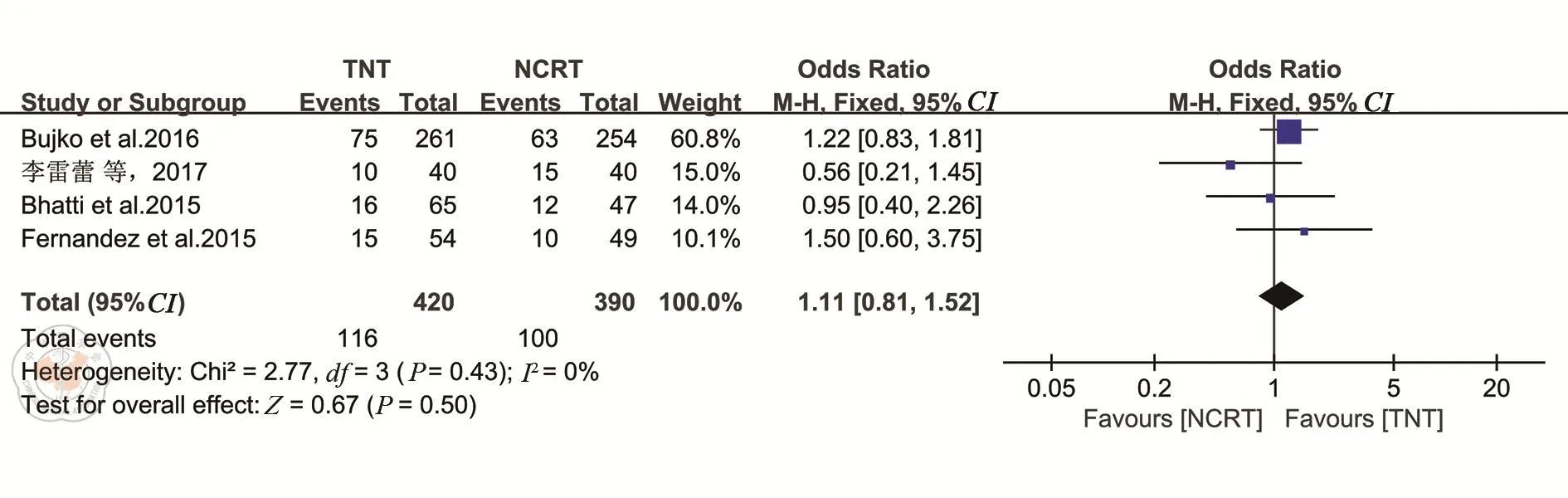
图10 TNT和nCRT组远处转移情况的比较分析
2.OS和DFS共7篇研究报道了两组的5年OS[13-15,20-21,23,25]。各研究之间异质性较小(P=0.24,I2=25%),选择固定效应模型。Meta分析结果表明,TNT组与nCRT组的5年OS差异无统计学意义(HR=0.84,95%CI:0.69~1.02,P=0.08)。见图11。共4篇研究报道了TNT和nCRT组的5年DFS[13,15,20,23]。各研究之间异质性较小(P=0.95,I2=0%),选择固定效应模型。Meta分析结果表明,两组的5年DFS无显著差异(HR=0.94,95%CI:0.03~1.39,P=0.74)。见图12。
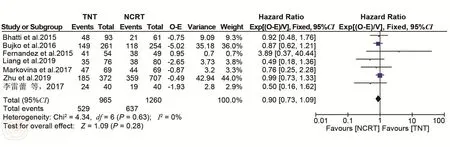
图11 TNT和nCRT组5年OS比较分析

图12 TNT和nCRT组5年DFS比较分析
五、文献发表偏移
采用漏斗图分析各结局指标所纳入文献的发表偏倚情况,发现漏斗图两侧分布基本对称,无明显发表偏移,表明稳定性良好,以pCR为例,纳入的13篇文献漏斗图基本分布在95%CI内,提示无明显发表偏倚。见图13。
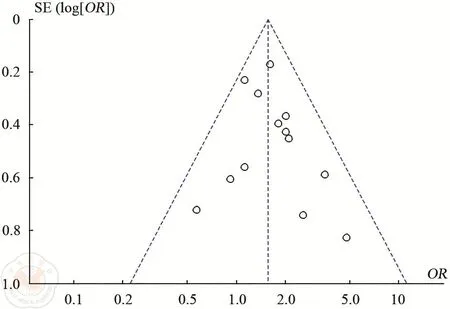
图13 纳入研究的发表偏移情况(pCR)
讨 论
多项研究表明,TNT可显著改善直肠癌患者的治疗依从性,提高pCR率、肿瘤降期率和R0切除率,增加手术保肛率和器官保留率,消除隐匿性微小转移病灶和缩短造口还纳时间,还可能通过增加肿瘤的局部控制,进一步降低局部复发和远处转移率,进而改善长期生存预后[11-18]。本研究发现,TNT组的pCR率、R0切除率和T分期降期率明显高于nCRT组,而3/4级急性毒性反应发生率和围手术期并发症率与nCRT组相近。两组的局部复发率、远处转移率、5年OS和DFS差异均无统计学意义。
与nCRT相比,TNT并未显著增加3/4级急性毒性反应发生率和围手术期并发症率。研究报道的TNT治疗期间3/4级急性毒性反应发生率为4%~55%,以腹泻和血液学毒性(中性粒细胞减少、血小板减少等)为主。总体来讲,TNT的毒性反应发生率(27%)与nCRT(31%)相近。也有研究认为,TNT的毒副反应发生率更低,这可能是由于患者尚未接受手术治疗,机体免疫力和一般状况较好,对全身化疗的耐受性更佳[12,25]。本研究结果发现,TNT组的围手术期并发症发生率与nCRT组相近,这与多数研究所得结论一致[15-19]。其中,手术切口并发症和吻合口相关并发症(吻合口漏和吻合口狭窄)较常见。上述研究表明,TNT与nCRT的安全性相当,TNT有可能在不增加毒副反应和术后并发症发生率的前提下取得较好的肿瘤学疗效。
本研究结果表明,TNT组总的pCR率为21.3%,显著高于nCRT组的13.9%(P<0.05),这与Petrelli等[32]的Meta分析研究结果相一致(22.4%vs.13.7%,P=0.01)。TNT可明显增加局部进展期直肠癌的pCR率。Garcia-Aguila等[9]的研究将局部进展期直肠癌患者分为四组,分别在nCRT和TME之间接受0、2、4和6个周期的“mFOLFOX6”巩固化疗方案,结果表明,各组的pCR率分别为18%、25%、30%和38%。这表明pCR率随着TNT的周期数的增加而提高。纪念斯隆-凯特琳癌症中心的一项回顾性研究表明,TNT组的pCR率显著高于nCRT组(35.7%vs.21.3%,P<0.05)[12]。但也有研究认为,TNT并未明显提高直肠癌患者的pCR率,如GCR-3研究和EXPECT-C研究[16,26]。
不同研究得出相反结论可能与从新辅助治疗结束到根治性手术前的时间间隔有关。Lyon R90-01研究表明,TNT的疗效具有时间依赖性,pCR率会随着时间间隔的延长而提高[27]。这一时间间隔显著延长后,肿瘤组织将拥有足够的退缩时间,从而取得更佳的减瘤降期效果和更高的pCR率。而EXPECT-C研究的时间间隔仅为5~6周,显著低于其他研究的 8~12 周[12,20-22],这可能是该研究的pCR率未明显提高的主要原因。
本研究表明,尽管两组的手术保肛率差异无统计学意义,但TNT组的造口还纳时间显著缩短。Cercek等[12]的研究发现,TNT组和nCRT组低位前切除术后分别有87.5%和85.5%的患者接受了保护性造口;术后半年内,TNT组造口还纳率显著高于nCRT组(71.9%vs.8.8%,P<0.001)。nCRT组通常需在完成术后辅助化疗后才考虑还纳造口,而TNT组多已在术前完成全身化疗,一般可在半年内还纳造口。因此,TNT显著缩短造口还纳时间,明显改善了直肠癌患者的术后生活质量。
目前,有关TNT远期疗效的研究相对较少,且结论不一。本研究发现,TNT组与nCRT组的OS和DFS均差异无统计学意义。GCR-3研究中,TNT组接受3周期的“CAPEOX”诱导化疗方案,结果表明,两组的局部复发率、远处转移率、5年OS和DFS差异无统计学意义[16]。国内研究也认为,TNT并未显著改善直肠癌患者的生存预后[25]。多项研究的亚组分析表明,pCR患者的OS和DFS较非pCR患者显著改善[9,17],说明直肠癌患者的生存预后可能与肿瘤的局部控制作用有关。也有研究指出,TNT可明显消除隐匿性微转移病灶,改善直肠癌患者的生存预后[13,17]。本文纳入的14项研究中,仅4项研究探讨了TNT的远期疗效,样本量较少,且以回顾性研究为主,这可能使得本研究结果存在较大偏移。
当前的TNT研究还存在一定的争论。首先,研究对象多为临床Ⅱ~Ⅲ期直肠癌患者,可能存在过度治疗或延迟治疗等情况。有肠壁外血管侵犯、直肠周围筋膜受累以及侧方淋巴结阳性等高危因素的直肠癌患者,其复发转移的风险较高,这类患者是TNT的适宜人群,可能有助于降低远处转移率并改善生存预后[28]。其次,研究发现,KRAS和p53基因突变者对放化疗的反应较差[29]。这可能导致那些对TNT反应差的患者在治疗期间出现疾病进展,失去最佳手术治疗机会。还有研究指出,TNT显著延长了从新辅助治疗结束到根治性手术前的时间间隔,使得盆腔组织明显纤维化,手术难度增加,围手术期并发症特别是吻合口漏的风险显著增加[30-31]。
TNT研究的初衷是提高治疗依从性并改善直肠癌患者的生存预后,而现有研究并未证实患者存在生存获益。值得关注的是,TNT可通过较早的引入全身化疗,消除潜在的微转移病灶,从而实现较好的肿瘤局部控制作用,pCR或cCR率显著提高,进一步增加接受“等待-观察”策略的cCR患者比例,提高器官保留率。这可能是TNT的临床应用前景之一[33]。此外,TNT后肿瘤局部切除也开始受到关注,如GRECCAR-2研究[34]和CARTS研究[35]。目前,TNT具体模式和化疗药物的种类和剂量尚无确切结论,诱导化疗和巩固化疗孰优孰劣、双药化疗或三药化疗或生物治疗的具体疗效、短程放疗联合术前化疗或术前长程放化疗等仍是TNT研究的热点和关键问题。
本Meta分析也存在一定的局限性:(1)本研究仅纳入6项随机对照研究,且样本量相对较少,可能存在发表偏移等不足。(2)纳入研究主要报道了TNT的近期疗效和安全性,如pCR、cCR、R0切除率等,有关长期生存预后的研究较少,且多以回顾性研究为主。
综上所述,TNT具有消除隐匿性微转移病灶,缩短直肠癌患者造口还纳时间和改善治疗依从性的优势,并显著增加了局部进展期直肠癌的pCR率,提高了R0切除率和肿瘤降期率。有关TNT长期生存预后的随机对照研究,如RAPIDO研究,NCT03177382、NCT02031939研究正在开展中,期待其研究结果能够进一步明确TNT的临床疗效。

