响应面法优化刺梨果多糖发酵工艺研究
谢晓阳,范 毅,王 伟,景炳年,陈谭星,刘雨晴,颜慧萍,曹力凡
(1.河南省生物技术开发中心/河南省科学院天然产物重点实验室,河南 郑州 450002;2.河南省高新技术实业有限公司,河南 郑州 450002)
刺梨(Rosa roxbunghii)为蔷薇科多年生落叶灌木缫丝花的果实,又称刺菠萝,是滋补健身的食药两用营养珍果[1]。最早种植于贵鄂山区,自1993年以来,刺梨被政府列为扶贫项目大力扶持和推广,中原地区的河南省开始人工大规模种植刺梨,是刺梨干果的主产区。刺梨鲜果中有着丰富的维生素、多糖、有机酸、酚类、氨基酸和微量元素等营养成分[2-3],研究表明,刺梨中活性物质含量都显著高于这些常见水果蔬菜,其体外抗氧化能力,是常见水果蔬菜的10~60倍[4],其中刺梨果多糖是鲜果中主要的一种水溶性成分,由10个以上单糖通过糖苷键链接的高分子聚合物[5],目前证实具有广泛的生物活性,杨江涛[6]报道了刺梨粗多糖具有提高衰老小鼠体内抗氧化的能力,增强动物的非特异性免疫和体液免疫应答;崔昊等[7]也研究发现,刺梨多糖对补体途径和替代途径均有着积极的作用。
目前在刺梨发酵多糖方面的报道不多,并且多数为自然发酵[8-10]。而在微生物发酵刺梨果多糖的相关报道中,使用酿酒酵母(Saccharomyces cerevisiae)作为发酵菌株的居多[11-12],而本研究在预选发酵菌种中又挑选了产朊假丝酵母(Candida utilis)和扣囊复膜孢酵母(Saccharomycopsis fibuligera),前者其蛋白质和维生素B的含量都远高于普通酿酒酵母[13],而后者产香产气丰富主要用在酿酒上[14]。另外由于清除自由基是表征抗氧化能力的一个重要指标,而1,1-二苯基-2-苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基是一种较稳定的含氮自由基,可重复性强,使用范围广[15]。为了进一步研究开发刺梨的食药价值、挖掘和拓展刺梨产品的应用,将DPPH自由基清除率作为刺梨果多糖抗氧化活性评价指标。
响应面法(response surface methodology,RSM)则考虑了试验随机误差,在实验条件寻优过程中,可以连续的对试验的各个水平进行分析。同时响应面法将复杂的未知的函数关系在小区域内用简单的一次或二次多项式模型来拟合,计算比较简便,是解决实际问题的有效手段[16-18]。本研究以河南开封野生刺梨果为原料,采用产朊假丝酵母(Candida utilis)、扣囊复膜孢酵母(Saccharomycopsis fibuligera)及酿酒酵母(Saccharomyces cerevisiae)进行发酵,通过传统水提法制备刺梨果多糖发酵液,以生长曲线、1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率和铁离子还原能力分析挑选出发酵优势菌株。在单因素试验基础上,利用Box-Behnken(BB)试验设计原理,采用响应面试验法,优化微生物发酵刺梨果多糖工艺条件,为今后刺梨产业发展和应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
野生刺梨:开封市金维康野生植物开发有限公司;产朊假丝酵母(Candida utilis)、扣囊复膜孢酵母(Saccharomycopsis fibuligera)、酿酒酵母(Saccharomyces cerevisiae):北京北纳创联生物技术有限公司。
1.1.2 化学试剂
DPPH清除能力试剂盒、铁离子还原能力测试试剂盒:上海琮益科技有限公司;总多糖含量测定测试盒:江苏艾迪生生物科技有限公司;纤维素酶(50 000 U/g):上海罗恩试剂公司。其他所用化学试剂均为分析纯。
1.1.3 培养基
酵母粉麦芽糖(yeast maltose,YM)培养基:酵母粉0.6 g/L,麦芽提取物0.6 g/L,葡萄糖2 g/L,蛋白胨1 g/L,蒸馏水1 000 mL。121 ℃灭菌15 min。
1.2 仪器与设备
PICO 21高速离心机:美国热电公司;5804R高速冷冻离心机:德国艾本德(中国)有限公司;MDF-U5411超低温冰箱:日本三洋公司;BP310S-OCE精密天平:德国塞多利斯(中国)有限公司;PHS-3C精密pH计:上海仪电科学仪器股份有限公司;LDZF-75L-II高压高温灭菌器:上海申安医疗器械厂;HB-031金属加热器:上海申能(集团)有限公司;HPS-250生化培养箱:徐州东联电子技术有限公司;T10紫外可见分光光度计:北京普析通用仪器有限责任公司;AUY 220电子天平:日本岛津公司;KQ-250DB数控超声波清洗器:昆山超声仪器有限公司;MJ-ZZ12粉碎机:美的电器集团。
1.3 方法
1.3.1 刺梨发酵酵母菌的选择
3株酵母菌采用YM培养基,按照2%接种量,以培养时间(0、2 h、4 h、6 h、8 h、10 h、12 h、24 h、36 h、48 h、60 h、72 h)为横坐标,吸光度值(OD600nm)为纵坐标,绘制产朊假丝酵母、扣囊复膜孢酵母、酿酒酵母的生长曲线,观察3株菌株的生长状况。
分别采用产朊假丝酵母、扣囊复膜孢酵母、酿酒酵母对刺梨汁进行发酵,然后分别按0.5 mg/L的多糖制备样品进行DPPH自由基清除率和铁离子还原能力的抗氧化活性测定,以未发酵样品为对照,进行4次平行重复试验。
通过菌株生长状况及其发酵液抗氧化活性选择优良菌株进行刺梨发酵。
1.3.2 发酵液制备
以野生刺梨果为原料,通过传统水提法[19](料液比1∶20(g∶mL),提取温度75 ℃,提取时间3 h)提取刺梨多糖。将已制备好的刺梨多糖提取液代替YM培养基中的蒸馏水,用来制备每瓶200 mL刺梨多糖YM培养基,121 ℃灭菌15 min,静置冷却后得到刺梨多糖YM培养基。在刺梨多糖YM培养基中按照2%的接种量加入酵母菌,28 ℃静置培养50 h,得到刺梨多糖发酵液。
1.3.3 刺梨多糖的制备
取上述刺梨多糖发酵液稀释1倍后,通过超声波清洗器进行处理(功率80 W,温度70 ℃,超声时间10 min);加入纤维素酶5 mg/mL,50 ℃水浴加热70 min;室温条件下5 000 r/min离心10 min,取上清液,加3倍体积无水乙醇进行醇提过夜,5 000 r/min离心15 min后,70 ℃烘干得到刺梨粗多糖。
1.3.4 多糖含量的测定
刺梨粗多糖含量通过基于蒽酮-硫酸显色法[20]的总多糖含量检测试剂盒测定。以吸光度值(y)(OD540nm)为纵坐标,葡萄糖标准液质量浓度(x)(0、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL、0.6 mg/mL、0.7 mg/mL、0.8 mg/mL、0.9 mg/mL、1 mg/mL)为横坐标,绘制葡萄糖标准曲线,通过标准曲线回归方程y=1.215 3x-0.005 1(相关系数R2=0.999 3)计算发酵液中的多糖含量。
1.3.5 DPPH自由基清除能力的测定
刺梨果多糖DPPH自由基清除率采用试剂盒测定。从-20 ℃冰箱取出DPPH试剂,37 ℃平衡20 min以上,待试剂溶化后,在试剂瓶中加入100 mL无水乙醇,剧烈振荡使试剂充分溶解。分别吸取DPPH溶液1 mL,与其等量的无水乙醇、以及不同浓度多糖样品混合,充分摇匀后,室温放置避光静置30 min使之充分反应。Ai表示含有样品和DPPH的溶液的吸光度值,Aj表示含有样品和无水乙醇的溶液的吸光度值,A0表示含有无水乙醇和DPPH的溶液的吸光度值(空白对照)。清除50%DPPH自由基所需的样品溶液浓度即半抑制浓度(50%inhibition concentration,IC50)值通过绘制自由基清除率与样品浓度的关系来计算。测定波长517 nm处吸光度值,所有的实验均进行3次重复。DPPH自由基清除率计算公式如下:
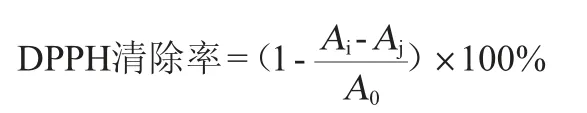
1.3.6 铁离子还原能力的测定
铁离子还原能力测试试剂盒来测定刺梨果多糖的铁离子还原能力。取不同浓度的多糖样品,依次加入1 mL的磷酸缓冲液(pH 6.6)和1 mL 1%的铁氰化钾溶液。混合物50 ℃水浴20 min,快速冷却后再加入1 mL 10%的三氯乙酸,充分混匀后,3 000 r/min离心10 min,取3 mL上清液加入新试管中,取0.6 mL 0.1%三氯化铁到上清液,充分混匀,室温静置10 min,测定波长700 nm处的吸光度值。不加样品的反应液为空白对照。
1.3.7 发酵工艺优化单因素试验
设定菌种接种量分别为(1%、2%、3%、4%、5%),培养温度为28 ℃,初始pH值分别为(3、4、5、6、7),发酵时间分别为(16 h、28 h、40 h、52 h、64 h),取200 mL多糖发酵液进行抗氧化活性试验,以刺梨果多糖的DPPH自由基清除率为评价指标,分别考察接种量、初始pH值及发酵时间对发酵刺梨果多糖抗氧化活性影响。
1.3.8 发酵工艺优化响应面试验设计
基于BB试验设计,优化发酵刺梨果多糖工艺,以发酵时间(Xi)、接种量(Xii)和初始pH值(Xij)为自变量,DPPH自由基清除率(Y)为响应值,响应面试验因素与水平见表1。

表1 发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for fermentation conditions optimization
2 结果与分析
2.1 刺梨发酵微生物的选择

图1 三种酵母菌的生长曲线Fig.1 Growth curves of three yeast strains
由图1可知,三种菌株在36 h时都开始进入生长稳定期,其中的产朊假丝酵母较之其他两种菌株生长优势显著,在12 h就已经进入到对数增长后期,并且产朊假丝酵母菌株浓度也显著高于其他两种菌株(P<0.05),说明其生长状况良好。
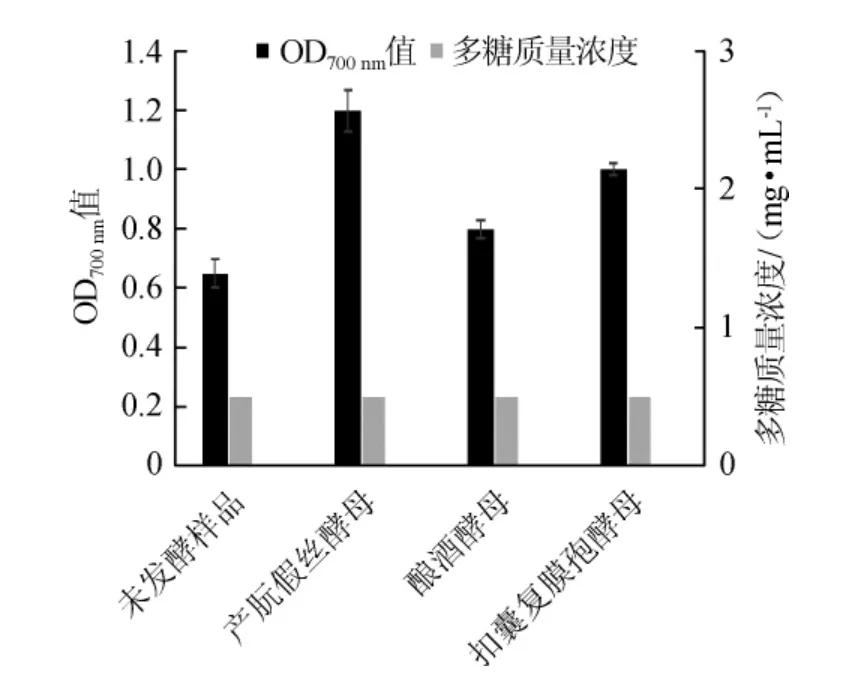
图3 三种酵母菌株铁离子还原能力的比较Fig.3 Comparison of iron ion reduction ability of three yeast strains
由图2和图3可知,三种菌株在对刺梨果多糖发酵后,与未发酵的原液相比多糖浓度都有一定的提高,是由于酵母菌在生长中主要以单糖和双糖等小分子糖为碳源,从而起到纯化多糖的作用,且GE Y等[21]报道纯化后多糖的抗氧化活性和还原能力均大于粗多糖。另外许多研究表明,多糖的生物活性与其分子质量有关。当多糖的分子质量不同时,抗氧化能力也不同,而据LIU W等[22-23]报道,多糖的分子质量在通过发酵后是低于发酵前的水平。而其中产朊假丝酵母在发酵刺梨果多糖后,DPPH自由基清除率明显高于其他菌株(P<0.05)。可能由于产朊假丝酵母生长速度快,菌株密度大,对小分子糖消耗多,产生胞外多糖量相对大,而本身其产蛋白量高,胞外多糖抗氧化能力可能也优于其他菌株。另外不但可以利用单糖、二糖,而且可以利用三糖,所以使得多糖纯度提高,据HUANG Q L等[24-25]报道,产朊假丝酵母产生大量的次生代谢物具有抗氧化能力。因此,选取产朊假丝酵母作为发酵菌种。
2.2 发酵工艺优化单因素试验
2.2.1 发酵时间对刺梨果多糖DPPH自由基清除率的影响
设定接种量为1%,初始pH值为4,不同发酵时间(16 h、28 h、40 h、52 h、64 h)对发酵刺梨果多糖的DPPH自由基清除率的影响见图4。由图4可知,16~40 h的DPPH自由基清除率差异显著(P<0.05),这个时间段的菌株处在对数增长期,对单糖和双糖等小分子糖利用率不断提高,使得多糖纯度提高,抗氧化活性也明显上升。发酵时间的逐渐延长,发酵液中多糖的DPPH自由基清除率在到达40 h后逐渐开始平稳的趋势,之后组间多糖的DPPH自由基清除率均差异不显著(P<0.05)。说明酵母菌在生长的过程中主要以小分子的单糖和双糖为优势碳源,在对三糖的利用上,因为酵母菌的种类不同,而存在着一定的差异[21],本试验中可能由于刺梨果渣多糖发酵液中酵母菌在40 h 已趋于稳定。因此,发酵时间40 h为宜。

图4 发酵时间对多糖DPPH自由基清除率的影响Fig.4 Effect of fermentation time on DPPH free radical scavenging rate of polysaccharides
2.2.2 接种量对刺梨果多糖DPPH自由基清除率的影响
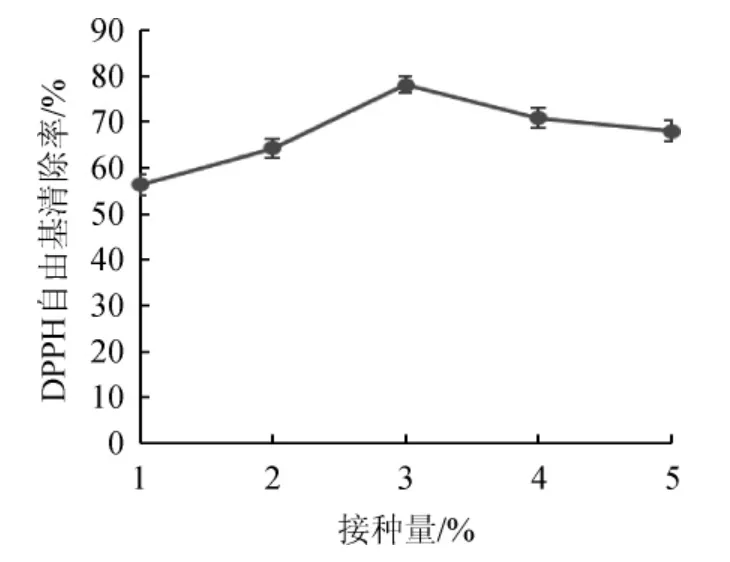
图5 接种量对多糖DPPH自由基清除率的影响Fig.5 Effect of inoculum on DPPH free radical scavenging rate of polysaccharides
由图5可知,随着酵母菌接种量的增加刺梨果多糖DPPH自由基清除率呈逐渐上升的趋势。接种量为1%时多糖DPPH自由基清除率低于其他各组;当接种量为3%时多糖DPPH自由基清除率最高(P<0.05);接种量>3%时,其含量则呈下降趋势。这可能是由于酵母菌接种量较低时菌种和原料接触不充分,而接种量过大则导致在有限的营养物质下酵母菌生长受到限制,从而致使后续进行发酵的动力不足,也可能由于菌种的不断产生并不断积累一些抑制产物,从而限制了发酵过程中菌种的正常生长[11]。因此,接种量3%为宜。
2.2.3 初始pH值对刺梨果多糖DPPH自由基清除率的影响
初始pH值对多糖含量的影响见图6。由图6可知,随着初始pH 值的增加,酵母发酵制备多糖的DPPH自由基清除率逐渐增加,直到初始pH值>5时多糖的DPPH自由基清除率开始降低,这可能是因为酵母菌适宜在偏酸性环境生长的原因,在pH值为中性时的发酵原液则影响了酵母菌细胞质膜电荷及其稳定性,以及菌体的代谢酶活性,从而改变了酵母菌对发酵液中营养物质的吸收和利用情况[19]。在初始pH值为5时,酵母菌的生长情况最佳,其多糖DPPH自由基清除率高于其他各组。因此,初始pH值为5为宜。
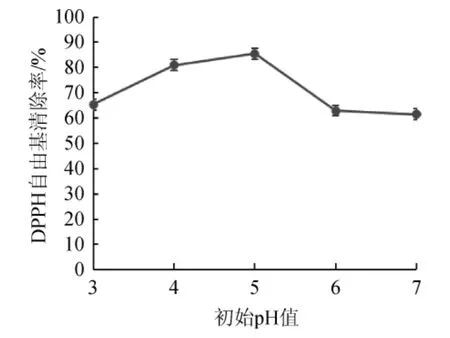
图6 初始pH值对多糖DPPH自由基清除率的影响Fig.6 Effect of initial pH on DPPH free radical scavenging rate of polysaccharides
2.3 发酵工艺优化响应面试验
2.3.1 BB试验设计和结果
在单因素试验的基础上,以发酵时间(Xi)、接种量(Xii)、初始pH值(Xij)为考察因素,以DPPH自由基清除率(Y)为响应值,设计进行3因素3水平的Box-Behnken试验优化发酵刺梨果多糖的发酵工艺,采用多元二次回归的方程拟合试验结果,响应面设计方案及结果见表2,方差分析见表3。
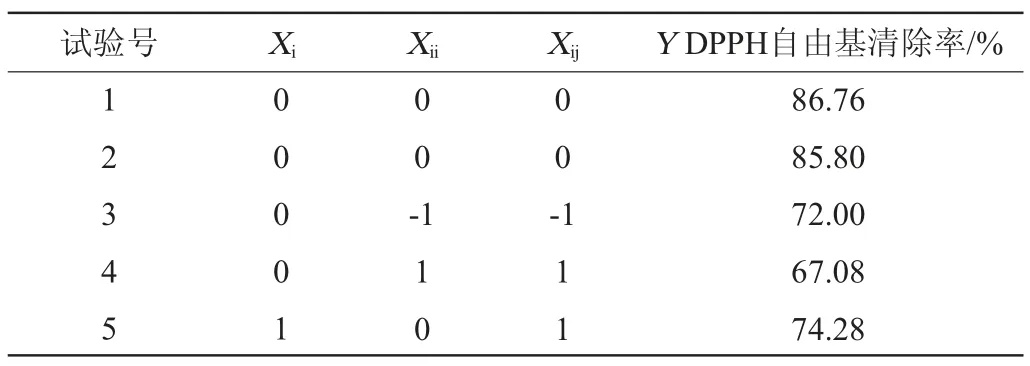
表2 发酵条件优化Box-Behnken试验设计与结果Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization
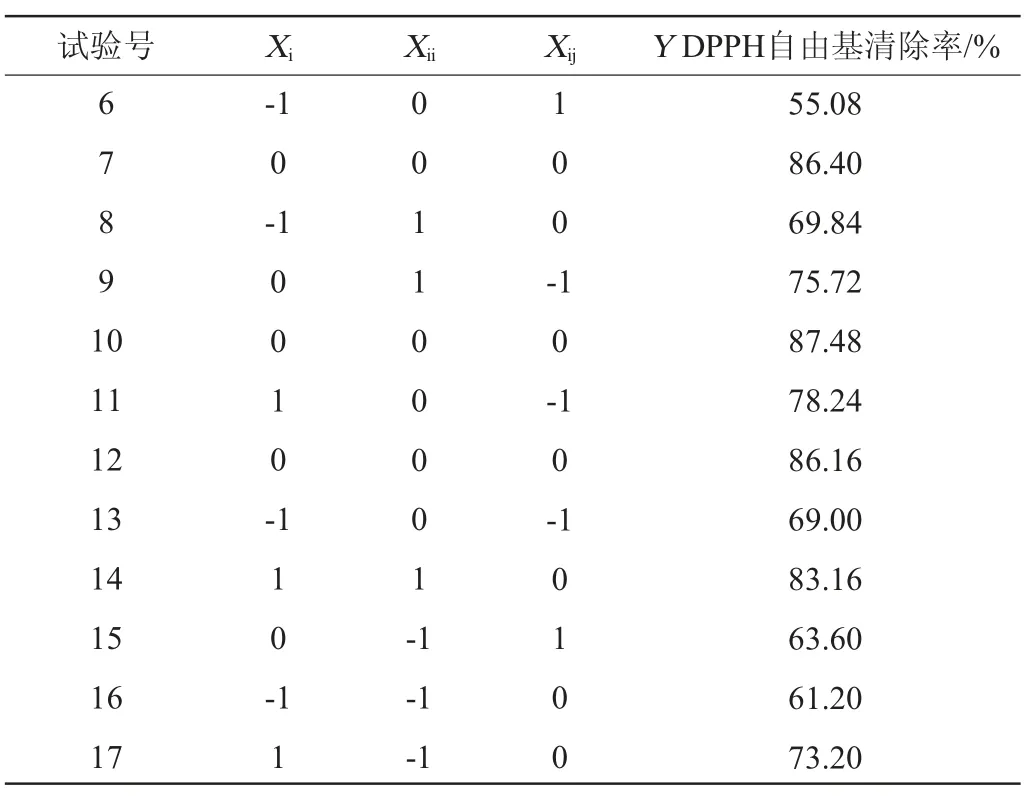
续表
采用Design-Expert 8.0.6统计软件对表2结果进行多元回归拟合分析,建立二次回归方程:Y=86.52+6.72Xi+3.23Xii-4.37Xij+0.33XiXii+2.49XiXij-0.06XiiXij-7.56Xi2-7.11Xii2-9.81Xij2。
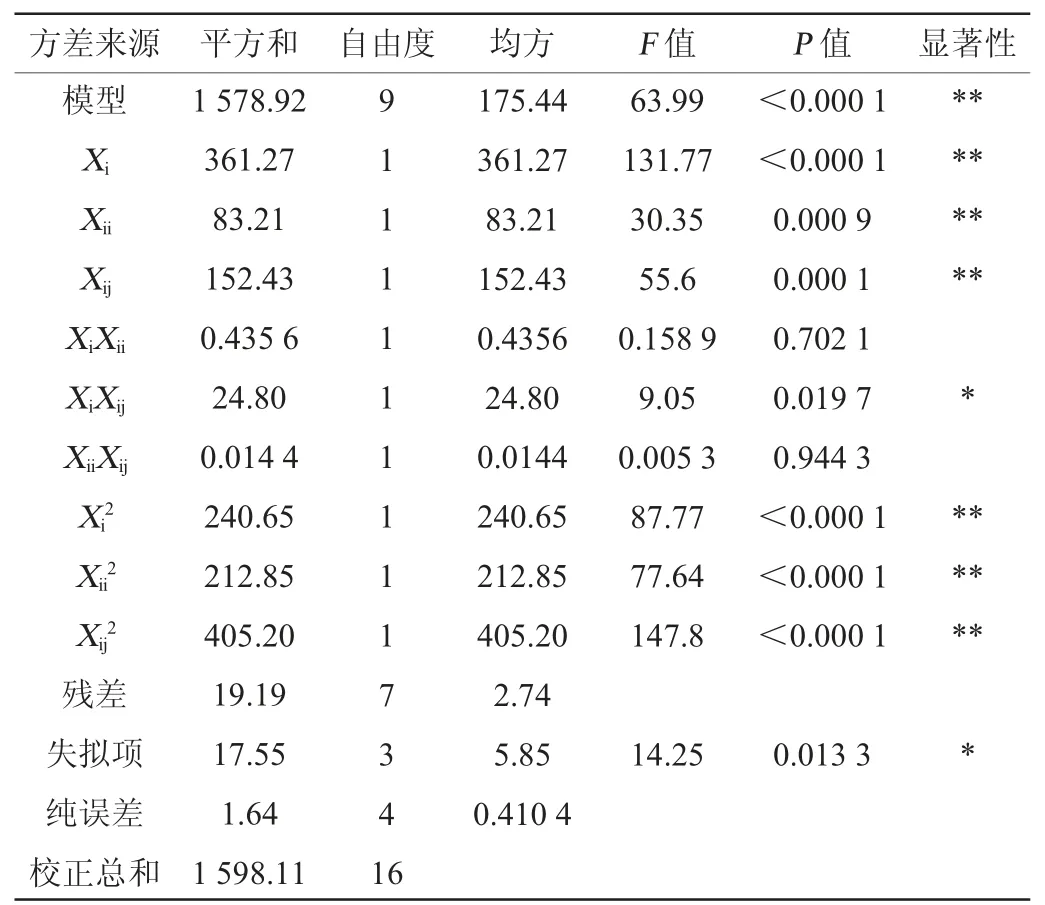
表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可知,一次项中发酵时间(Xi)、接种量(Xii)、初始pH值(Xij)以及平方项中发酵时间(Xi2)、接种量(Xii2)、初始pH值(Xij2)对响应值影响极其显著(P<0.01),交互项中发酵时间与初始pH值(XiXij)对响应值影响显著(P<0.05),其他项不显著(P>0.05)。由回归方差分析显著性检验表明,该实验数据所得的拟合模型F=63.99,P>0.000 1,说明模型的回归极显著(P<0.01),并且此模型的决定系数R2=0.988 0,调整决定系数R2Adj=0.972 6,变异系数(coefficient of variation,CV)=2.21%,说明该模型的自变量和其响应值之间的线性关系显著,与实际的试验拟合度高,实验误差小,可以用于微生物发酵刺梨果多糖提高抗氧化活性的理论预测。
2.3.2 响应面分析
根据回归模型绘制发酵时间、接种量、初始pH值的交互作用对发酵刺梨果多糖抗氧化活性影响的响应面和等高线见图7。响应面图是响应值对各影响因素所形成的三维空间曲面图,通过响应面图可形象看出最优取值点及各参数之间的相互作用[26]。如果响应面曲线越陡,则表明该因素对DPPH自由基清除率影响越大。等高线的形状可以反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反。由图7可知,Xi(发酵时间)对DPPH自由基清除率的影响最大,Xij(初始pH值)次之,Xii(接种量)最小,与表3方差分析的结果一致。根据试验分析结果,各因素对综合评分的影响交互项强弱顺序为:XiXij>XiXii>XiiXij。
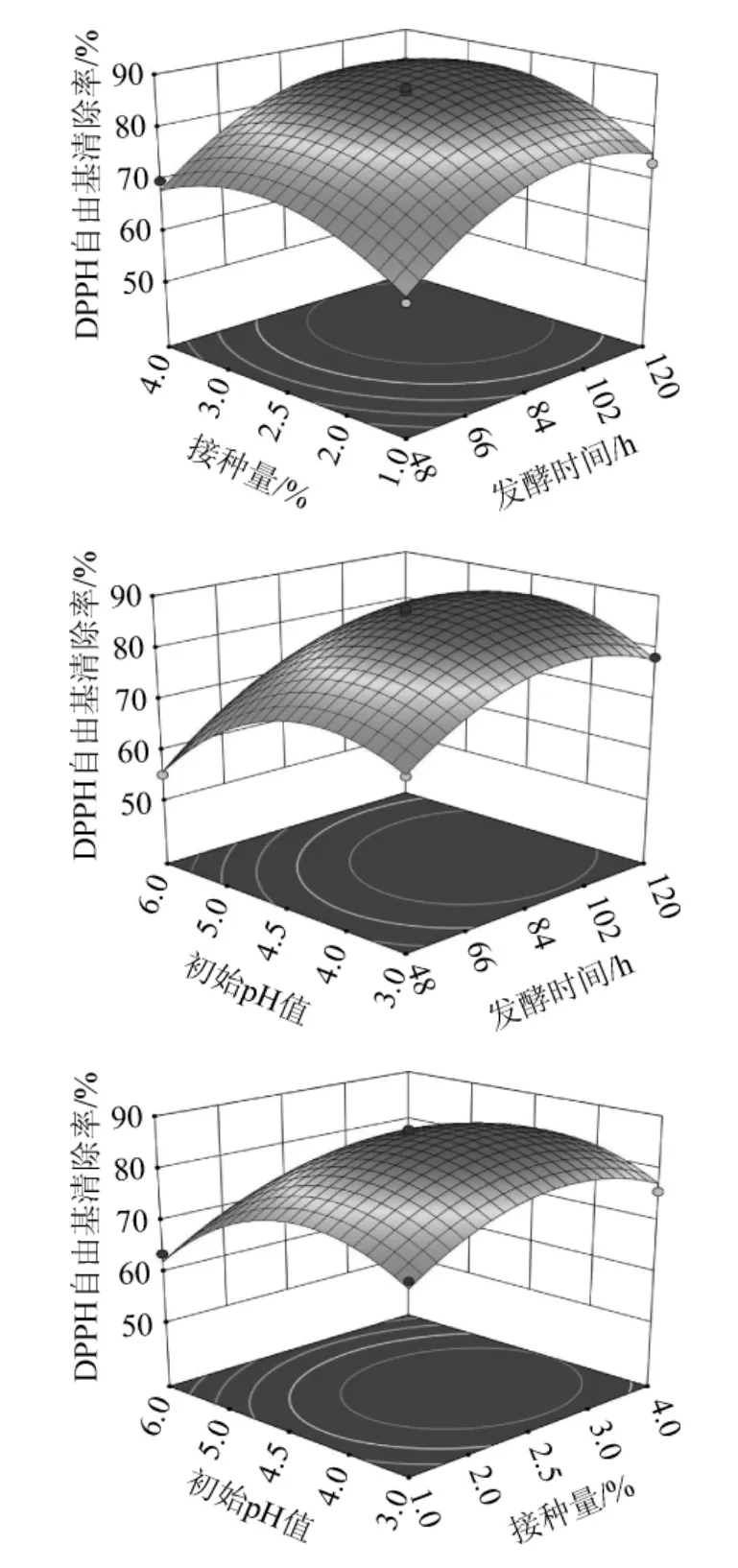
图7 各因素交互作用对DPPH自由基清除率影响的响应面和等高线Fig.7 Response surface plots and contour lines of effects of interaction between each factors on DPPH free radical scavenging rate
2.3.3 验证试验
根据Design-Expert 8.0.6软件预测的最优工艺优化结果为发酵时间49.9 h,接种量2.37%,初始pH值为3。考虑到实施工艺参数的实际可操作性,将发酵刺梨果多糖最佳发酵工艺调整为:发酵时间50 h;接种量2%;初始pH值3。在此条件下平行进行3次验证试验,测得刺梨果多糖DPPH自由基清除率实际值为86.56%,与模型预测值86.57%相比,相对误差小。因此采用响应面分析法优化发酵刺梨果多糖提高抗氧化活性的工艺条件的参数准确可靠,条件稳定,同时也说明建立的回归模型合理。具有一定的实用价值。可用于以后的刺梨发酵提高抗氧化活性的研究中。
3 结论
本研究主要针对刺梨果多糖的抗氧化活性提高进行研究,通过优势菌株的选择和发酵工艺改善达到提高抗氧化活性的目的。结果发现产朊假丝酵母作为发酵菌株,发酵后的刺梨果多糖抗氧化能力最高,所以作为发酵菌种,以YM培养基为菌种发酵底物,通过前期优化后的培养条件对刺梨汁进行发酵后,提取粗多糖进行抗氧化分析。
本研究除了通过单因素试验及Box-Behnken试验设计建立数学模型,对发酵工艺进行优化,通过试验设计和结果分析,获得最佳的发酵工艺参数为发酵时间50 h、接种量2%、初始pH值3。在此最佳条件下,刺梨果多糖DPPH自由基清除率达到86.56%,为以后刺梨产业发展和应用奠定基础。

