TDO2基因敲除小鼠模型的建立和初步表型研究
李素素,常 艳,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽 合肥 230032)
色氨酸2,3-双加氧酶(tryptophan 2,3-dioxygenase,TDO2)是犬尿氨酸代谢通路(kynurenine pathway,KP)的初始限速酶之一,能够催化色氨酸(tryptophan,Trp)代谢为犬尿氨酸(kynurenine,Kyn)和其他活性代谢产物,包括犬尿喹啉酸、喹啉酸和尼克酰胺腺嘌呤二核苷酸等。TDO2首次发现于大鼠肝脏,受糖皮质激素及L-Trp的诱导。Trp是TDO2的唯一底物,TDO2具有分解代谢Trp的高度特异性。TDO由TDO2基因编码,具有4个亚基[1]。TDO2的整体结构为同源四聚体,由406个氨基酸组成。约90%的Trp由肝脏中TDO2降解,可维持血液中Trp水平的稳定[2]。
研究表明,TDO2与神经系统疾病病理生理密切相关,如阿尔茨海默症(Alzheimer’s disease,AD)、抑郁症和精神分裂症等。新近研究发现,TDO2在多种肿瘤中均有高表达,主要通过直接作用于肿瘤细胞以及间接调控免疫逃逸,促进肿瘤生长,与恶性肿瘤发生发展密切相关[4-6]。相关报道同时发现TDO2与多发性硬化症等炎症免疫相关性疾病有关,但具体作用尚不清楚[3,7-8]。因此,本课题组采用CRISPR/Cas9技术构建TDO2基因敲除(TDO2 gene knockout,TDO2-KO)小鼠模型,在蛋白水平进行了验证,并进行了初步表型研究,以期在动物水平上进一步探究TDO2基因的功能学特性以及在疾病病理机制中的作用。
1 材料
1.1 实验动物采用CRISPR/Cas9基因编辑技术构建TDO2-KO小鼠,本工作与南京集萃药康生物科技公司实验室合作完成。野生型(wild type,WT)小鼠(C57BL/6J)购自南京集萃药康生物科技公司,合格编号(201908136)。实验动物操作及饲养均符合安徽医科大学实验动物管理与伦理委员会相关规定。
1.2 试剂RNA提取试剂(批号:213408)(美国Invitrogen公司);TIANamp Genomic DNA Kit(批号:PT4503)(天根生化科技公司);Prime ScriptTM1st Strand cDNA Synthesis Kit逆转录试剂盒(批号:R201)和TB GreenTMFast qPCR Mix反应试剂(批号:Q302-1)(日本TaKaRa公司);蛋白酶K(批号:AM2546)(美国Sigma公司);抗β-actin抗体(批号:10004156)、抗TDO2抗体(批号:00049827)和辣根过氧化物酶山羊抗兔/小鼠二抗(批号:202700514/142637)(美国Proteintech公司);TE Buffer(批号:12090015)、1 mol·L-1Tris-HCl(批号:ST768)、0.5 mol·L-1EDTA(批号:WK180920-2)、PMSF(批号:P0100)、RIPA裂解液(批号:040920200709)、SDS-PAGE凝胶配制试剂盒(批号:BB3702)和BCA蛋白定量试剂盒(批号:BB19071)(上海贝博生物公司);ECL化学发光试剂盒(批号:161204-34)(美国Thermo公司)。
1.3 仪器PCR自动系列化分析仪MYCYDER、电泳仪BIO-RAD powerpac 164-5070(美国Bio-Rad公司);全自动数码凝胶图像分析系统Tanon-1600(上海天能公司);化学发光成像分析LAS4000Mini(美国GE Healthcare公司)。
2 方法
2.1 TDO2-KO小鼠的构建
2.1.1CRISPR-Cas9靶向位点的设计及sgRNA的合成 根据Gene ID小鼠基因组序列信息和打靶位点侧翼序列信息,设计针对TDO2基因的第3-8号外显子特异性打靶位点的sgRNA(Fig 1),为确保能完全敲除TDO2的基因组DNA序列,选择4个特异性sgRNA序列,其基因组位置及序列见Tab 1。
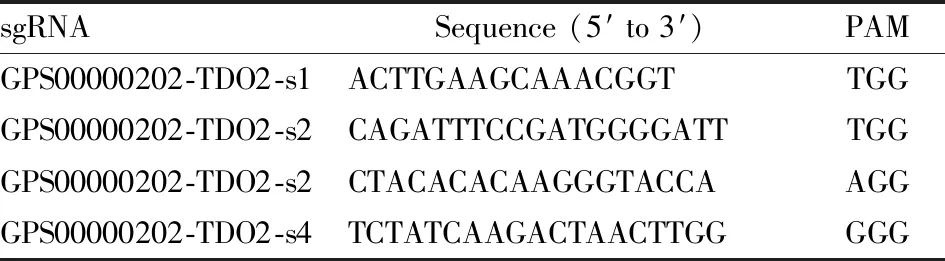
Tab 1 sgRNA sequence information
2.1.2Cas9 mRNA和sgRNA显微注射导入小鼠受精卵 待♀ C57BL/6小鼠超数排卵后收集受精卵细胞,Cas9和sgRNA终浓度分别为0.1 g·L-1和0.05 g·L-1。采用显微操作系统将Cas9 mRNA和sgRNA混合液注射至C57BL/6J小鼠受精卵的胞质中,在37 ℃,5% CO2细胞培养箱中过夜培养受精卵细胞。当细胞发育至细胞胚胎阶段时,将其转移至同周龄假孕的C57BL/6J雌鼠输卵管腹部,得到4只F0代小鼠(Fig 2)。
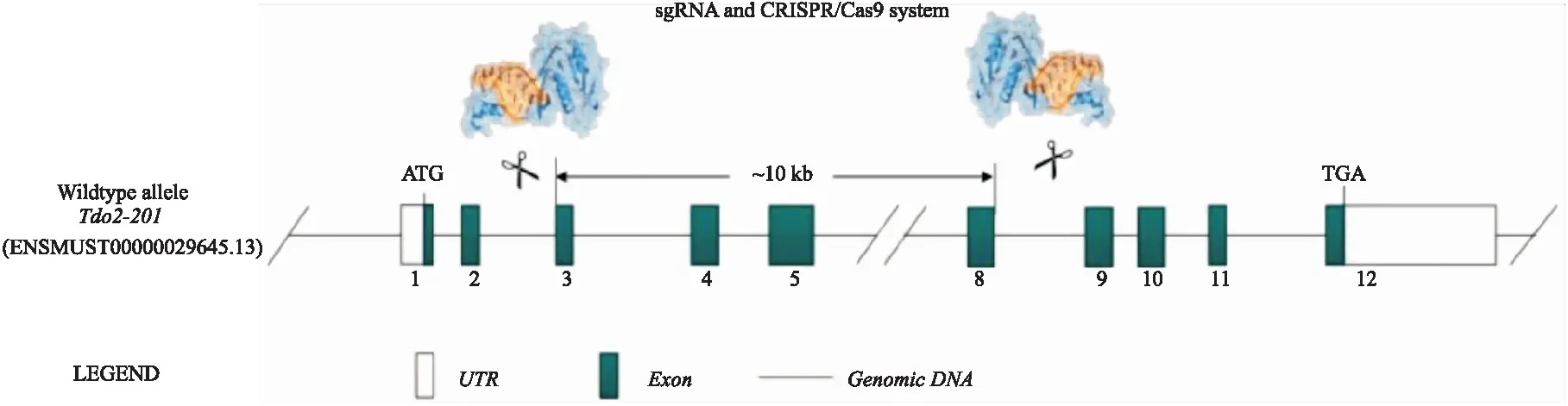
Fig 1 TDO2-KO strategyThe Cas9 protein binds to the target site under the guidance of sgRNA to cause DNA double-strand breaks,thereby achieving the deletion of the base sequence of the Exon3-8,and finally achieving TDO2 gene knockout.
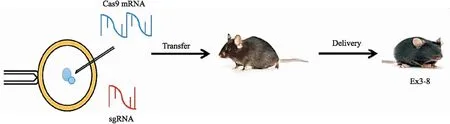
Fig 2 Cas9 mRNA and sgRNA microinjected into zygotes of miceAfter embryos were cultured to the two-cell stage,followed by transfer into abdomen of fallopian tube of pseudo pregnant females.Mutations in TDO2 Exon 3-8 in F1 female mice were detected.
2.2 TDO2-KO小鼠的饲养和繁殖TDO2-KO小鼠饲养于SPF级环境中,温度(22 ℃-28 ℃);相对湿度(40%-60%);换气(10-20次·h-1);噪音(<60 dB);每周2次更换鼠笼、垫料和饮用水;自由饮食和饮水,定时喂少量葵花籽;每天记录环境数据和小鼠状况(饮食、活动及全身情况);孕鼠妊娠期一般20 d左右;小仔出生5-7 d可进行剪尾和剪脚趾编号操作;19-21 d可进行分笼操作,幼鼠离乳,并将雌雄小鼠分开饲养;一般雄鼠8周,雌鼠6周左右大小性成熟,可用于配繁。
鉴定后的阳性F0代小鼠和WT小鼠回交得到的后代称为F1代小鼠。F1代小鼠需要根据PCR来鉴定删除片段的大小,确定阳性F1代小鼠并分别保种建系。
2.3 TDO2-KO小鼠PCR鉴定
2.3.1提取小鼠尾部组织基因组DNA F0代小鼠出生1周后,取小鼠尾尖部0.3 cm于EP管中。然后加入500 μL裂解液,消化过夜。次日,摇晃EP管使消化好的组织均匀。每管加入500 μL等体积的酚/氯仿混合溶液混匀,12 000 r·min-1离心15 min。吸取300 μL上清转移至新的EP管,每管加入2倍于上清体积的100%乙醇,混匀,12 000 r·min-1离心10 min。弃上清,再加入800 μL 70%乙醇,12 000 r·min-1离心5 min。弃上清,晾干。加入100 μL TE溶液溶解DNA,37 ℃助溶,4 ℃冰箱保存备用。
2.3.2PCR鉴定
2.3.2.1 引物信息:KO:F1:TCTGCTATGGCACGTTGAGTGGTG;R1:ATGTGGTGGTGAACATCTGTAATCC;WT:F2:TAATCTCCTGGGTGTTGTAAGTGTGG;R2:CTAACCTTGGGAAGACGTTAAGTCC
2.3.2.2 PCR体系:反应体系25 μL;分别加入ddH2O 9.5 μL,Taq Master Mix,Dye Plus各12.5 μL,引物各1 μL,模板cDNA 1 μL。PCR仪扩增,95 ℃预变性5 min,95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸45 s,20个循环,72 ℃ 5 min 终止反应。
2.3.2.3 电泳:将2.0 μL溴酚蓝加入到PCR产物中,混匀,每孔点样5 μL,Marker对照。140-150 V电压,观察条带由负极向正极移动情况,20-30 min后结束电泳,拍照观察。
2.3.2.4 鉴定结果判读:根据鉴定报告,对比PCR条带,得出结论。PCR反应未获得500 bp条带但获得252 bp条带的为WT小鼠;PCR反应获得500 bp条带也获得252 bp条带的为杂合小鼠;PCR反应获得500 bp条带但未获得252 bp条带的为TDO2-KO小鼠。
2.4 TDO2-KO小鼠生长和繁育能力观察TDO2-KO小鼠的饮食、活动、全身情况、发育生长状态等变化,观察TDO2-KO小鼠的繁殖能力。
2.5 Western blot 检测TDO2-KO小鼠肝脏中TDO2蛋白的表达匀浆裂解WT和F3代纯合子小鼠肝脏组织,提取小鼠肝组织总蛋白,BCA法蛋白定量,计算浓度,依次上样。采用12%的SDS-PAGE电泳,转膜,37 ℃摇床封闭2 h,孵育TDO2一抗(1 ∶500),4 ℃过夜,次日用TPBS洗,3次/10 min,加入山羊抗兔IgG(1 ∶20 000),37 ℃孵育2 h。TPBS 洗,3次/10 min,PBS洗,1次/10 min,采集图像,定影。
3 结果
3.1 TDO2-KO小鼠鉴定结果受精卵显微注射,胚胎移植后,获得了F0代小鼠,由于F0代为嵌合小鼠,无法稳定遗传,阳性F0代小鼠需要与WT回交,获得可稳定遗传的F1代杂合子小鼠。阳性F1代杂合子小鼠之间配繁,获得F2代纯合子小鼠,F2代纯合子小鼠之间继续配繁,成功繁殖出更多的TDO2-KO纯合子小鼠。阳性F0代杂合子小鼠与WT配繁得F1代小鼠,部分小鼠基因型鉴定结果见(Fig 3A),其中32、33、35、36、38-40、42、44号出现1条252 bp 的条带,为WT小鼠;34、37、41、43、45-51号分别出现500 bp和252 bp两条条带,为杂合子小鼠;F1代阳性杂合子小鼠之间合笼配繁,产生F2代小鼠进行基因型检测,结果见(Fig 3B、3C),其中100、103-106号出现500 bp和252 bp的两条条带,为杂合子小鼠;101、108-111、113只出现1条500 bp左右条带,为纯合子小鼠;102、112、114-116号出现1条252 bp的条带,为WT小鼠。分别挑选♀、♂纯合子基因型小鼠进行扩繁,得到的 F3代及以后只出现1条500 bp左右条带(Fig 3D),173-185号全部为基因敲除纯合子小鼠。
3.2 TDO2-KO小鼠的生长和繁育情况与WT小鼠相比,TDO2-KO小鼠饮食、发育和体质量增长正常,皮肤、毛色无明显差异。母鼠妊娠期为19-21 d,每胎产3-5只幼鼠,成活率>90%,TDO2-KO小鼠与WT小鼠繁殖情况无差异。
3.3 Western blot 检测TDO2-KO小鼠肝脏中TDO2蛋白的表达为了在蛋白水平上进一步验证,我们选取了TDO2表达较高的肝脏组织观察其表达。如Fig 4所示,Western blot检测WT小鼠肝脏中可见TDO2蛋白的表达,TDO2基因敲除纯合子小鼠肝脏无TDO2蛋白表达。
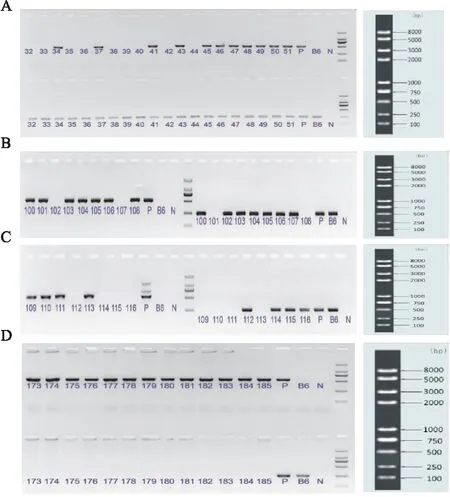
Fig 3 Results of genotype identification of mice by PCRP was positive control,B6 was negative control,and N was blank control;DL2000 marker:2000 bp/1000 bp/750 bp/500 bp/250 bp/100 bp;A:Genotype identification of F1 generation mice;B,C:Genotype identification of F2 generation mice;D:Genotype identification of F3 generation mice.

Fig 4 TDO2 expression in liver of WT and TDO2-KO mice
4 讨论
TDO2是KP代谢通路的重要限速酶之一,可以调节系统Trp水平和肝脏Kyn水平[10]。TDO2主要表达于肝脏,但在其他器官、组织中也有少量表达,如脑、皮肤、睾丸、附睾、胎盘和妊娠子宫。TDO2可由糖皮质激素和Trp诱导,前列腺素也可调控TDO2的表达。近几年研究发现,TDO2在神经系统疾病、肿瘤和炎症免疫相关性疾病的病理机制中发挥重要作用。
TDO2表达异常引起Trp耗竭和Kyn的积累,使KP代谢异常紊乱,从而介导多种疾病的发生发展[11]。TDO2在神经元中表达,与神经组织生理功能密切相关。TDO2基因的一些内含子和外显子变异导致与精神疾病相关的多态性,如Tourette综合征和自闭症。TDO2的高表达介导KP异常,引起下游代谢产物的过度产生,例如可增加喹啉酸在脑中的积累,参与AD的病理过程。研究发现在果蝇AD模型中,TDO2基因干扰,减少KP代谢产物的产生,可以缓解AD的发生发展[12]。新近研究发现,TDO2在肿瘤中也发挥重要作用。TDO2在肝癌、乳腺癌、肺癌和直肠癌等多种肿瘤中均高表达,而且肿瘤细胞中TDO2的高表达可直接促进肿瘤细胞的生长和转移,同时TDO2通过消耗免疫细胞增殖所需的Trp以及产生中间代谢物Kyn,介导肿瘤免疫逃逸[5]。基于TDO2参与免疫反应的作用,学者们进一步发现TDO2与多发性硬化症、肺炎球菌脑膜炎、肝纤维化等炎症免疫相关性疾病的病理机制有密切联系。但目前TDO2如何参与炎症免疫相关性疾病的分子机制研究较少。
传统的基因敲除手段有基因打靶和基因捕获技术。CRISP/Cas9系统是新开发的基因编辑技术[13]。CRISPR/Cas9系统由Cas9核酸内切酶和CRISPR基因组成。它主要利用特异性的sgRNA引导、定位并识别目的基因特异性位点,将Cas9的核酸酶定位到基因组上的靶点,诱导其发生缺失突变。与其他技术相比,这种方法具有基因组编辑特异性强、打靶效率高、方法操作简单、适用性广泛等优点[14-15]。利用CRISPR/Cas9技术,设计并体外转录sgRNA,将Cas9、sgRNA同时注射到小鼠的受精卵中。Cas9蛋白在sgRNA引导下结合到靶位点第3-8号外显子进而造成DNA双链断裂,从而实现靶位点第3-8号外显子碱基序列缺失,最终实现TDO2基因敲除。显微注射法是将Cas9 mRNA和sgRNA传递给受精卵的常用方法[16]。本课题组利用CRISPR-Cas9技术,成功构建TDO2-KO小鼠,在繁殖中未发现有差异,子代生长状况良好。通过PCR鉴定发现,后续繁殖的纯合子小鼠中TDO2表达缺失,表明基因缺失具有遗传稳定性。同时采用Western blot检验小鼠TDO2表达较多的肝脏组织。结果表明,与WT小鼠相比,TDO2-KO小鼠肝脏中无TDO2蛋白表达,说明TDO2基因敲除成功,与PCR结果一致。
本研究利用CRISPR/Cas9技术成功构建TDO2-KO小鼠模型,对其表型进行了初步研究。为进一步研究TDO2基因的生物学功能奠定基础,以及为TDO2在疾病病理机制中的调控作用提供实验动物模型。

