miR-199a-5p调控DDR1抑制人脑胶质瘤细胞增殖和迁移
闫兆月,高玉帅,贾玉龙,步星耀
(河南省人民医院神经外科,河南 郑州 450008)
脑胶质瘤是一种颅内常见的恶性肿瘤,约占颅内原发性肿瘤的46%。目前,有关脑胶质瘤的临床治疗主要是以手术疗法、放疗和化疗为主,但是以上临床疗效不佳,病人预后较差,其原因是由于肿瘤细胞的恶性增殖并伴随高度的侵袭和转移能力[1-2]。因此,通过抑制脑胶质瘤细胞增殖和迁移能力对于治疗脑胶质瘤具有积极的临床价值。
miR-199a-5p在多种肿瘤细胞和组织中异常表达,参与调控肿瘤细胞的增殖代谢、血管生成、侵袭转移和凋亡等过程[3]。研究证实,在不同的肿瘤细胞中miR-199a-5p发挥不同生物学作用。在乳腺癌细胞MCF7,miR-199a-5p表达明显下调,过表达miR-199a-5p能够抑制自噬相关基因(Beclin1)表达,从而调控乳腺癌细胞自噬水平并抑制乳腺癌细胞的增殖和迁移[4]。另外,在结肠癌细胞中miR-199a-5p负向调控FZD基因。FZD基因能够影响肿瘤细胞增殖、分化以及迁移等。miR-199a-5p能够抑制FZD表达从而发挥抗癌作用[5]。以上研究表明[6],miR-199a-5p在肿瘤的治疗中发挥重要作用。但是有关miR-199a-5p对人脑胶质瘤细胞增殖和迁移的作用尚不清楚。盘状结构域受体1(discoid domain receptor 1,DDR1)是一种非整合素胶原受体,广泛参与细胞增殖、迁移和分化等生命活动。在卵巢癌患者中DDR1在卵巢癌组织中呈现高表达,抑制DDR1能够降低卵巢癌细胞增殖和迁移[7]。既往研究证实,miR-199a-5p靶向DDR1抑制大肠癌细胞增殖和迁移[8]。但是有关miR-199a-5p能否靶向DDR1抑制人脑胶质瘤细胞增殖和迁移尚不清楚。因此,本研究拟通过构建miR-199a-5p过表达U251细胞株,探究miR-199a-5p对其增殖和迁移的影响及其作用机制。
1 材料
1.1 实验细胞与试剂U251脑胶质瘤细胞(中科院上海分院细胞库);DMEM细胞培养基(HyClone公司);细胞裂解液、胰酶、蛋白酶抑制剂、蛋白marker、BCA试剂盒、一抗稀释液、二抗稀释液和ECL发光试剂盒(碧云天生物技术研究所);逆转录试剂盒(广州锐博生物科技有限公司);miR-199a-5p和DDR1引物设计合成(上海生工生物工程股份有限公司);DDR1一抗(美国Cell Signaling Technology公司,货号:5583);GAPDH一抗(碧云天生物技术研究所,货号:AF5001);CCK-8测定试剂盒(碧云天生物技术研究所,货号:C0037);Transwell小室(美国Corning 公司);HRP辣根过氧化物酶标记鼠、兔二抗(碧云天生物技术研究所);pcDNA3.1质粒(BioVector质粒载体菌种细胞基因保藏中心);野生型DDR1-WT和突变型DDR1-MUT荧光素报告酶基因载体(广州锐博生物科技有限公司)。
1.2 主要仪器单功能酶标仪(湖南湘仪技术有限公司);低温、高速离心机(湖南湘仪实验室仪器有限公司);PCR仪(山东博科科学仪器有限公司);Western blot检测装置(美国Bio-Rad公司);荧光倒置显微镜(日本Olympus);CO2细胞培养箱(美国Thermo公司);ChemiDoc XRS+成像系统(美国 Bio-Rad公司)。
2 方法
2.1 细胞培养与分组人脑胶质瘤U251细胞使用含有10%胎牛血清(FBS)的DMEM细胞培养基培养。细胞置于37 ℃,5% CO2的细胞培养箱内培养,细胞贴壁生长,待生长融合度达80%-90%时,倾去培养基,PBS润洗2次,采用0.25%的胰蛋白酶消化3 min至细胞呈卵圆形,10% FBS的DMEM细胞培养基终止消化,进行传代处理。后续实验分为:对照组(无转染处理的U251细胞,24 h)、阴性对照组(转染空载体质粒U251细胞,NC)以及实验组(转染miR-199a-5p成熟模拟物,mimics)。另外,在细胞生长融合度达到80%时,设置组别:转染miR-199a-5p成熟模拟物组,转染miR-199a-5p成熟模拟物+DDR1空载体组(pcDNA3.1组)以及转染miR-199a-5p成熟模拟物+DDR1质粒组(pcDNA3.1-DDR1组),以上各组转染对应质粒24 h后,收集各自细胞进行实验。
2.2 MTT检测细胞活力将消化后的U251细胞按照96孔板密度为:1×104/孔接种,细胞贴壁生长24 h后,实验分为对照组、miR-199a-5p NC组和miR-199a-5p mimics组,其中miR-199a-5p mimics组转染miR-199a-5p 模拟物24 h,每组设置6个复孔,重复3次。每孔加入5% MTT的溶液22 μL继续室温孵育2 h,酶标仪设定波长为570 nm检测各孔的吸光度值。
2.3 划痕试验检测各组细胞迁移能力取对数生长期人脑胶质瘤U251细胞铺板,待各组细胞在6孔板内生长融合达到约100%时,采用3 μL微量移液枪头在6孔板内垂直划痕。PBS润洗3次后,采用无血清DMEM细胞培养基继续培养24 h,之后在显微镜下随机选择5个100倍视野内拍照并计算各组划痕后细胞迁移至空隙的细胞数目。
2.4 Transwell检测各组细胞迁移能力各组细胞首先采用无血清培养基进行吹打并计数,将上述细胞密度稀释为108个·L-1,之后将上述细胞加入至Transwell小室内,体积为200 μL,各自细胞数目保持为2×104个,下室中加入完全培养基500 μL,继续培养24-48 h,倾去小室内细胞培养基,采用PBS润洗2-3次,对于膜上方的细胞利用棉签轻轻擦去,Transwell上下小室室温条件下用4%的多聚甲醛固定约30 min,PBS润洗2次,0.1%的结晶紫染色15 min,最后再次使用PBS润洗2次。显微镜下观察同一视野下5个位置的细胞数目,取各组平均值进行统计学分析。
2.5 实时荧光定量PCR(RT-PCR)检测miR-199a-5p和DDR1 mRNA表达水平依据RNA提取试剂盒说明书步骤提取U251细胞总RNA,并运用紫外分光光度计检测总RNA的浓度与纯度。以RNA为模板,参照逆转录试剂盒说明书步骤将其逆转录为单链cDNA。再以cDNA为模板,根据广州锐博公司设计合成的 PCR引物进行扩增。扩增条件:92 ℃,30 s;92 ℃,5 s;60 ℃,31 s,共进行30个循环。采用7300 System SDS Software 分析数据,根据2-ΔΔCt值相对定量样本中目的基因表达水平。

Tab 1 Primer sequences for RT-qPCR
2.6 Western blot检测DDR1表达水平将处理完成的U251细胞放置于1.5 mL的组织研磨管内并按照1 ∶4比例加入细胞裂解液放置在已经预冷后的细胞组织匀浆仪中进行研磨;4 ℃ 12 000×g离心10 min,收集细胞上清液,采用BCA法进行蛋白质浓度定量检测;每孔上样量为30 μg进行蛋白质凝胶电泳实验,根据目的蛋白分子量大小以及蛋白Marker指示进行切胶,湿转转膜法将蛋白转移至PVDF膜上,脱脂牛奶封闭2 h,孵育DDR1(1 ∶100),4 ℃过夜,孵育二抗(1 ∶5 000)1-2 h,于摇床摇晃洗膜,含吐温磷酸盐缓冲液(TPBS)洗涤后加入ECL,使用胶片曝光,图片扫描后用 ImageJ 软件计算各条带的灰度值,以各目标条带灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。
3 结果
3.1 miR-199a-5p转染效果验证转染miR-199a-5p mimics 8 h后,荧光显微镜下观察U251细胞内可见大量颗粒状,部分颗粒可呈现细胞样轮廓。表明miR-199a-5p mimics已经成功转入U251细胞(Fig 1)。qRT-PCR检测各组miR-199a-5p表达水平显示,与Control组相比,miR-199a-5p mimics组miR-199a-5p表达增加(P<0.01),miR-199a-5p NC差异无显著性(P>0.05)(Fig 2)。

Fig 1 Verification of miR-199a-5p transfection effect(40×)
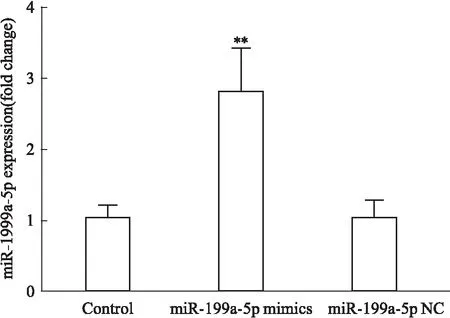
Fig 2 The expression level of miR-199a-5p **P<0.01 vs control.
3.2 转染miR-199a-5p对U251细胞增殖和迁移的影响分别采用CCK-8、细胞划痕实验以及Transwell实验检测U251细胞增殖和迁移。CCK-8检测显示,与Control组相比,转染miR-199a-5p mimics组细胞活力降低(P<0.01)(Fig 3A)。细胞划痕实验,与Control组相比,转染miR-199a-5p mimics组细胞迁移数目减少(P<0.01)(Fig 3B、3C)。Transwell实验,与Control组相比,转染miR-199a-5p mimics组细胞迁移数目亦减少(P<0.01)(Fig 3D、3E)。以上结果表明miR-199a-5p能够抑制人脑胶质瘤细胞U251增殖和迁移。
3.3 转染miR-199a-5p对DDR1表达的影响qRT-PCR和Western blot实验检测U251细胞DDR1表达水平。与Control组相比,转染miR-199a-5p mimics组U251细胞DDR1 mRNA和蛋白水平均下调(P<0.01)(Fig 4)。
3.4 过表达DDR1逆转miR-199a-5p模拟物对U251细胞增殖和迁移的影响为进一步证实miR-199a-5p靶向DDR1抑制U251细胞增殖和迁移。通过构建DDR1过表达细胞系,探究miR-199a-5p/DDR1在U251细胞增殖和迁移中作用。与Control组相比,转染pcDNA3.1-DDR1组DDR1表达上调(P<0.01)(Fig 5A)。细胞划痕实验和Transwell实验结果显示,与转染miR-199a-5p mimincs组相比,过表达DDR1能够促进人脑胶质瘤细胞U251增殖和迁移(P<0.01)(Fig 5B-5E)。
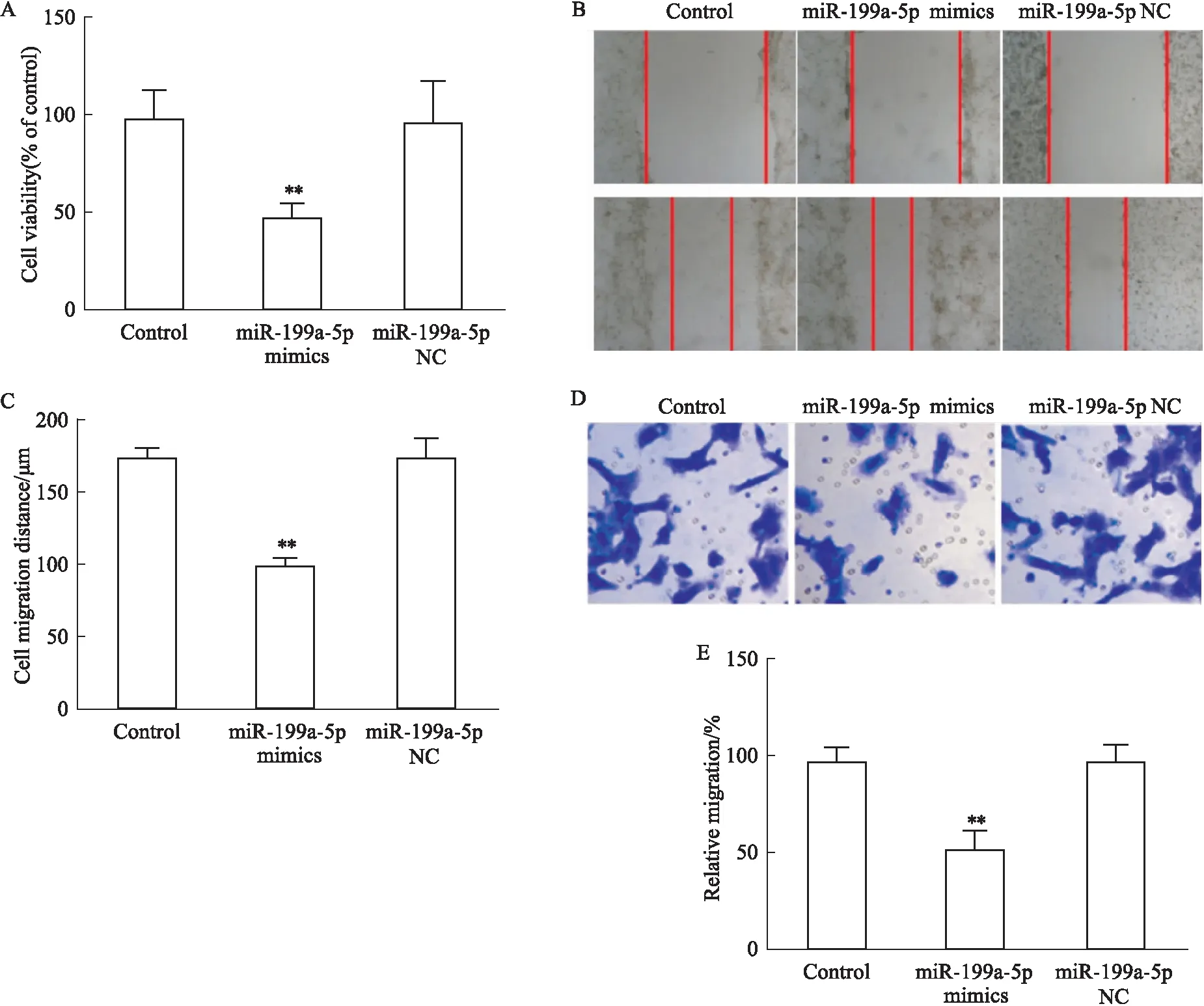
Fig 3 Effect of miR-199a-5p mimics on U251 cell A:The cell viability of U251 cells;B:Scratch assays were performed to test the migration ability of U251cells;C:Quantification of B;D:Transwell experiments were performed to test the migration ability of U251 cells;E:Quantification of D.**P<0.01 vs control.
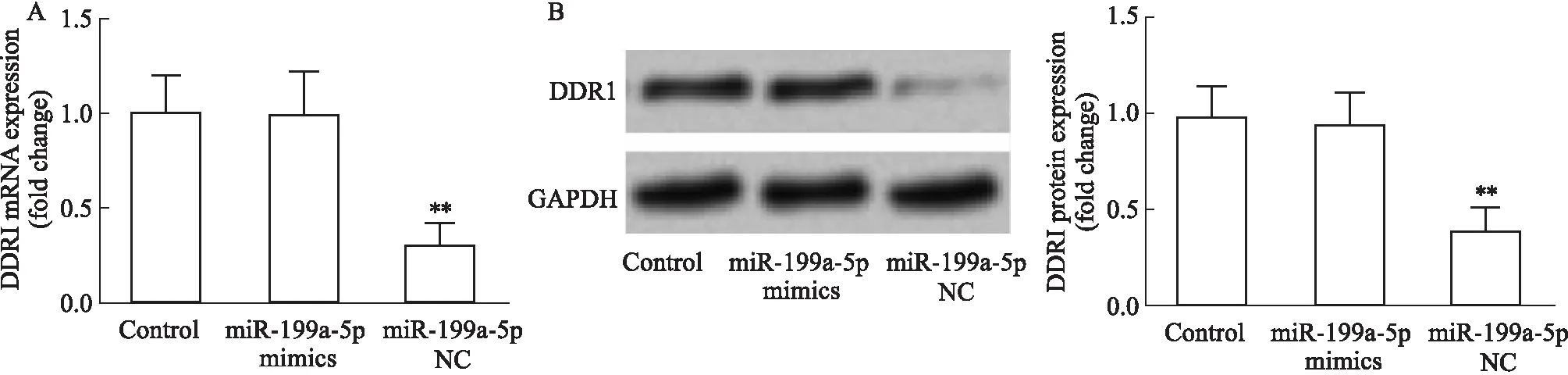
Fig 4 Effect of miR-199a-5p mimics on DDR1 A:The expression of DDR1 mRNA.B:The expression of DDR1 protein.**P<0.01 vs Control.
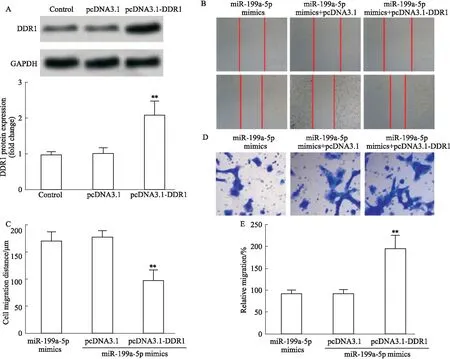
Fig 5 Effect of overexpression of DDR1 on miR-199a-5p inhibiting proliferation and migration of U251 A:The expression of DDR1 protein.B:Scratch assays were performed to test the migration ability of U251cells.C:Quantification of B.D:Transwell experiments were performed to test the migration ability of U251 cells.E:Quantification of D.**P<0.01 vs miR-199a-5p mimics.
4 讨论
miRNA是一类长度约20-25个核苷酸的内源性非编码单链小分子RNA,其主要机制是与靶基因3′-UTR完全或是不完全配对,进而降解靶基因mRNA或抑制翻译,并参与机体的生长发育、增殖、分化等相关生命活动[9]。miRNA在肿瘤的防治以及预后中发挥重要的调控作用。miR-199a是miRNAs中的一员,研究证实miR-199a在人体中是以miR-199a-5p和miR-199a-3p两种成熟形式存在[10]。新近研究发现,miR-199a在多种肿瘤进程中扮演不同的角色,在卵巢组织以及相应的细胞株中miR-199a表达下调,过表达miR-199a能够抑制肿瘤细胞增殖、迁移以及血管形成[11]。然而,在胃癌组织miR-199a表达明显高于癌旁正常的胃黏膜组织,进一步研究发现,miR-199a表达水平与胃癌患者的癌细胞转移成正相关[12]。在胶质瘤U251细胞中,miR-199a-3p表达明显下调,过表达miR-199a-3p能够抑制p21蛋白激活激酶4表达进而增加U251对化疗的敏感性[13]。另外,在神经胶质瘤细胞系中miR-199a-5p表达下调,过表达miR-199a-5p能够靶向抑制镁转运蛋白1表达,进而抑制神经胶质瘤细胞系增殖、迁移和侵袭[14]。以上研究均表明,miR-199a-5p在胶质瘤的进程,尤其增殖和迁移中发挥关键的抑制作用。但是,有关miR-199a-5p对胶质瘤增殖、迁移的分子作用机制尚不完全清楚。因此,本研究首先通过转染miR-199a-5p mimics 8 h发现U251细胞内可见大量荧光颗粒状,部分荧光颗粒可呈现细胞样轮廓。表明miR-199a-5p mimics已经成功转入U251细胞。进一步qRT-PCR检测各组U251细胞miR-199a-5p表达水平,结果显示与Control组相比,转染miR-199a-5p mimics组细胞miR-199a-5p表达明显升高。
细胞异常增殖和迁移是胶质瘤恶化的关键因素。CCK-8检测显示与Control相比,转染miR-199a-5p mimics能够明显降低U251细胞活力,抑制细胞增殖。细胞划痕实验和Transwell实验显示,与Control组相比,转染miR-199a-5p mimics组细胞迁移率明显降低。本研究结果与以往文献中miR-199a-5p抑制U251细胞增殖和迁移一致。DDR1是受体酪氨酸蛋白酶家族成员之一,广泛参与了肿瘤细胞的增殖和迁移过程。既往文献报道,在胶质母细胞瘤和临床组织样本中DDR1表达上调,DDR1抑制剂联合化疗能够降低增加胶质母细胞瘤对化疗药物的敏感性[15]。另外,DDR1a能够激活基质金属蛋白酶2诱导胶质母细胞瘤粘附和侵袭[16]。那么miR-199a-5p是否可以通过降低DDR1表达抑制胶质瘤细胞增殖和迁移呢?为此,本研究通过过表达miR-199a-5p发现miR-199a-5p mimics组DDR1 mRNA和蛋白表达水平显著低于Control。以往文献通过双荧光素酶报告基因实验证实miR-199a-5p能够靶向DDR1 3′-UTR抑制DDR1表达,从而调控肿瘤细胞增殖[17]。为进一步确证miR-199a-5p能够靶向DDR1抑制胶质瘤细胞增殖和迁移。本实验通过在转染miR-199a-5p的U251细胞中质粒转染pcDNA3.1-DDR1,探究过表达DDR1能够逆转miR-199a-5p对胶质瘤细胞增殖和迁移的作用。Western blot检测稳转pcDNA3.1-DDR1组DDR1蛋白表达显著增加,表明过表达DDR1质粒转染成功。细胞划痕实验和Transwell实验显示,与miR-199a-5p mimics组相比,转染pcDNA3.1-DDR1组胶质瘤细胞增殖和迁移降低。
综上所述,本研究通过探究miR-199a-5p对胶质瘤细胞增殖和迁移的影响。结果发现miR-199a-5p能够靶向DDR1抑制胶质瘤细胞增殖和迁移。以上研究结果为胶质瘤细胞增殖和迁移的发生机制提供了新的理论基础,miR-199a-5p可能成为胶质瘤治疗的生物靶点,但是需要进一步在动物模型或胶质瘤患者中确证。

