HR-HPV感染患者微量元素与阴道微环境中细胞因子的相关性研究
王珊珊,任静静,程旭红
(新乡市中心医院检验科,河南新乡 453700)
高危型人乳头瘤病毒(HR-HPV)持续感染是宫颈癌发生的必要因素,但仅存在HR-HPV 感染不足以将已感染细胞转化为肿瘤细胞,也可能是HR-HPV 感染病程中炎性反应和免疫反应的调控发生了改变[1-2]。微量元素通过多种途径调节炎症反应及免疫细胞因子的分泌,多项研究证实,微量元素含量异常与HPV 感染、宫颈高级别病变及宫颈癌有密切关系[3-6],但HR-HPV 患者微量元素与细胞因子的相关性研究报道较少且不全面。本研究探讨HR-HPV 感染患者血清微量元素及阴道微环境中细胞因子的差异,以及微量元素与细胞因子间的相关性,为寻找HPV 的治疗开辟新思路。
1 资料与方法
1.1 临床资料
选取2017 年1 月至2019 年5 月新乡市中心医院收治的66 例感染HR-HPV 宫颈病变患者,根据临床诊断分为宫颈上皮内瘤(CIN)Ⅰ组20 例[平均年龄(43.02±8.43)岁]、CIN Ⅱ~Ⅲ组25 例[平均年龄(42.17±9.62)岁]及宫颈癌组21 例[平均年龄(45.17±8.89)岁]。择取同期该院体检的20 例健康女性作为对照组[平均年龄(47.33±7.81)岁]。纳入标准:①年龄≥24 周岁;②HR-HPV 感染经病理诊断确诊为CIN 患者、宫颈癌Ⅰ期患者;③无其他宫颈疾病和恶性肿瘤;④无自身免疫疾病或使用免疫抑制剂治疗史。排除标准:①妊娠、哺乳期妇女;②1 周内有性行为、阴道用药;③心、肺、肝、肾功能异常。本研究通过医院伦理委员会批准,患者及其家属知情同意。4 组一般资料比较,差别无统计学意义(P>0.05)。
1.2 方法
1.2.1 阴道微环境中细胞因子检测 生理盐水充分冲洗阴道壁上1/3 及宫颈阴道部,用专用试剂管于后穹窿吸取灌洗液,离心取上清分装,-80℃保存备用。恢复室温后采用酶联免疫吸附法检测γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)水平,试剂盒购自武汉优尔生生命科学装备有限公司,操作步骤按试剂盒说明书进行。
1.2.2 清微量元素检测 采集外周静脉血分离血清,采用电子耦合-等离子体原子发射光谱仪进行检测血清中锌、硒、铁、锰、钴等微量元素。
1.3 统计学方法
数据分析采用SSPSS 19.0 统计软件。计量资料以均数±标准差()表示,比较用方差分析,进一步两两比较用SNK-q 检验;相关性分析用Pearson 法;P<0.05 为差异有统计学意义。
2 结果
2.1 4 组血清中微量元素水平比较
4 组铁、锰、钴等微量元素含量比较,差异无统计学意义(P>0.05),但均在正常值范围内。对照组血清中锌、硒水平>CINⅠ组>CIN Ⅱ~Ⅲ组>宫颈癌组,差异有统计学意义(P<0.05)。见表1。
2.2 4 组阴道微环境中细胞因子水平比较
4 组阴道微环境中细胞因子IFN-γ、TGF-β、IL-10、TNF-α 水平比较,差异有统计学意义(P<0.05)。见表2。
2.3 血清中锌含量与阴道微环境中细胞因子的相关性分析
血清锌含量与阴道中IFN-γ、TNF-α 水平呈正相关(r=0.573 和0.612,P=0.007 和0.009);而与阴道中IL-10、TGF-β 水平呈负相关(r=-0.193和-0.416,P=0.002 和0.003)。
表1 4 组血清中微量元素水平比较()
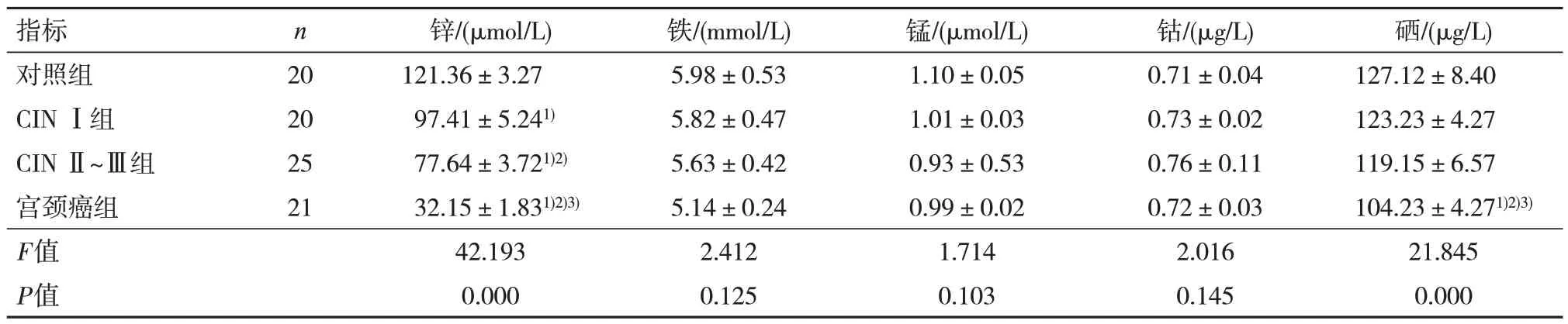
表1 4 组血清中微量元素水平比较()
注:1)与对照组比较,P<0.05;2)与CIN Ⅰ组比较,P<0.05;3)与CIN Ⅱ~Ⅲ组比较,P<0.05。
表2 4 组阴道微环境中细胞因子水平比较(,pg/mL)
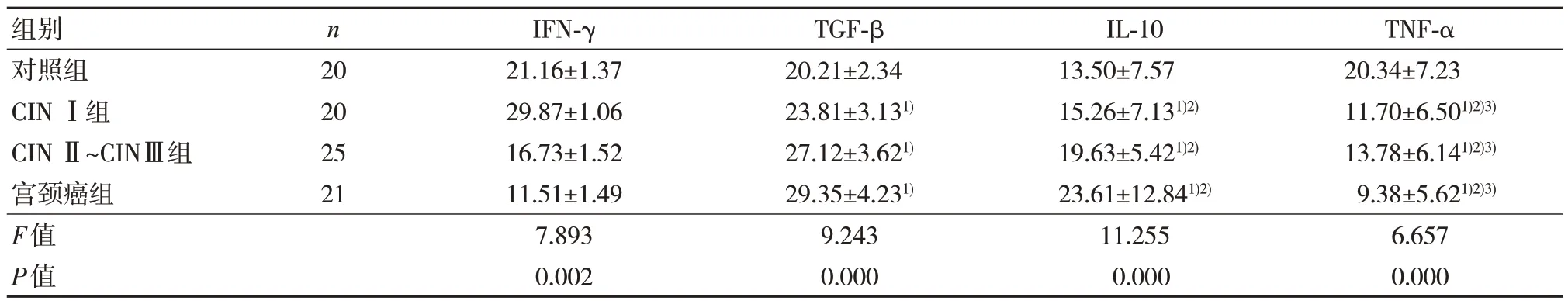
表2 4 组阴道微环境中细胞因子水平比较(,pg/mL)
注:1)与对照组比较,P<0.05;2)与CIN Ⅰ组比较,P<0.05;3)与CIN Ⅱ~Ⅲ组比较,P<0.05。
3 讨论
微量元素对人类的生存和健康起着至关重要的作用,已有研究证实,微量元素与感染性疾病及恶性肿瘤的发生密切相关[3-7]。本研究发现,HR-HPV 患者的锌含量明显降低,且随着临床分期的加重锌含量显著降低,而各组铁、锰、钴水平比较无差异,这与ABULIZI 等[8]研究指出血清镍和硒低水平与HPV 感染和CIN Ⅱ有关的结果不一致,而与张媛媛等[9]和文彩虹[10]研究锌是宫颈疾病组、宫颈癌的保护性因素的结果一致。本研究结果提示,锌含量的降低与HR-HPV 感染的发生及宫颈病变的进展有关,这可能与微量元素是维持机体免疫自稳、免疫监测和免疫应答所必需、其在体内的失衡可造成免疫调节的紊乱有关。
IFN-γ、TNF-α 主要是由Th1 细胞分泌的炎性因子,参于细胞免疫发挥抑制病毒复制和抗肿瘤作用[11-13]。IL-10 是下调或抑制炎性因子分泌的Th2 细胞因子[14],具有免疫抑制活性。TGF-β 是一类多肽类的生长因子,能够抑制机体淋巴因子活化杀伤细胞(ILAK)的产生和NK 细胞的活化、减少细胞因子的产生[14]。本研究结果显示,随着宫颈病变的发展,血清中IFN-γ、TNF-α 水平逐渐降低,而血清中IL-10、TGF-β 水平在CIN 组及宫颈癌组明显升高,表明HR-HPV 感染患者发生了免疫应答的紊乱及多种免疫细胞因子的异常,即机体发生了细胞免疫的调节异常,偏向于免疫抑制的Th2 细胞优势应答,且随着病变发展Th2 优势应答越明显,这与研究报道Th1/Th2 漂移是HRHPV 持续感染和宫颈癌发生的重要因素一致[15-17]。
本研究结果还发现,机体锌含量与阴道微环境中IFN-γ、TNF-α 呈正相关,而与阴道微环境中IL-10、TGF-β 呈负相关。这提示HR-HPV 感染病程中锌的缺乏与Th2 优势应答密切相关、造成CD4+T 细胞免疫应答紊乱,这可能是由于锌参与多种催化酶活性中心的构成。当机体内轻度缺锌时,血清胸腺素的活性显著下降,影响T 细胞功能,包括异基因细胞毒、抑制功能及IL-12 的产生功能等,造成Th1 和Th2 细胞功能的不平衡[18-19]。本研究HR-HPV 病毒载量CIN Ⅰ组<CINⅡ~Ⅲ组<宫颈癌组也证实Th1 细胞清除HPV 及抗肿瘤能力减弱。IL-10 通过激活JAK1/STAT3 信号传导通路促进E6、E7 癌基因蛋白表达,加剧癌变的发生;同时E6、E7 癌基因蛋白反式激活IL-10 过表达,形成恶性循环[20]。总之Th1/Th2 漂移是HR-HPV 持续感染和宫颈癌发生的重要因素。
综上所述,HR-HPV 感染患者血清微量元素锌显著降低,其与疾病发生、发展中免疫反应的异常密切相关。

