帕金森病伴焦虑患者静息态功能磁共振脑功能连接改变的研究
贾永锋,王建伟,刘 俊,张克忠,袁永胜,王 敏*
1南京医科大学第一附属医院放射科,2神经内科,江苏 南京 210029
帕金森病(Parkinson’s disease,PD)是一种神经系统退行性疾病,近年来,PD患者的非运动症状得到了越来越多的关注。焦虑是PD最常见的非运动症状之一,其发病率可达55%[1],远高于一般人群,严重影响患者生活质量[2]。此外焦虑在PD中比在其他慢性病中更加常见,提示PD伴发的焦虑可能涉及独特的病理生理机制。静息态功能磁共振成像(rs-fMRI)能反映自发的神经元活动[3]。既往对PD的rs-fMRI研究主要集中在运动症状,且大多为局部一致性、低频振幅等算法[4-5],对PD患者伴发焦虑的功能连接研究较少。体素镜像同伦连接(voxelmirrored homotopic connectivity,VMHC)可以量化评估双侧大脑半球同源脑区的功能连接,被认为是大脑内在功能结构的一个关键特征[6]。有研究报道在步态冻结和抑郁的PD患者中发现了VMHC的改变,提示VMHC可作为检测PD伴焦虑患者大脑半球功能连接改变的可靠手段。此外,目前的情绪相关神经生物模型广泛认为杏仁核在情绪加工中居主导地位[7],其通过与大脑其他皮层和皮层下区域的联系来进行情绪处理,因此以杏仁核为种子点观察相关的脑网络变化可能揭示焦虑潜在的病理生理机制。本研究采用VMHC和种子点功能连接方法对伴有焦虑的PD患者(PD-A组)、不伴焦虑的PD患者(PD-NA组)和健康对照组脑功能连接改变进行观察,为进一步了解PD伴焦虑的病理生理机制及临床治疗提供新的思路。
1 对象和方法
1.1 对象
收集2014年7月—2019年8月在南京医科大学第一附属医院神经内科诊治的PD患者112例,所有患者的临床诊断均符合英国PD学会脑库的诊断标准,均为右利手。排除标准:①进行性核上性瘫痪、多系统萎缩、血管性帕金森病综合征;②MRI禁忌证,如幽闭恐惧症、金属植入物或体内装置;③目前服用精神活性类药物;④患有严重神经精神疾病;⑤诊断为其他严重急慢性疾病。为了排除潜在的混杂因素,排除有严重认知下降的患者,定义为简易智能精神状态检查量表(MMSE评分)≤24分。在停用抗PD药物后至少12 h进行MRI扫描和临床检查,以减轻药物影响。同期,将54例无心理、神经功能障碍或神经影像学异常的健康对照组纳入本研究。实验开始前征得所有参与者的书面知情同意,研究由南京医科大学附属第一医院伦理委员会批准。
汉密尔顿焦虑(HAMA)量表是临床实践和研究中评估焦虑严重程度的主要依据[8]。根据HAMA量表评分结果,将≥12分的患者纳入为PD-A组共50例,和<12分的归为PD-NA组,共62例。同时使用帕金森统一评定量表第3部分(UPDRS-III)以及Hoehn和Yahr分级评分量表(H&Y分级)来评估疾病严重程度和疾病分期。记录每位PD患者的病程、每位受试者的教育年限等。
1.2 方法
MR图像采集:MR扫描采用德国西门子3.0T Tim Trio磁共振成像系统,所有病例均行MRI头颅常规序列、rs-fMRI和3D-T1WI扫描,扫描时嘱患者闭眼,保持清醒和不进行主动思维。rs-fMRI采用平面回波序列(echo-planar imaging,EPI),扫描参数为:TR 2 000 ms,TE 21 ms,翻转角90°,FOV 256 mm×256 mm,层数35,层厚3 mm,层间距0 mm,矩阵64×64,体素3 mm×3 mm×3 mm,时间点为240;3D-T1WI参数为:TR 1 900 ms,TE 2.95 ms,翻转角9°,层厚1 mm,层数160层,FOV 230 mm×230 mm,矩阵256×256,体素为1 mm×1 mm×1 mm。
数据处理:采用基于MATLAB平台的SPM12和DPABI软件进行数据预处理。预处理包括以下步骤:去除前10个时间点,对扫描图像进行时间校正,头动校正(排除头动平移>2 mm或旋转>2°的被试),使用DARTEL法配准被试结构像与功能像,以及去线性漂移、低频滤波以及去除协变量等。VMHC值的计算:将预处理数据配准到蒙特利尔标准空间,以体素3 mm×3 mm×3 mm大小重采样,计算脑内体素与对侧镜像体素BOLD信号的Pearson相关系数,通过FisherZ正态性转换为t值,以便于进一步分析。
1.3 统计学方法
使用SPSS 22.0软件对被试一般临床资料进行分析,其中性别采用卡方检验。定量资料先进行正态性检验和方差齐性检验,符合正态分布且方差齐的定量资料以均数±标准差()表示,3组间比较采用单因素方差分析;两组间比较采用两独立样本t检验。不符合正态分布的资料用中位数(四分位数)[M(P25,P75)]表示,采用多个独立样本非参数检验,P<0.05为差异具有统计学意义。
使用DPABI软件对3组的VMHC值进行协方差分析(ANCOVA),以年龄、性别、教育程度、灰质体积为协变量,使用非参数统计阈值分析(TFCE)方法行多重比较校正,运算5 000次,P<0.05的脑区为有统计学意义的脑区,然后提取这些脑区作为掩膜(mask),在掩膜内行双样本事后比较检验(post-hoc),多重比较校正同样采用TFCE法,运算5 000次,P<0.05的脑区为有统计学意义的脑区。
分别以VMHC分析得到的差异脑区和双侧杏仁核作为感兴趣区(region of interest,ROI),采用点对点种子点功能连接方法计算差异脑区与双侧杏仁核之间的功能连接。双侧杏仁核采用AAL模板构建,使用DPABI软件中的ROI Signal Extractor模块提取PD-A组与PD-NA组的ROI与双侧杏仁核的时间序列,其功能连接数值经FisherZ转换后,行组间独立样本t检验,P<0.05为差异具有统计学意义。最后将PD-A组额下回与杏仁核的功能连接值与HAMA评分进行Pearson相关性分析,P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床特征比较
本研究3组间年龄、性别及教育年限差异均无统计学意义(P>0.05);PD-A组与PD-NA组间病程、UPDRS-Ⅲ评分、H&Y分级、MMSE评分差异无统计学意义(P>0.05);PD-A组HAMA量表高于PD-NA组,差异具有统计学意义(P<0.05,表1)。
2.2 各组VMHC分析结果
PD-A组、PD-NA组和健康对照组间VMHC值差异有统计学意义,组间post-hoct检验显示,PD-A与PD-NA相比,双侧额下回(inferior frontal gyrus,IFG)三角部及岛盖部VMHC值减低,差异具有统计学意义(P<0.05,表2,图1)。
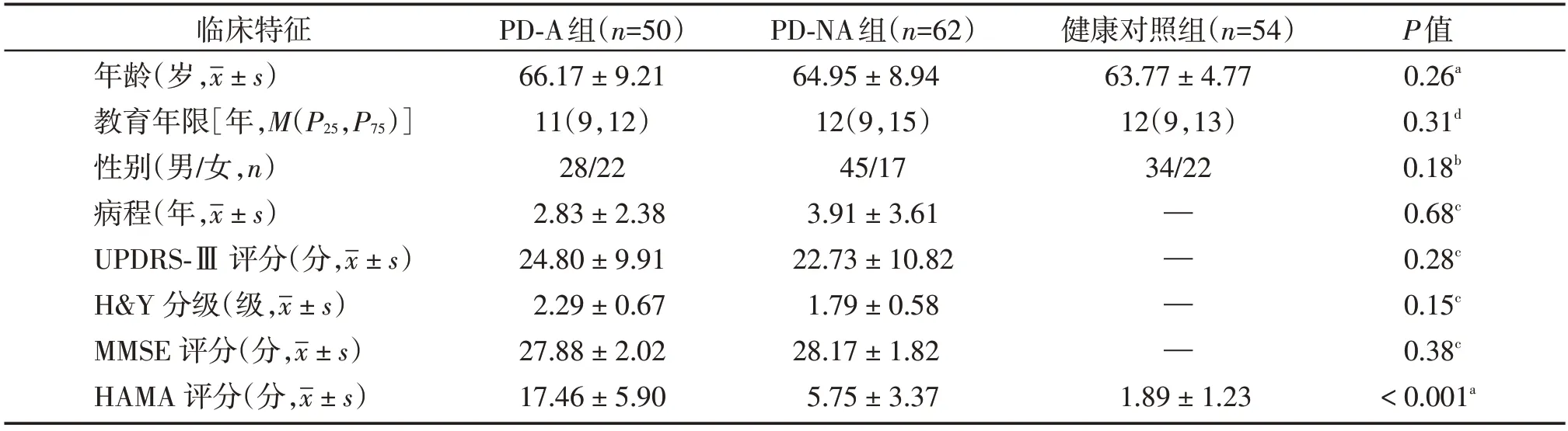
表1 3组间临床特征比较Table 1 Comparison of clinical characteristics among three groups
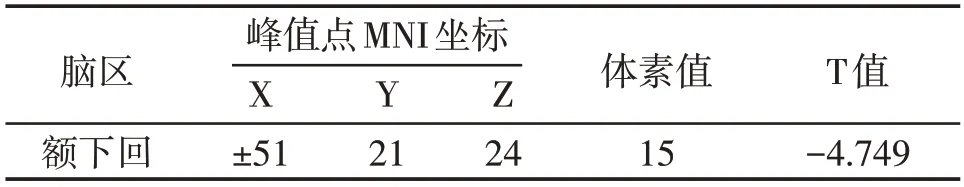
表2 PD-A组与PD-NA组的VMHC值差异结果Table 2 VMHC differences between PD-A and PD-NA
2.3 PD-A组与PD-NA组功能连接分析结果
PD-A组相较于PD-NA组,左侧额下回与左侧杏仁核功能连接增强(P<0.05);而左侧额下回与右侧杏仁核、右侧额下回与双侧杏仁核功能连接未见明显差异(P>0.05,表3,图2)。
2.4 PD-A组功能连接值与HAMA值相关分析结果
将PD-A组患者额下回与杏仁核的功能连接值与HAMA评分进行Pearson相关分析后发现,PD-A组左侧额下回-左侧杏仁核的功能连接值与HAMA评分呈正相关(r=0.486,P<0.001,图3)。余左侧额下回与右侧杏仁核、右侧额下回与双侧杏仁核各组的功能连接值与HAMA评分无相关性(P>0.05)。

图1 PD-A组相较PD-NA组的VMHC值差异脑区Figure 1 Brain regions with abnormal VMHC values in PD-A subtype compared to PD-NA

表3 PD-A组与PD-NA组功能连接结果Table 3 Functional connectivity results between PD-A and PD-NA

图2 PD-A组相较于PD-NA组功能连接异常脑区Figure 2 Brain regions with abnormal functional activity values in PD-A subtype compared to PD-NA

图3 PD-A组左侧额下回-左侧杏仁核的功能连接值与HAMA评分的相关分析Figure 3 Correlation between functional connectivity in left amygdala-left IFG and HAMA scores in PD-A group
3 讨论
本研究采用VMHC方法比较PD-A组、PD-NA组和健康对照组大脑半球间VMHC的变化。结果发现,PD-A组IFG的三角部、延伸至额下回岛盖部的VMHC值明显低于PD-NA组和健康对照组,说明PD-A组存在IFG的镜像同伦功能连接异常,同时点对点种子功能连接分析发现左侧IFG与左侧杏仁核的功能连接增强,且功能连接值与HAMA评分正相关,提示在PD患者中IFG的功能异常以及包含IFG在内的前额叶-杏仁核环路相关功能网络可能参与了焦虑的发生过程。
情绪的产生和调节主要受皮层及皮层下神经活动影响,情绪加工神经环路所涉及的脑区分为以下几类:与情绪形成有关的脑区,如杏仁核等皮层下边缘系统;与情绪自发调节处理相关的脑区,如前扣带回、额中回等;与自主情绪及认知调控相关的区域,如腹外侧前额叶、背外侧前额叶等[9]。而PD的病理基础是黑质致密部的神经元变性导致多巴胺分泌不足,基底神经节对丘脑的抑制性突触输出增加,从而使得丘脑向大脑皮层传递信号的频率大大降低,引发相应的功能障碍。在本研究中,PD-A组患者的双侧IFG较PD-NA组患者和健康对照组就呈现出明显的VMHC减低,而IFG是调控自我情绪及认知的前额叶的重要组成部分,提示了PD伴焦虑患者IFG的功能改变使得情绪的自上而下调节机制发生障碍,从而导致了焦虑的发生。此前一项基于体素形态学分析研究也表明,广泛性焦虑症患者IFG中灰质体积显著降低[10]。此外,IFG还是腹外侧前额叶皮层(ventrolateralprefrontalcortex,VLPFC)最主要的组成部分,VLPFC的一个重要作用就是参与恐惧环路的形成,恐惧环路被认为参与个体感知潜在危险时调节情绪以及保持威胁刺激的高警惕性的过程[11]。恐惧环路的重要作用在焦虑障碍的亚型(如广泛性焦虑症和惊恐亚型等)中得到广泛关注和认可。文献报道VLPFC外伤可导致焦虑程度减轻[12],动物模型也显示VLPFC与杏仁核的联系与焦虑症状有关[13]。
同时,我们采用点对点种子点功能连接方法,发现PD-A组患者的左侧杏仁核与左侧IFG之间功能连接较PD-NA组增强,相关分析显示PD-A组左侧额下回-左侧杏仁核的功能连接值与HAMA评分呈正相关(r=0.486,P<0.001),提示在PD患者中,杏仁核与前额叶功能网络代偿性的过度激活可能会导致患者情绪控制的异常,从而引发焦虑等情绪障碍的发生,且功能活动越活跃,HAMA评分越高,提示焦虑症状越严重。这也说明,左侧杏仁核与左侧IFG之间功能连接强度有可能作为PD焦虑发生的潜在影像学标志。既往针对普通人群焦虑症的研究表明,前额叶-杏仁核环路可能是普通人群焦虑障碍最主要的病理基础,大脑对于情绪刺激的精细反应依赖于丘脑-大脑皮层-杏仁核通路[14]。该环路将人体对于刺激的反应分为两部分,即以前额叶等认知控制相关脑区主导的自上而下的调节,和以杏仁核等区域直接编码刺激情感属性的自下而上的调节。当刺激发生时,杏仁核首先对于刺激进行编码并上传刺激过程,而前额叶区域则通过认知过程对于上行的刺激进行调控,从而实现刺激的再处理。PD-A患者前额叶VMHC功能连接的低下,对杏仁核的自上而下抑制减弱,使杏仁核对于负性情绪过度激活时调控发生障碍,从而可能产生持续的无法正常消退的焦虑症状[15]。Andreescu等[16]通过结构MRI研究发现PD伴焦虑患者左侧杏仁核的体积改变,从而有可能引发相关功能网络的异常。此外,本研究中双侧杏仁核功能连接分析提示左侧杏仁核与左侧IFG之间功能连接增强,其他种子点间无明显功能连接改变,提示杏仁核在情绪处理过程中可能存在偏侧化现象,这与之前的一项研究结果是一致的[17]。
本研究存在一些不足之处,首先我们主要关注的是PD患者有无焦虑症状的伴发,因此没有对患者的焦虑类型进行细分类;其次本研究PD伴发焦虑症状的维度相对较窄,没有将可能与PD患者焦虑严重程度有关的PD其他症状如视空间障碍、冻结步态[18]等因素纳入其中。在后续研究中我们将采用更为详细的分类和多维度的网络架构来进一步探究和充实本研究结果。
总之,本研究采用静息态fMRI方法,发现伴有焦虑的PD患者存在着双侧IFG的功能活动减低,左侧杏仁核-左侧IFG的功能连接增强,且与HAMA评分呈正相关,提示了伴有焦虑的PD患者存在这些神经环路的功能异常,为进一步揭示PD患者焦虑产生的病理生理机制以及临床针对性的治疗提供一定帮助。

