低强度脉冲式超声波对小鼠骨髓来源巨噬细胞极化和吞脂能力的影响
陈 绩,杨传熙,徐天华,孙 伟,孔祥清,盛燕辉*
1南京医科大学第一附属医院心内科,江苏 南京 210029;2东南大学医学院,江苏 南京 211189
冠心病是临床最常见的心血管系统疾病之一[1],也是世界范围内的主要致死疾病[2-4]。多数重症冠心病患者临床往往采用冠状动脉介入手术(percutaneous coronary intervention,PCI)治疗,但存在慢性全闭塞(chronictotal occlusion,CTO)和严重钙化病变等隐患,导致手术风险较大[5]。尽管已有相对成熟的临床用药[6],但药物治疗往往存在药物抵抗[7]及不良反应[8]等问题,长期应用可能会对身体造成损伤。我国冠心病病死率呈上升趋势,特别是农村地区,病死率上升明显。对冠心病的诊治需要日益强化的同时,仍存在因经济问题患者自行停药、拒绝手术的情况,冠心病的医疗费用负担是造成患者治疗依从性差的重要原因。急需探索和完善安全、无创、低价的物理治疗手段。
巨噬细胞主要拥有参与炎症的M1型和抗炎的M2型两个极化方向[9],其炎症极化方向和吞脂能力的变化,会影响泡沫细胞的形成和血管斑块脂质沉积[10-11],是冠心病发生发展的重要环节[12],因此抑制巨噬细胞向M1型方向极化和减弱其吞脂能力可能成为治疗冠心病的关键策略之一。
超声治疗利用超声波在组织中传播所产生的热效应、机械效应等生物效应达到治疗效果,是近年来凸显的一种新型治疗手段,目前主要处于实验研究阶段。其中较高频率的超声波穿透能力差,传递过程中易发生较多的能量衰减,导致到达治疗部位的能量达不到治疗数量级,一些学会判定高频超声的疗效不确定,越来越多的学者将关注转向了低强度脉冲式超声波(low-intensity pulsed ultrasound,LIPUS)。LIPUS由于频率较低,强度不高,因而在组织中传播时声能衰减低,被组织吸收少。它所产生的热效应和对组织的升温作用均接近于可忽略的程度,主要通过机械效应起到治疗作用。这种声波以压力波的形式存在,可对组织细胞产生微型压力作用[13]。本实验拟在体外通过脂多糖(lipopolysaccharide,LPS)诱导巨噬细胞的炎症模型,采用不同强度的LIPUS进行处理,探讨LIPUS对巨噬细胞M1型极化和吞脂能力的影响及其分子机制,为冠心病临床无创治疗的新方法提供实验基础和理论依据。
1 材料和方法
1.1 材料
C57BL/6小鼠(北京维通利华实验动物技术有限公司),集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)(R&D公司,美国),LPS(Sigma公司,美国),DMEM高糖培养基(Gibco公司,美国),青霉素、链霉素、胎牛血清(fetal bovine serum,FBS)(Biological Industries公司,以色列),TRIzol试剂(Bioflux公司,日本),DEPC水、CCK-8试剂(日本Dojindo公司),SybrGreen qPCR Master Mix(含Rox)、双蒸水(doble distilled water,ddH2O,日本TaKaRa公司),SYBR Green荧光染料、流式细胞术分析试剂盒(ThermoFisher公司,美国),苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、蛋白上样缓冲液、BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),十二烷基硫酸钠聚丙烯酰胺凝胶快速制备试剂盒(上海雅酶生物科技有限公司),聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(上海罗氏诊断产品有限公司),牛血清白蛋白(bovine serum albumin,BSA)(ICN生物医学化学药品公司,美国),DiI标记的氧化低密度脂蛋白(DiI-Ox-LDL)(广州奕元生物技术有限公司),辣根酶标记山羊抗小鼠IgG、辣根酶标记山羊抗兔IgG(北京中杉金桥公司),GAPDH抗体、p65抗体、p-p65抗体、p38抗体、pp38抗体、JNK抗体、p-JNK抗体、ERK抗体,p-ERK抗体(Cell Signaling Technology公司,美国)。
1.2 方法
1.2.1 原代小鼠骨髓来源的巨噬细胞分离与培养
脊髓脱臼处死6周龄C57BL/6小鼠(实验动物伦理批准号:IACUC-2008020),酒精浸泡,取胫骨剪断远端,注射器吸取培养基插入胫骨近端,冲洗出骨髓原代前体细胞,添加GM-CSF使其成熟为原代巨噬细胞,37 ℃、5%二氧化碳培养,隔天换液。
1.2.2 LIPUS辐照细胞
与前期研究[14]一致,实验采用超声设备(Agilent Technologies,Santa Clara,美国)发射LIPUS对巨噬细胞进行辐照处理。超声参数:频率0.5 MHz,电压50~150 mVpp,声强4.825~43.425 mW/cm2,时长20 min,每天2次,每次间隔6 h。超声后以LPS(100 μg/mL)诱导24 h后进行下一步处理。
1.2.3 流式细胞术检测细胞凋亡情况
将LIPUS辐照处理后的各组细胞移至装有DMEM培养基的15 mL离心管中,1 000 r/min离心5 min。弃上清,加预冷PBS重悬,1 000 r/min离心5 min,重复此操作3遍后弃上清,倒置离心管,吸干PBS。对照组避光加入500 μL缓冲液,按每支流式管100 μL分为空白对照1管、单加碘化丙啶(propidium iodide PI)1管、单加膜联蛋白V(Annexin V)1管、双加PI/Annexin V 2管,其余辐照处理组加入200 μL缓冲液平均分为两管,加入PI/Annexin V。每管避光孵育15 min,加入300 μL缓冲液吹打均匀,使用流式细胞仪检测细胞凋亡情况。
1.2.4 CCK-8法检测细胞活性
将LIPUS辐照处理后各组细胞按每组4孔,每孔100 μL DMEM培养基,每孔细胞计数1.5×103的密度布板细胞悬液,培养箱培养24 h。然后避光将每孔中的旧培养基换为10 μL CCK-8+100 μL DMEM培养基的混合液,于等量空白孔里也加110 μL混合液用于对比参照。温箱孵育2 h后,使用酶标仪检测LIPUS辐照处理下巨噬细胞活性。
1.2.5 LIPUS辐照热效应检测
将培养皿放置于超声辐照探头上,确保接触紧密。连接测温仪与测温针,测试校准后,固定测温针顶端接触培养皿底部正中心,设定测温记录参数为1 s采集2次,采集20 min,进行LIPUS热效应检测。
1.2.6 实时荧光定量PCR(qPCR)
LPS(100 μg/mL)诱导24 h后收取RNA,进行PCR检测,具体方法如下:每6 cm皿添加1 mL TRIzol试剂,充分研磨后移液至1.5 mL EP管,每管添加200 μL氯仿震荡后12 000g4 ℃离心15 min,移上层无色水相至另一EP管,加等体积异丙醇12 000g4 ℃离心10 min,弃上清加75%乙醇1 mL,颠倒后7 500g4 ℃离心10 min,弃上清液,滤纸吸取残留液体室温干燥10 min,沉淀溶于DEPC水,分光光度计计算所得RNA浓度与纯度,于10 μL EP管中按总RNA 500 ng添加对应体积RNA,补充适量DEPC水使总体积达到8 μL,于管中加入2 μL SybrGreen qPCR Master Mix(含Rox),震荡离心,使用逆转录仪按程序参数:35 ℃15 min,85 ℃5 s将RNA逆转录为cDNA。按2.5 μL SYBR、0.05 μL上游引物、0.05 μL下游引物,2.4 μL cDNA的5 μL体系加样,遵循两步法程序参数设定PCR反应循环,95 ℃10 min进行预变性;95 ℃15 s,60 ℃1 min,40个循环,用2-ΔΔCT法计算目的基因的相对表达量。

表1 PCR引物Table 1 Primers for PCR
1.2.7 Western blot
LPS(100 μg/mL)诱导24 h后收取蛋白,具体方法如下:蛋白裂解液按90∶1添加PMSF后,每6 cm皿添加80 μL蛋白裂解液,充分研磨后移液至1.5 mL EP管,冰上裂解30 min,12 000g离心15 min去除杂质取上清液,采用BCA法测定蛋白浓度,加入蛋白上样缓冲液煮沸5~6 min。配制10%SDS-PAGE凝胶,电泳至蛋白条带分隔清晰。分离后的蛋白转膜至PVDF膜上,BSA溶液封闭2 h,于一抗中4 ℃孵育过夜,次日于对应二抗中孵育2 h、洗脱20 min后,曝光显现蛋白条带。
1.2.8 脂滴吞噬染色
细胞每皿添加2.0 mg/mL的DiI-Ox-LDL 3 mL,避光37 ℃培养3 h后,吸尽含DiI-Ox-LDL的培养基,PBS冲洗3次,4%多聚甲醛室温固定20 min,ddH2O室温冲洗5 s,每皿添加3 mL PBS。荧光倒置显微镜下拍摄细胞脂滴吞噬图像。
1.3 统计学方法
所有实验均重复3次,采用SPSS 22.0进行统计学分析,采用软件Graphpad prism 7绘制图表。数据处理时,计量资料经检验,数据符合正态分布,方差齐,结果以均数±标准差()表示。多组之间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 LIPUS对小鼠骨髓来源巨噬细胞凋亡与活性的影响
为了检测所用超声强度对巨噬细胞凋亡的影响,实验通过流式细胞术检测了巨噬细胞凋亡状态的变化。不同强度(4.825、19.300、43.425 mW/cm2)的LIPUS辐照处理巨噬细胞后,与对照组对比,凋亡细胞所占比例未有明显变化(图1A)。CCK-8法检测结果显示,与同时间点对照组相比,LIPUS辐照处理的小鼠骨髓来源巨噬细胞活性未出现明显差异(图1B)。此外,实验通过热电偶测温技术检测了LIPUS辐照过程中细胞培养基温度变化情况。测温数据显示,20 min的LIPUS辐照处理过程中,培养基温差稳定在±1 ℃(图1C),超声辐照过程中未产生明显的热效应。

图1 LIPUS对小鼠骨髓来源巨噬细胞凋亡与活性的影响Figure 1 Effects of LIPUS on apoptosis and viability of murine bone marrow-derived macrophage
2.2 LIPUS对LPS诱导巨噬细胞向M1型分化的作用
为了检测LIPUS对巨噬细胞极化的作用,实验通过qPCR技术检测了M1型巨噬细胞标志基因白介素(interleukin,IL)-6、IL-23α、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的mRNA水平变化。实验使用LPS(100 μg/mL)诱导巨噬细胞向M1型极化,结果显示,LPS诱导能够显著上调巨噬细胞IL-6、IL-23α、TNF-α、iNOS的mRNA水平。与LPS诱导组相比,LIPUS辐照后能够下调LPS诱导的IL-6、IL-23α、TNF-α、iNOS的mRNA水平(图2)。
2.3 LIPUS对M1型巨噬细胞吞噬效率的影响
为了检测LIPUS对M1型巨噬细胞吞噬能力的影响,将巨噬细胞与DiI-Ox-LDL共培养24 h后,通过荧光显微镜观察巨噬细胞的吞脂能力。Image J软件分析可得对照组、LPS(100 μg/mL)组、LPS+4.825 mW/cm2组、LPS+19.300 mW/cm2组、LPS+43.425 mW/cm2组吞脂效率分别为(60.9±1.9)%、(72.7±1.2)%、(28.6±7.1)%、(43.1±2.6)%、(27.3±1.8)%,结果显示,与LPS组相比,LIPUS辐照处理明显降低了LPS诱导的巨噬细胞的吞脂能力(图3)。
2.4 LIPUS对巨噬细胞NF-кB/MAPK信号通路活化的影响
为了阐明LIPUS抑制巨噬细胞M1型极化和减弱巨噬细胞吞脂能力的机制,实验通过Western blot技术检测了NF-κB和MAPK通路信号分子的变化。与对照组相比,LPS明显诱导了NF-κB/MAPK信号通路的活化,增强了p38、ERK、JNK和p65的磷酸化。而LIPUS辐照处理后,下调了NF-κB/MAPK通路p-p38、p-ERK、p-JNK和p-p65的蛋白水平(P<0.05,图4),进一步提示LIPUS可能通过NF-κB/MAPK信号通路来调控巨噬细胞的极化和吞脂能力。

图2 LIPUS对LPS诱导巨噬细胞向M1型分化的作用Figure 2 Effects of LIPUS on polarization of LPS-induced macrophage to the M1 phenotype

图3 LIPUS对M1型巨噬细胞吞噬效率的影响Figure 3 Effects of LIPUS on phagocytosis efficiency of M1 phenotype macrophage
3 讨论
LIPUS作为超过人类听阈范围的高频声波,以压力波的形式存在,可对组织细胞产生微型压力作用[13]。LIPUS的空化效应[15]已被应用于肿瘤抑制[16]、穿透血脑屏障[17]等领域。在心血管领域,Charles等[18]研究发现通过脾和颈部脉冲超声可明显减少急性高血糖心肌梗死面积,其治疗效果可能是通过胆碱能抗炎途径发挥作用。此类研究更侧重于冠心病发展到重症阶段时,急性心肌梗死(acute myocardial infarction,AMI)发生后,LIPUS对心梗面积的恢复作用。AMI发作急骤且病程已发展至晚期,往往导致较为严重的预后,且对于轻中症患者关注不足,没有起到发病前预防的效果。已有研究指出,冠心病患者病情的早期发现早期干预具有重要的意义[19]。同时,此类文章往往以整体器官作为研究对象,实验结果可能会受到个体发育与手术操作效果的影响,对于慢性冠心病脂质沉积发展过程中,LIPUS对巨噬细胞本身造成的炎症极化方向和吞脂能力改变并未给予太多关注。而在人体炎症过程中,巨噬细胞向M1型方向极化,吞脂能力增强,最终形成泡沫细胞沉积于动脉内膜之下的过程,是冠心病发生发展的重要环节。过往研究表明,LIPUS能够被用于治疗病毒性心肌炎[20]、心脏功能障碍[21]等疾病。但LIPUS是否能通过作用于巨噬细胞对其极化方向和吞脂能力产生影响,目前仍然未见报道。本文首次阐明LIPUS对小鼠骨髓来源巨噬细胞极化和吞脂能力的影响。
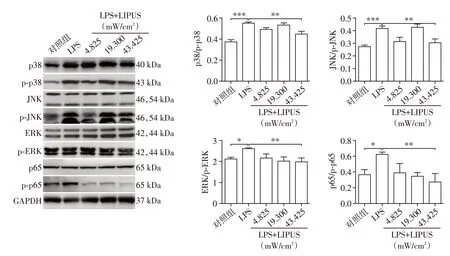
图4 LIPUS对巨噬细胞NF-кB/MAPK信号通路活化的影响Figure 4 Effects of LIPUS on activation of NF-кB/MAPK pathways in macrophage
冠心病是一种炎症性、代谢性疾病,主要由动脉粥样硬化引起。脂质代谢异常和炎症在动脉粥样硬化及其并发症的发生、发展中起重要作用[22],二者高度相关[23]。有资料表明,相比胆固醇的累积,炎症被认为在发病过程中的作用更为关键[24]。本研究发现,辐照强度达到43.425 mW/cm2时,LIPUS不仅下调了LPS诱导的M1型巨噬细胞标志基因的mRNA水平,同时减弱了M1型巨噬细胞的脂质吞噬能力,这证明了LIPUS具有通过巨噬细胞发挥抗炎、降脂质积累的效果,可能对冠心病起到进一步预防与治疗作用。
NF-κB/MAPK信号通路是影响炎症极化最为重要的信号通路之一,通路的激活往往意味着细胞的极化方向更大比例转为致炎M1方向[25],可能影响巨噬细胞对脂滴的吞噬能力。实验中对巨噬细胞p38、JNK、ERK、p65的磷酸化水平进行检测。Western blot结果显示,LIPUS能够下调LPS诱导的pp38、p-JNK、p-ERK和p-p65的蛋白水平,表明LIPUS可能是通过抑制NF-κB/MAPK信号通路的活化来起到治疗效果。未来诊疗中在单独通过LIPUS起到冠心病防控的同时,可以通过配合已有的超声空化效应研究和传统临床药物、手术,起到联合治疗的作用。
综上所述,本研究发现LIPUS可抑制小鼠来源的巨噬细胞向M1型极化以及减弱M1型巨噬细胞的吞脂能力,其机制可能与抑制LPS活化的NF-κB/MAPK通路有关。为临床预防与治疗冠心病,降低血管脂质沉积提供了新的思路。

