社区人群脑微出血与基底节区核团体积的相关性研究
苏宁,王全,梁新宇,韩菲,周立新,姚明,崔丽英,龚高浪,朱以诚,倪俊
脑微出血(cerebral microbleeds,CMBs)是脑内微小血管病变导致的以血管周围含铁血黄素沉积为主要特征的一种脑实质损害[1]。CMBs是脑小血管病的影像标志物之一,在梯度回波T2*WI或SWI上显示为边界清晰的圆形或类圆形低信号灶[2],为局灶性含铁血黄素沉积。根据解剖部位,CMBs可分为局限皮层CMBs以及深部/混合CMBs[3-6]。不同部位的CMBs,代表不同形式的病理改变,局限皮层CMBs病理上主要与脑淀粉样血管病相关,而深部/混合CMBs主要与高血压相关[7-8]。
脑体积是反映整体神经功能的重要标志,随着年龄增长,脑体积逐渐减小,特定的病理条件可加速年龄以外的脑萎缩进程[9],因此整体的脑萎缩从宏观角度反映了整体神经功能的退化。脑萎缩病理改变包括神经元丢失、皮层变薄,皮质下血管病变伴脑白质稀疏和萎缩,小动脉硬化、静脉胶原变性和继发性神经退行性改变等[7]。脑血管病理改变可通过影响脑体积而进一步影响认知及运动等神经功能。既往研究提出,脑萎缩可单独预测卒中或痴呆的发生[10-11]。因此,脑萎缩是反映整体神经功能的重要指标。
关于脑小血管影像改变与脑体积或脑萎缩的相关性研究,多集中在缺血性影像改变,如脑白质高信号、腔隙,与皮层或皮层下结构的相关性,关于CMBs与脑体积的相关性研究较有限[12-13]。在遗传性脑淀粉样变性患者中发现,血管淀粉样变是导致皮层萎缩的独立危险因素[12]。北京顺义社区人群队列研究曾报道,CMBs负荷与皮层下白质及海马体积负相关,并提出海马萎缩可能是连接脑小血管病出血性病理改变与神经退行性改变的一个桥接因素[13]。国际及国内关于CMBs与基底节区核团体积的相关性研究较少。基底节区核团包括尾状核、壳核、苍白球、丘脑等,对运动控制及运动调节起着重要的作用[14-18]。颅内微出血病变是否会引起深部黑质核团的结构改变,进一步影响运动控制及感觉传导等运动相关的功能改变,尚未可知。本研究旨在探讨CMBs的部位及负荷与基底节区核团体积的相关性,为探讨CMBs相关的脑结构及临床神经功能改变提供更多的证据。
1 对象与方法
1.1 研究对象 顺义研究是北京顺义地区基于社区人群的长程队列研究,该队列的研究目的是探讨中国社区人群脑改变的危险因素及结局[19]。研究纳入顺义地区大孙各庄镇5个村(东尹家府、西尹家府、陀头庙村、赵家裕村、小段村)年龄≥35岁且能够独立生活的受试者。基线信息的采集从2013年6月-2016年4月。本研究获得北京协和医院伦理审核会的批准(批准号:B-160),受试者均自愿签署知情同意书。
纳入标准:①年龄≥35岁,且能独立生活;②已完善基线头颅MRI检查,且影像质量良好。
排除标准:①既往卒中病史;②缺乏认知数据或被诊断为痴呆。
1.2 研究方法
1.2.1 资料收集 基线评估内容包括标准结构化问卷、体格检查、头颅MRI检查等[20-21]。应用统一设计的调查问卷收集所有受试者的基本临床资料,包括年龄、性别、受教育程度、身高、体重、血压、吸烟史、饮酒史、用药史及脑血管病危险因素等。量表信息收集及体格检查均由经过培训的神经内科医师完成。
1.2.2 脑血管病危险因素的评估 满足以下任意一项者定义为高血压:基线收缩压≥140 mmg Hg或舒张压≥90 mm Hg;既往诊断为高血压;服用降压药;随访中出现新发高血压。满足以下任意一项者定义为糖尿病:既往诊断糖尿病;空腹血糖≥7.0 mmol/L;目前服用降糖药或接受胰岛素治疗;随访过程中出现新发糖尿病。满足以下任意一项者定义为高脂血症:TC>5.2 mmol/L;LDL-C>2.58 mmol/L;目前服用降脂药治疗;既往诊断为高脂血症。目前吸烟:最近1个月有吸烟。目前饮酒:最近一个月有饮酒,至少每周1次。
1.2.3 脑小血管病影像负荷评估 所有受试者图像均使用同一台3T MRI扫描仪(Skyra,Siemens,Erlangen,Germany),由放射科医师负责数据采集,图像采集时间2014年7月-2016年4月。一致性评估:每项脑小血管影像学指标由一名神经科医师评估完成,1个月以后随机抽取50名受试者的影像资料,计算评估者内一致性。腔隙的Kappa值为0.95,CMBs的Kappa值为0.9,基底节区和白质区血管周围间隙(perivascular spaces,PVS)评分的Kappa值分别为0.71和0.61。脑白质高信号自动分割与手工半自动标注的DICE系数为0.62。
(1)CMBs:使用SWI评估CMBs情况。SWI参数:重复时间20 ms,回波时间27 ms,视野200 mm×220 mm,层厚1.5 mm,翻转角15 °,共80张轴位图像。CMBs在SWI上表现为小圆形或卵圆形、边界清楚、均质性信号缺失灶,直径不超过10 mm,病灶至少50%被脑实质围绕,排除铁或钙沉积、骨质、血管流空影及弥漫性轴索损害等[1]。按照有无CMBs,将受试者分为无CMBs和有CMBs组;按照CMBs负荷分组,分为无CMBs、1~2个CMBs及≥3个CMBs组;按照CMBs部位分组,分为无CMBs、局限皮层CMBs及深部/混合CMBs组。仅有皮层CMBs,定义为局限皮层CMBs;有深部CMBs,伴或不伴皮层CMBs,定义为深部/混合CMBs。
(2)脑白质高信号:位于脑白质区域内,T1WI呈等信号或低信号,T2WI及FLAIR上呈高信号,不同于脑脊液信号。应用SPM12软件和LST工具包进行脑白质高信号自动分割及容量计算。
(3)腔隙:直径为3~15 mm,边界不光滑的液化病灶,分布于基底节区、脑白质及脑干,在全部序列上呈脑脊液信号。腔隙在3D-T1WI上评估,需与血管周围间隙鉴别。
(4)PVS:在全部MRI序列上均显示为脑脊液信号;直径一般<3 mm。根据解剖部位,PVS分为基底节区PVS(PVS in basal ganglia,PVS-BG)和皮层下白质区PVS(PVS in white matter,PVS-WM)。PVS-BG的分级标准如下:1级,PVS≤5个;2级,6~10个;3级,>10个但仍可数;4级,不可数,导致筛孔样改变[22]。PVS-WM分级:1级,PVS总数≤10个;2级:PVS总数>10个且在包含最大数量PVS的层面≤10个;3级,在包含最大数量PVS的层面为11~20个;4级,在包含最大数量PVS的层面>20个[22]。重度PVS-BG定义为:PVS-BG评分3级或4级;重度PVS-WM定义为:PVS-WM评分3级或4级。
1.2.4 基底节区核团体积提取
(1)颅内总体积:应用S P M12 软件及CAT12工具包在3D T1WI图像上进行脑结构自动分割,计算脑灰质、脑白质和脑脊液体积。颅内总体积是脑灰质、脑白质及脑脊液三者容量之和。
(2)基底节区核团体积:应用CIVET软件可以对脑影像数据进行自动化分析。通过使用FIRST皮层下核团计算软件完成皮层下核团(尾状核、苍白球、壳核、丘脑)体积的提取[23]。在分析中,尾状核、苍白球、壳核、丘脑的体积分别是左右侧核团体积之和的平均值,整体基底节区体积为左右侧尾状核、苍白球、壳核、丘脑体积之和的平均值。统计分析通过工具包SurfStat完成。基底节、尾状核、苍白球、壳核、丘脑体积分数分别定义为相关部位体积所占颅内总体积的百分比,具体公式为:(基底节体积÷颅内总体积)×100%。
1.2.5 统计学方法 比较CMBs不同分组间基本流行病学信息、脑血管病危险因素、脑小血管病影像负荷及脑体积参数的差异。计数资料用频数和率(%)进行描述,两组及多组间的比较采用χ2检验。符合正态分布的计量资料用描述,两组间比较采用t检验或秩和检验,多组间比较采用方差分析。对于多因素分析,采用广义线性模型评估CMBs(无CMBs、1~2个局限皮层CMBs、≥3个局限皮层CMBs、1~2个深部/混合CMBs及≥3个深部/混合CMBs)与基底节区核团体积分数(基底节、尾状核、苍白球、壳核、丘脑)的相关性。模型1:校正年龄、性别;模型2:校正年龄、性别、高血压、脑白质高信号体积及腔隙。分析结果用β(SE)来呈现,用伪发现率(false discovery rate,FDR)进行多重校正。使用SAS 9.4软件进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 总人群共1844例,剔除未完成MRI检查或影像质量不佳、既往卒中病史、未完成认知测试或痴呆受试者,最终纳入分析997例(图1)。纳入分析人群平均年龄56.7±9.3岁,其中男性占34.7%;无CMBs的受试者共903例(90.6%),有CMBs的受试者共94例(8.4%)。
2.2 基底节区核团体积在不同脑微出血组间的差异
(1)有无CMBs组:相比无CMBs组,有CMBs组年龄更大、男性比例更高、高血压所占比例更高,脑白质高信号体积及腔隙所占比例较高,基底节区、苍白球、尾状核及丘脑体积所占总脑体积的百分比较低,差异均具有统计学意义(表1)。
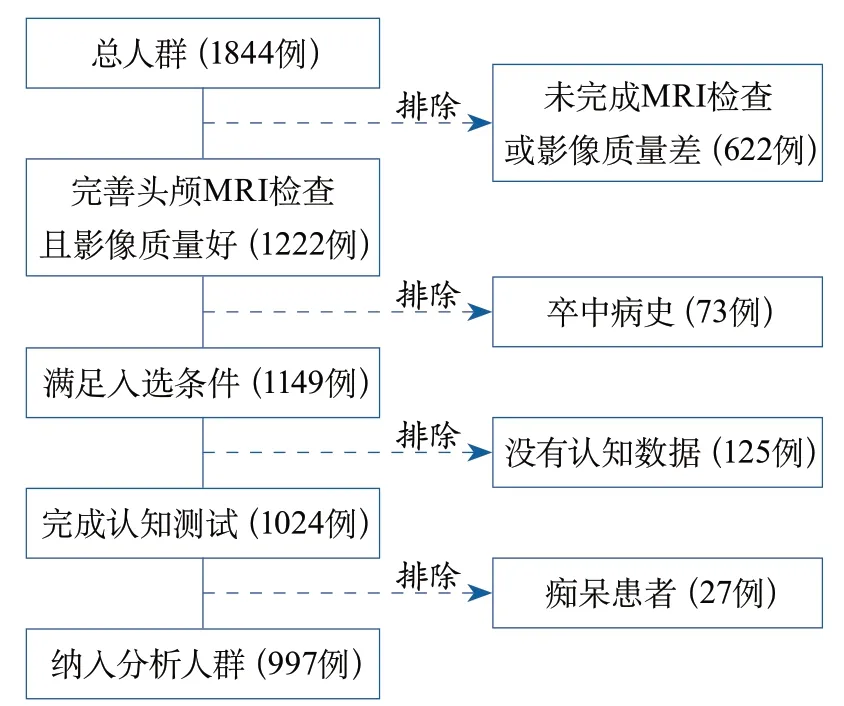
图1 入组流程图
(2)不同CMBs负荷组:无CMBs组903例,1~2个CMBs组73例,≥3个CMBs组21例;年龄、男性比例、目前饮酒所占比例、高血压所占比例、脑白质高信号体积、腔隙所占比例,以及基底节区、苍白球、尾状核和丘脑体积所占总脑体积的百分比在三组间差异有统计学意义(表2)。
(3)不同CMBs分布组:无CMBs组903例,局限皮层CMBs组48例,深部/混合CMBs组46例;年龄、男性比例、高血压所占比例、脑白质高信号体积、腔隙所占比例,以及基底节区、苍白球、尾状核和丘脑体积所占总脑体积的百分比在三组间差异有统计学意义(表3)。
2.3 脑微出血与基底节区核团体积的相关性多因素模型分析发现,与无CMBs相比,≥3个深部/混合CMBs与苍白球体积负相关;使用FDR方法对结果进行多重校正,差异仍具有统计学意义。≥3个深部/混合CMBs虽与基底节体积、丘脑体积相关,但该相关性校正高血压及缺血性脑小血管病影像标志物(脑白质高信号、腔隙)后无统计学意义(表4)。
3 讨论
本研究主要探讨CMBs部位及负荷与基底节区核团体积的相关性。本研究发现CMBs及负荷与脑体积存在相关性。进一步多因素分析显示:较高负荷的深部/混合CMBs(≥3个)与较小的苍白球体积紧密相关,该相关性独立于脑血管病危险因素(高血压)及脑小血管病缺血性影像改变(脑白质高信号及腔隙)。

表1 基底节区核团体积在有无脑微出血组的情况
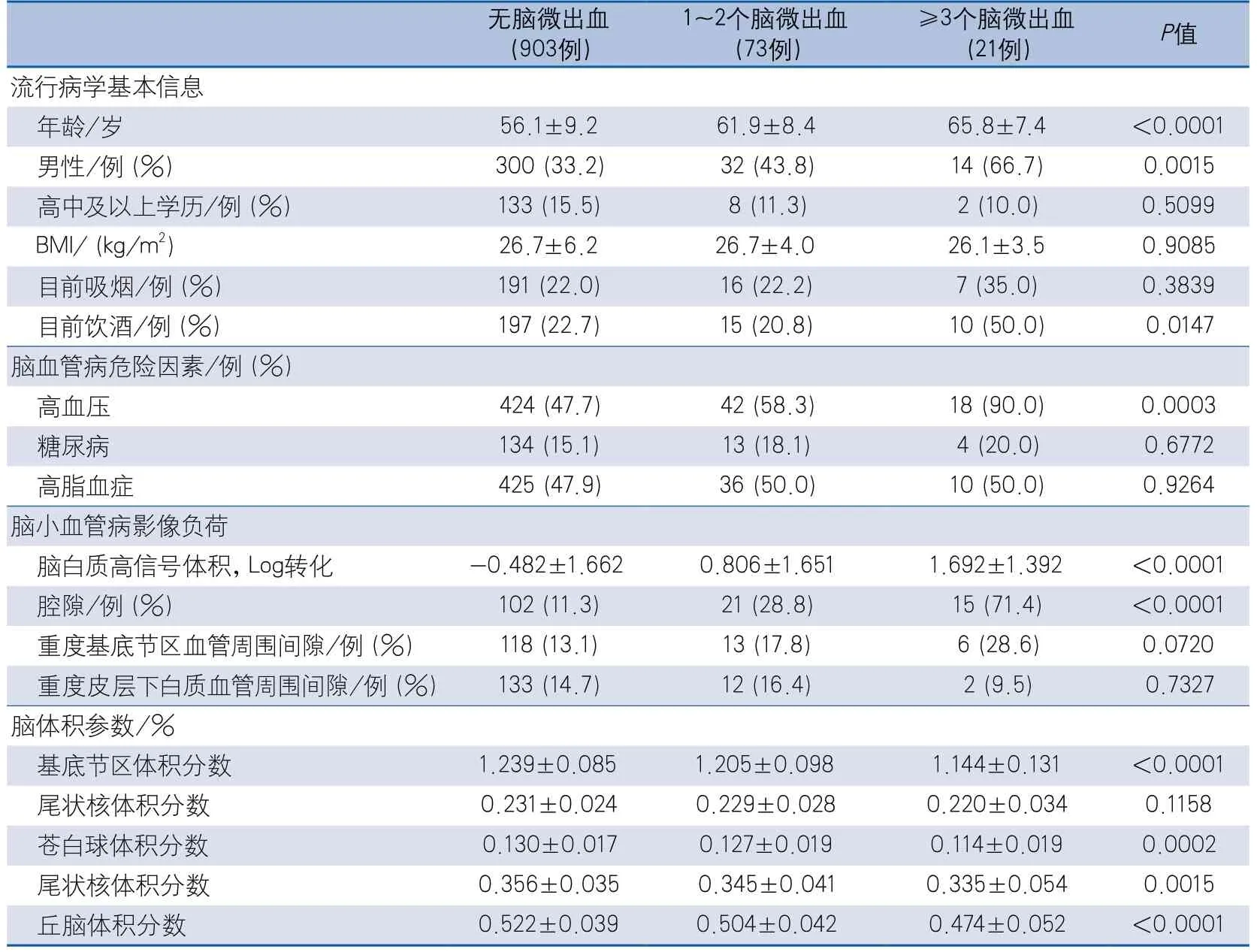
表2 基底节区核团体积在不同脑微出血负荷组的情况
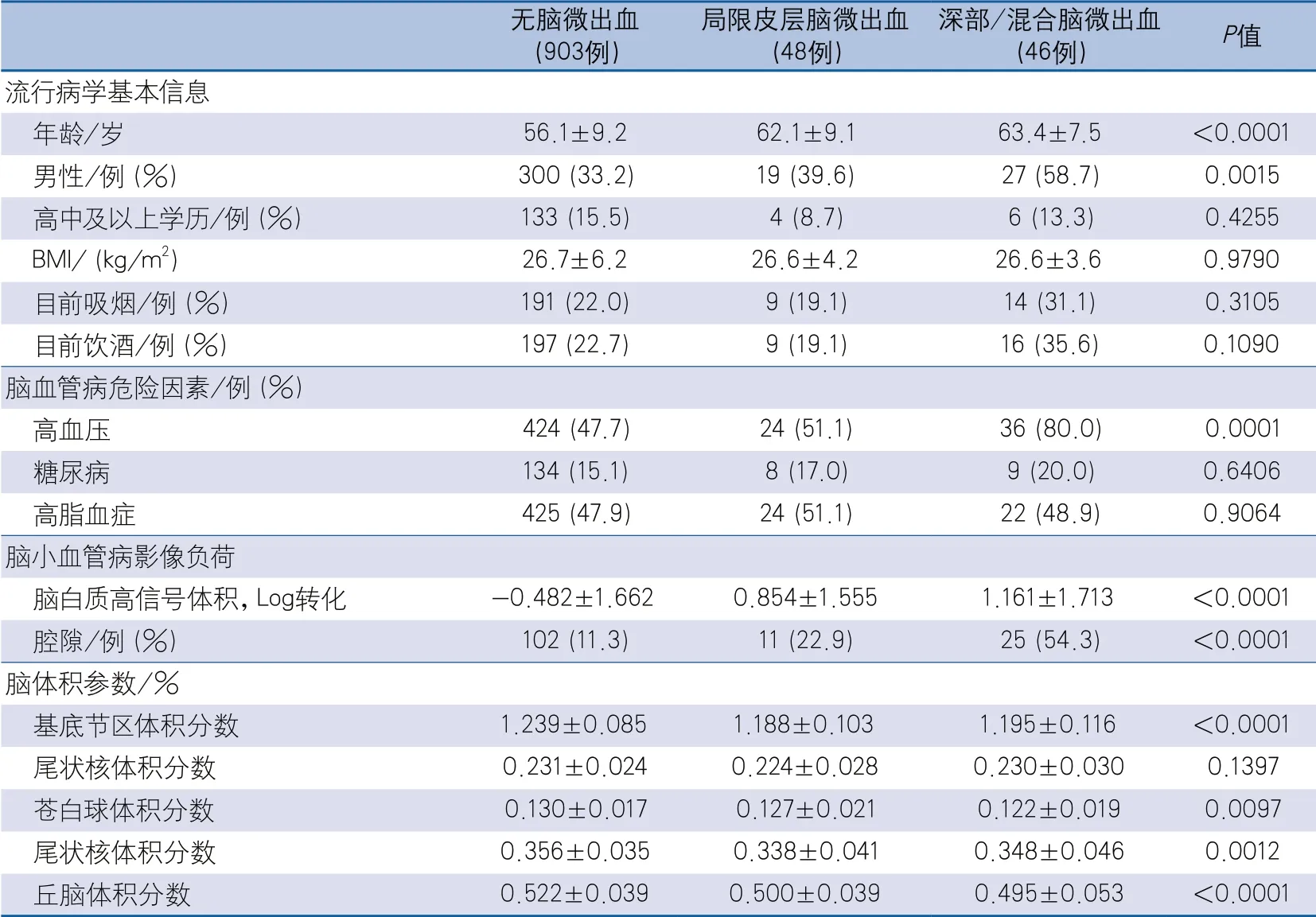
表3 基底节区核团体积在不同脑微出血分布组的情况

表4 多元线性模型分析脑微出血与基底节区核团体积的相关性
既往有研究探讨CMBs与脑萎缩的相关性,脑结构方面主要集中在皮层[12]、皮层下白质或海马等结构[13,24]。皮层CMBs被认为是脑血管淀粉样变与卒中、脑老化、痴呆和阿尔茨海默病之间的特殊联系,而深部CMBs被认为与高血压紧密相关[25]。顺义社区人群队列研究发现无论是局限皮层CMBs还是深部/混合CMBs,当CMBs负荷增高(≥3个),皮层下白质体积相对较小[13],该研究结果可通过既往阿尔茨海默病队列研究的发现来解释,即多发CMBs可能造成白质纤维束完整性破坏,进一步引起皮层下白质纤维束的萎缩和体积减小[24]。研究的另外一个发现是高负荷的深部CMBs,在高血压共同介导因素下,可同时引起海马神经元退化而造成海马萎缩[13]。因此,不同部位的CMBs及脑结构改变,可能意味着不同的病理生理机制参与其中,而临床结局也有所不同。
本研究发现较高负荷的深部/混合CMBs与苍白球体积呈现负相关。机制考虑以下几点:①脑深部CMBs与长期高血压相关。高血压作为大小血管病共同高危因素发挥作用。一方面,长期高血压导致小动脉纤维玻璃样变,从而继发影像学可视的深部CMBs;另一方面,苍白球血供来自脉络膜前动脉、大脑中动脉和大脑前动脉,其中大脑中动脉的穿支动脉提供了苍白球大部分的血液供应[26]。长期高血压可导致穿支动脉供血区低灌注,从而继发神经元供血不足而出现萎缩。②从神经功能角度来讲,基底节区核团主要参与四种神经功能环路,包括运动环路(涉及运动前区、辅助运动区、初级运动区)、动眼神经环路(涉及大脑皮层的额叶和辅助视野区)、执行关联环路以及情感环路(即边缘系统环路)[27]。基底节区存在广泛的联系纤维,其神经环路包括内部传入及传出通路。来自皮层的兴奋性传入信号传至新纹状体(尾状核、壳核)及丘脑底核,基底节区内部的抑制性传出信号主要由壳核传至苍白球,而又由苍白球传至丘脑及中脑脚间核。基底节区的神经核团如丘脑、壳核等,直接与皮层神经元形成广泛的联系,而苍白球的神经纤维联系相对局限。从神经纤维联系的角度讲,苍白球较其他基底节区核团更依赖局部的神经信息传递,其中包括信号及营养传递。作为出血性的影像学标志物,虽然CMBs对局部脑结构的破坏性不强,但深部CMBs继发的局部代谢改变,可能对神经元的代谢起到一定的负面影响,而苍白球比其他核团对局部微环境改变适应性更差。因此苍白球神经元可能较其他神经核团更易出现体积减小或萎缩改变。此外,既往研究显示社区居住人群的苍白球萎缩与步基增宽相关[16],本研究中苍白球体积减小可能参与步态障碍形成的病理生理过程。但苍白球体积减小是否介导了临床功能损伤,仍需进一步证实。
本研究具有一定的局限性。首先,本研究是一个横断面研究,推断因果关系具有局限性,需要长程研究验证本文的研究结论。其次,本研究的研究对象为社区人群,相关结论无法推广至症状性脑小血管病患者。本研究发现高负荷的深部/混合CMBs与较小的苍白球体积相关,需长程研究进一步证实基线的深部/混合CMBs与基底节区核团萎缩的相关性。
【点睛】本研究显示脑微出血负荷与深部灰质核团体积紧密相关,提示脑小血管病的出血性影像改变可能会加速或加重亚临床神经功能缺失。

