缺血性卒中相关性肺炎危险因素分析
孙悦,陈义彤,李星,张润华
卒中具有发病率高、死亡率高、致残率高的特点,其中缺血性卒中约占卒中的87%[1]。卒中相关性肺炎(stroke-associated pneumonia,SAP)是指非机械通气的卒中患者在发病7 d内新出现的肺炎[2]。国外流行病学调查显示,卒中相关性肺炎的发病率为7%~38%[3-4]。中国国家卒中登记中心的资料显示,缺血性卒中患者卒中相关性肺炎发病率达到11.4%[5]。肺炎不仅增加了患者医疗费用及住院时间,而且还是卒中患者预后不良甚至死亡的重要影响因素[6-7]。本文旨在分析卒中相关性肺炎的危险因素,从而为精准预防提供理论支持。
1 对象与方法
1.1 研究对象 本研究为横断面研究,对2014年5月-2016年5月在首都医科大学附属北京天坛医院神经内科连续住院治疗的缺血性卒中患者的临床资料进行分析。纳入标准:①年龄≥18岁;②符合《2010年中国急性缺血性脑卒中诊治指南》[8]中的缺血性卒中的诊断标准且经头颅CT和(或)MRI检查证实;③发病至住院时间≤7 d;④住院期间未进行机械通气治疗。排除标准:①其他类型卒中(脑出血、蛛网膜下腔出血、TIA);②入院后24 h出院或死亡;③病历资料不完整。
1.2 卒中相关性肺炎诊断标准 参照《卒中相关性肺炎诊治中国专家共识》[2],卒中发病7 d内出现以下情况诊断为卒中相关性肺炎:胸部影像学新出现或进展性肺部浸润病变,同时合并2个以上临床感染症状:①发热(体温≥38 ℃);②新出现的咳嗽、咳痰或原有呼吸道疾病症状加重,伴或不伴胸痛;③肺实变体征,和(或)湿啰音;④白细胞减少(≤4×109/L)或白细胞增多(≥10×109/L),伴或不伴核左移。另外,卒中相关肺炎的诊断还需除外肺部肿瘤、肺结核、肺间质性病变等其他非感染性肺部疾病。
1.3 资料收集及标准 收集患者的临床资料,包括:①人口学信息:年龄和性别。②卒中危险因素:高血压、糖尿病、高脂血症、心房颤动、冠心病、卒中史、吸烟及饮酒史。吸烟指一生中连续或累积吸烟6个月以上者,每天吸烟至少1支。饮酒分为不饮酒、适量饮酒、中-重度饮酒,其中适量饮酒指饮酒但<2个标准饮酒量/日;中-重度饮酒指≥2个标准饮酒量/日。1个标准饮酒量相当于120 mL葡萄酒、360 mL啤酒或45 mL白酒。③既往合并疾病:心力衰竭、心脏瓣膜病、慢性阻塞性肺疾病、周围动脉病、肝硬化、消化道溃疡、肾功能衰竭、关节炎和肿瘤。④药物治疗史:既往抗血小板药物和抗凝药物治疗史。⑤卒中前mRS评分,入院时NIHSS和GCS评分、血压和BMI。⑥入院首次实验室检查结果:白细胞计数、红细胞计数、血红蛋白、血小板计数、TC、TG、HDL-C、LDL-C、血糖、尿酸等。⑦患者发病至入院时间和住院天数。
1.4 数据分析 以患者是否发生卒中相关性肺炎分为卒中相关性肺炎组和无卒中相关性肺炎组,对两组的临床资料进行单因素和多因素分析,确定卒中相关性肺炎的独立影响因素;另外,按照性别、年龄(<50岁、50~59岁、60~69岁和≥70岁)和入院时NIHSS评分(<2分、2~4分、5~8分和>8分)进行分层,比较不同亚组卒中相关性肺炎的发生率及差异。
1.5 统计学方法 应用SPSS 17.0软件进行数据分析。连续变量符合正态分布用表示,不符合正态分布用M(P25~P75)表示;分类变量用例数(%)表示。单因素分析中,连续变量组间比较采用独立样本t检验或Mann-WhitneyU检验,分类变量采用χ2检验或Fisher精确检验。以单因素分析中P<0.2的变量作为自变量,以是否发生卒中相关性肺炎为因变量,采用后退法,进行多因素logistic回归,分析缺血性卒中患者发生卒中相关性肺炎的独立影响因素,效应值采用OR和95%CI表示。按照性别、年龄和入院时NIHSS评分分层计算卒中相关性肺炎的发生率,采用χ2检验比较不同性别的卒中相关性肺炎的发生率,采用Cochran-Armitage趋势性检验,分析卒中相关性肺炎发生率随年龄、入院时NIHSS评分增加的变化趋势。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 研究共纳入1129例AIS患者,年龄18~89岁,平均58.7±12.5岁,男性899例(79.6%),女性230例(20.4%),86例(7.6%)患者发生卒中相关性肺炎,1043例(92.4%)患者无卒中相关性肺炎。
卒中相关性肺炎组平均年龄、合并心房颤动及肾功能衰竭的患者比例、入院NIHSS评分、白细胞计数、TC、LDL-C、HDL-C、血糖、住院时间等均高于无卒中相关性肺炎组,吸烟患者的比例、入院时GCS评分、TG水平、尿酸、发病至入院时间低于无卒中相关性肺炎组,差异均有统计学意义;其余变量在两组间差异无统计学意义(表1)。
2.2 不同分层卒中相关性肺炎发病率及时间趋势 按性别分层,男性卒中相关性肺炎的发生率为7.2%(65/899),女性发生率为9.1%(21/230),差异无统计学意义(P=0.3324);按年龄分层,<50岁卒中相关性肺炎发生率为1.8%(4/223),50~59岁发生率为6.5%(24/370),60~69岁发生率为7.1%(23/323),≥70岁发生率为16.4%(35/213),卒中相关性肺炎发生率随着年龄的增加而增加(趋势性P<0.0001);按NIHSS分层,入院NIHSS<2分患者的卒中相关性肺炎发生率为1.8%(7/388),2~4分患者的发生率为2.4%(6/252),5~8分患者的发生率为3.6%(8/222),>8分患者的发生率为24.3%(65/267),随着NIHSS评分的增加,卒中相关性肺炎的发生率增加(趋势性P<0.0001)。
对卒中相关性肺炎的发生时间进行分析,卒中发病至卒中相关性肺炎确诊的中位时间为4(2~7)d,累计50%发病时间范围为0~3 d。
2.3 卒中相关性肺炎的多因素分析 多因素分析显示,年龄增高、入院NIHSS评分增加、白细胞计数升高及住院天数延长为卒中相关性肺炎的独立危险因素(表2)。
3 讨论
本研究显示卒中相关性肺炎在住院治疗的缺血性卒中患者中发生率为7.6%,年龄增高、入院NIHSS评分增加,白细胞计数升高及住院天数延长是卒中相关性肺炎的独立危险因素。
既往文献报道,患者的年龄每增长1岁,卒中相关性肺炎发生率增加2%[9]。研究者认为高龄卒中患者脏器功能下降,抵抗力下降,同时吞咽能力下降,增加误吸风险;另外高龄患者咳嗽能力减弱,呼吸道分泌物及异物排出困难,易引发感染。上述因素都可能增加高龄患者卒中相关性肺炎的风险。本研究对不同年龄段患者卒中相关性肺炎的发生率进行统计后发现,<50岁、50~59岁、60~69岁和≥70岁年龄段卒中相关性肺炎的发生率分别为1.8%、6.5%、7.1%和16.4%,随着年龄的增加,卒中相关性肺炎的风险呈显著增高趋势(P<0.0001),结果支持既往研究的结论。
关于缺血性卒中后神经功能损伤程度与卒中相关性肺炎的关系,有研究发现,发病时NIHSS评分越高,患者发生卒中相关性肺炎的风险越高[10]。NIHSS评分高提示患者肢体瘫痪更重,卧床时间延长,易发生坠积性肺部感染,导致卒中相关性肺炎发生率增高。本研究按NIHSS进行分层统计,NIHSS<2分、2~4分、5~8分和>8分亚组卒中相关性肺炎发生率分别为1.8%、2.4%、3.6%和24.3%,趋势分析显示,随着NIHSS升高,患者卒中相关性肺炎的风险显著上升(P<0.0001),与既往研究结果相似。
本研究中,入院时无卒中相关性肺炎组平均白细胞计数在正常范围内,但卒中相关性肺炎组的平均白细胞计数已经出现升高[(10.9±4.1)×109/L],提示这部分患者在入院时可能已经有感染的表现。曾庆宏等[11]的研究也显示白细胞计数增高是卒中相关性肺炎发生的独立危险因素,与本研究的多因素分析结果一致。
卒中相关性肺炎确诊时间的研究少见报道。卒中相关性肺炎的发病机制为意识障碍、吞咽功能障碍引起的误吸以及卒中引起的免疫抑制等[12-13]。约有34%~64%的早期缺血性卒中患者出现吞咽功能障碍[14],提示缺血性卒中患者发病后早期发生肺炎的风险即开始上升。本研究显示缺血性卒中发病至肺炎确诊中位时间为4 d,累计50%发病时间范围为0~3 d。结合卒中相关性肺炎组入院白细胞计数已经明显升高,提示缺血性卒中患者发病4 d内是卒中相关性肺炎的高发时间段。因此,对缺血性卒中患者进行早期肺炎危险因素评估,进而制订针对性的治疗和护理方案,具有重要的临床意义。
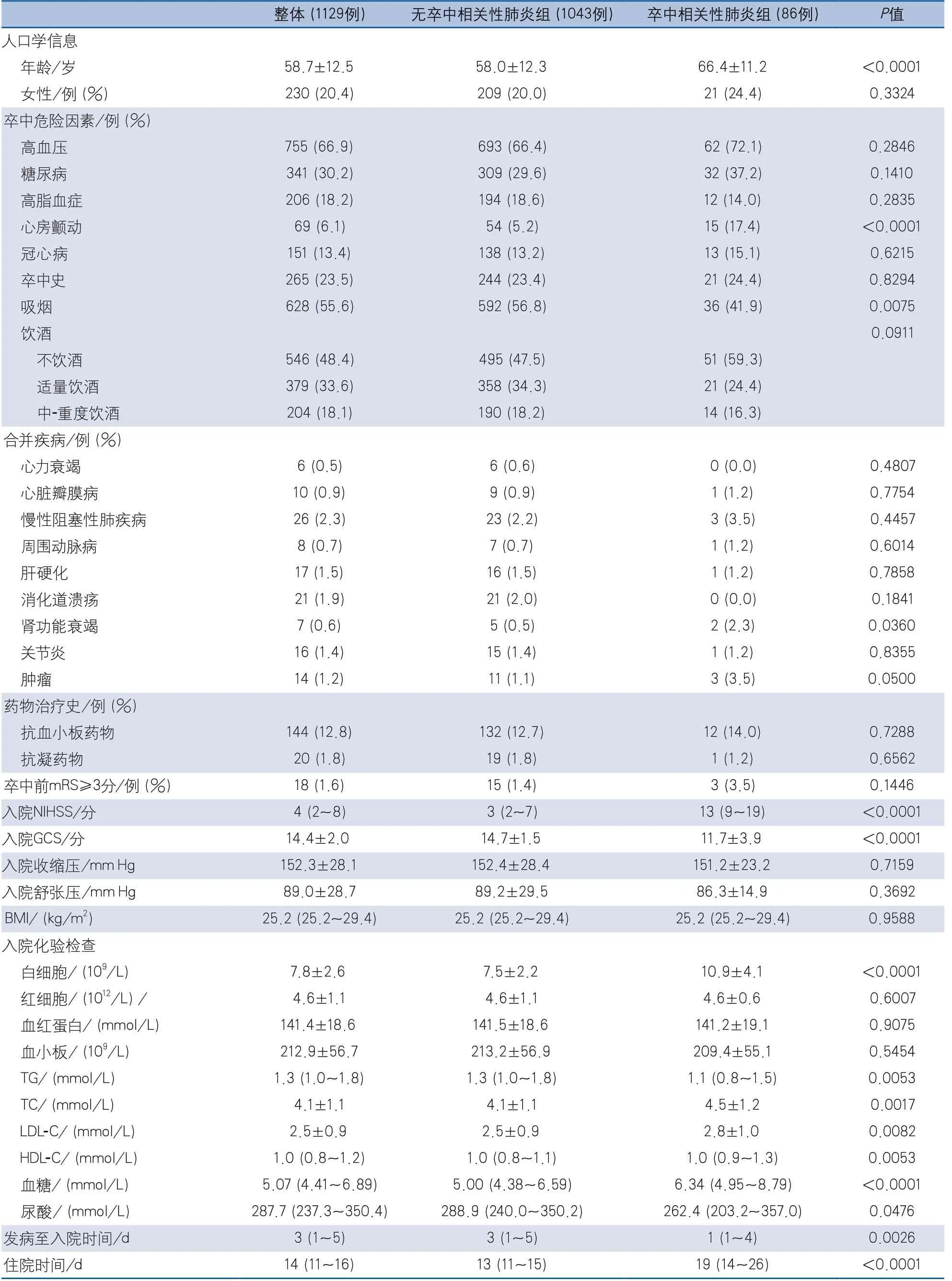
表1 卒中相关性肺炎单因素分析
本研究为横断面研究,对连续的住院患者进行数据分析,样本量较大,因此结果具有一定的代表性。卒中相关性肺炎的风险也同时受医院对卒中患者临床治疗的规范性的影响,如本研究的中心常规对卒中患者进行入院后早期的吞咽功能筛查并针对吞咽障碍的患者进行治疗和干预,这些管理和诊疗措施均可能影响卒中相关性肺炎的发生率,因此本研究作为在单中心展开的调查分析,结果可能具有一定的偏倚。不过基于本研究的结果数据,提示临床医师应该对高龄、神经功能缺损严重、入院时白细胞计数增高的患者进行更严格的预防肺炎的管理,以降低这部分患者卒中相关性肺炎发生的风险。
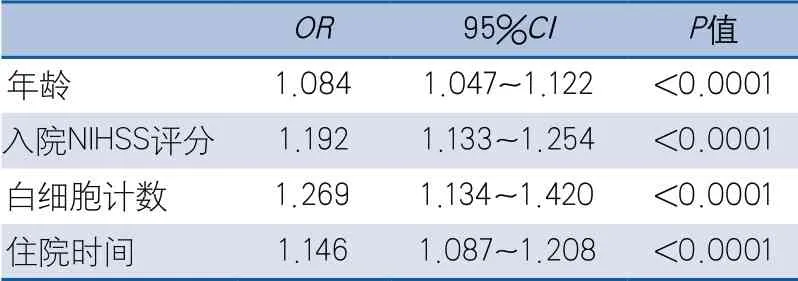
表2 卒中相关性肺炎影响因素的多元logistic回归分析
【点睛】本研究对1129例急性缺血性卒中患者进行了卒中相关性肺炎的发生率和影响因素的横断面调查,发现缺血性卒中后卒中相关性肺炎的发生与高龄、神经功能缺损程度重、白细胞增高、住院时间长有关。

