地西他滨联合CAG治疗TET2阳性老年急性髓细胞白血病的疗效观察
蔡嘉惠 谭健锋 翟晓 吴秉毅 董瑞红
【摘要】 目的:研究地西他滨联合CAG(盐酸阿柔比星+阿糖胞苷+粒细胞集落刺激因子)治疗TET2阳性老年急性髓细胞白血病(acute myelocytic leukemia,AML)的效果。方法:选取2013年1月-
2020年9月本院收治的46例TET2阳性老年AML患者,其中2013年1月-2018年1月TET2阳性老年AML患者23例为对照组实行CAG方案,2018年6月-2020年9月TET2阳性老年AML患者23例为观察组实行地西他滨+CAG方案,比较两组疗效。结果:用药后,两组CD3+、CD4+及CD4+/CD8+指标均降低,且观察组均低于对照组,差异均有统计学意义(P<0.05)。观察组总有效率较对照组更高,差异有统计学意义(P<0.05)。两组白细胞恢复时间、血小板输注量比较,差异均无统计学意义(P>0.05)。两组各项不良反应率比较,差异均无统计学意义(P>0.05)。结论:地西他滨联合CAG方案治疗TET2阳性老年AML患者能提高疗效,不会增加不良反应,值得推广。
【关键词】 地西他滨 CAG方案 TET2阳性 急性髓细胞白血病 细胞免疫
Effect of Decitabine Combined with CAG on TET2 Positive Senile Acute Myeloid Leukemia/CAI Jiahui, TAN Jianfeng, ZHAI Xiao, WU Bingyi, DONG Ruihong. //Medical Innovation of China, 2021, 18(07): 0-080
[Abstract] Objective: To study effect of Decitabine combined with CAG (Arubicin Hydrochloride+Cytara Bine+granulocyte colony stimulating factor) on TET2 positive senile acute myeloid leukemia (AML). Method: A total of 46 elderly patients with TET2 positive AML admitted to our hospital from January 2013 to September 2020 were selected. Among them, 23 elderly patients with TET2 positive AML from January 2013 to January 2018 were treated with CAG scheme in the control group, and 23 elderly patients with TET2 positive AML from June 2018 to September 2020 were treated with Decitabine+CAG scheme in the observation group. The efficacy of the two groups was compared. Result: After treatment, CD3+, CD4+ and CD4+/CD8+ indexes were decreased in both groups, and the observation group of those were lower than those in the control group, the differences were statistically significant (P<0.05). The total effective rate of the observation group was higher than that of the control group, the difference was statistically significant (P<0.05). There were no significant differences in WBC recovery time and platelet infusion volume between the two groups (P>0.05). There was no statistical significance in adverse reaction rates between the two groups (P>0.05). Conclusion: Decitabine+CAG regimen in the treatment of TET2 positive elderly AML patients can improve the efficacy, cant increase adverse reactions, which is worthy of praise.
[Key words] Decitabine CAG regimen TET2 positive Acute myeloid leukemia Cellular immunity
First-authors address: Shunde Hospital of Southern Medical University (The First Peoples Hospital of Shunde), Foshan 528308, China
doi:10.3969/j.issn.1674-4985.2021.07.019
研究表明,臨床常见的急性髓细胞白血病(acute myeloid leukemia,AML),属于高度异质的血液系统恶性肿瘤[1],在老年群体较常见,分析原因与自身免疫状态差、脏器功能衰弱等因素有关,患病后典型特征为骨髓中原始细胞异常增生,对正常造血产生抑制,可对肝、脾或淋巴结等脏器造成侵犯,表现为贫血、出血、感染及髓外浸润等症状[2-3],分析患者病理机制发现,此病多与遗传、环境及异常DNA甲基化有关。有研究显示,TET2基因在老年AML群体中突变率相对较高,突变率为10%~17%,若AML患者合并TET2阳性,提示预后不佳[4]。因此结合基因结果选择合适的治疗方案是关键,对降低病死率、改善预后有积极作用。刘晓等[5]证实,异基因造血干细胞移植术是根治AML的方法,但老年群体体质较差,无法耐受异基因造血干细胞移植术,临床上多采用化疗控制疾病,CAG方案为老年AML患者的常用方案,可达到一定的疗效,缓解患者症状,提高生活质量,但总体有效率不算高,且短期内易出现疾病复发,效果不理想[6-7]。鉴于此,本文选取2018年6月-2020年9月本院23例TET2阳性老年AML患者为研究对象,分析联合化疗的价值,现报道如下。
1 资料与方法
1.1 一般资料 研究样本采集本院2013年
1月-2020年9月收治的46例TET2阳性老年AML患者资料。(1)纳入标准:①根据《血液病诊断及疗效标准》[8],经血常规、骨髓形态学、免疫分型、染色体及AML相关预后基因确诊为TET2阳性AML;②年龄≥50岁;③资料完整。(2)排除标准:①伴严重肺部感染、全身感染;②伴严重器质性疾病、内分泌系统疾病;③营养不良或过敏体质;④严重精神障碍;⑤用药禁忌;⑥中途退出研究。其中2013年1月-2018年1月TET2阳性老年AML患者23例为对照组实行CAG方案,2018年
6月-2020年9月TET2阳性老年AML患者23例为观察组实行地西他滨+CAG方案,所有患者及家属对研究内容知情并签署知情同意书,研究经医院伦理委员会审批同意。
1.2 方法 (1)对照组采用CAG方案:治疗第1~5天静脉注射盐酸阿柔比星(生产厂家:深圳万乐药业有限公司,批准文号:国药准字H10910092,规格:20 mg/瓶),20 mg/d;阿糖胞苷(生产厂家:国药一心制药有限公司,批准文号:国药准字H20055127,规格:100 mg/瓶)皮下注射10 mg/m2,2次/d,持续治疗14 d;重组人粒细胞集落刺激因子(G-CSF,生产厂家:北海集琦方舟基因药业有限公司,批准文号:国药准字S19990028,规格:150 μg/支),皮下注射200 μg/(m2·d),持续治疗14 d,治疗过程中严密监测患者症状体征及相关指标,若白细胞计数>20×109/L,暂停使用G-CSF。(2)观察组CAG方案同对照组,联合地西他滨(生产厂家:江苏豪森医药集团连云港宏创医药有限公司,批准文号:国药准字H20130092,规格:10 mg/瓶),治疗第1~5天予以静脉滴注,10 mg/d,用药期间做好护胃、护肝等对症治疗,根据血常规结果输注血制品支持治疗。两组每个疗程均为14 d,骨髓恢复后给予第2疗程化疗,连续用药2个疗程。
1.3 观察指标与判定标准 (1)细胞免疫:采集患者空腹时3 mL静脉血,离心后使用全自动流式细胞分析仪(Beckman Coul-ter Epics XL)检测CD3+、CD4+、CD8+,计算CD4+/CD8+,美国Beckman公司提供免疫荧光抗体,严格按试剂说明操作[9-10]。(2)临床疗效参考《血液病诊断及疗效标准》(第4版),完全缓解(CR):①临床无白血病细胞浸润的症状和体征;②血象:血红蛋白≥100 g/L(男性)或≥90 g/L(女性),中性粒细胞绝对值≥1.5×109/L,血小板≥100×109/L,外周血无白血病细胞;③骨髓中原始细胞≤5%。部分缓解(PR):5%骨髓中原始细胞≤20%,或临床、血象中有一项未达到CR标准[11-12]。未缓解(NR):骨髓象、血象及临床表现未达上述标准。总有效率=(CR例数+PR例数)/总例数×100%。(3)临床指标:测评白细胞恢复时间、血小板输注量。(4)不良反应发生情况:统计Ⅳ度骨髓抑制、肝功能损害与继发感染的例数。
1.4 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料以(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 观察组男14例,女9例;年龄50~75岁,平均(61.53±8.25)岁;合并前驱骨髓增生异常综合征(MDS)病史5例,无MDS病史18例;FAB分型:M2、M4、M5型分别为12、2、9例;文化程度:初中及以下9例,高中9例,大专及以上5例。对照组男13例,女10例;年龄52~73岁,平均(62.93±7.78)岁;合并前驱MDS病史6例,无MDS病史17例;FAB分型:M2、M4、M5型分别为14、1、8例;文化程度:初中及以下8例,高中8例,大专及以上7例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
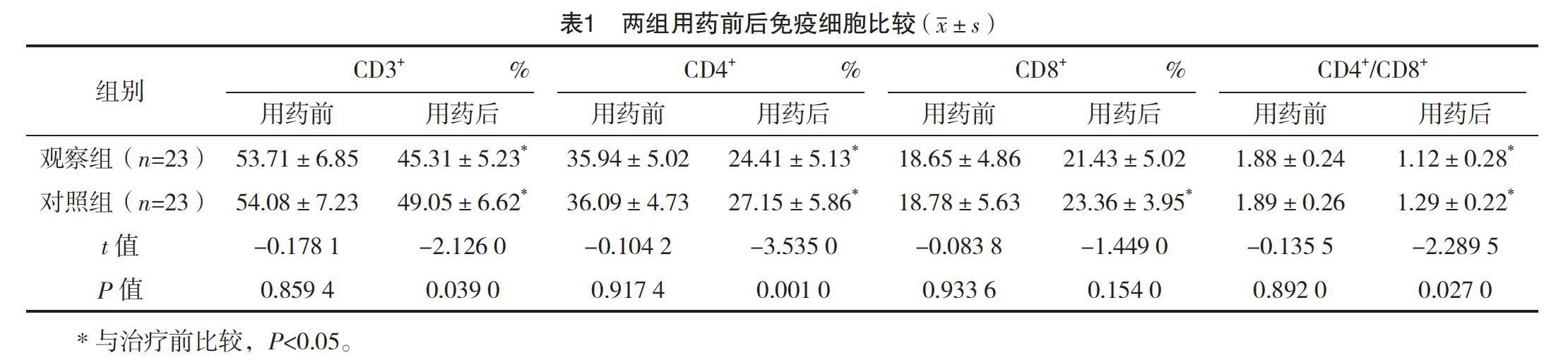
2.2 两组用药前后免疫细胞比较 用药前,兩组免疫细胞比较,差异均无统计学意义(P>0.05);用药后,两组CD3+、CD4+及CD4+/CD8+指标均降低,且观察组均低于对照组,差异均有统计学意义(P<0.05);观察组CD8+用药后较用药前提升,但差异无统计学意义(P>0.05);用药后两组CD8+比较,差异无统计学意义(P>0.05)。见表1。
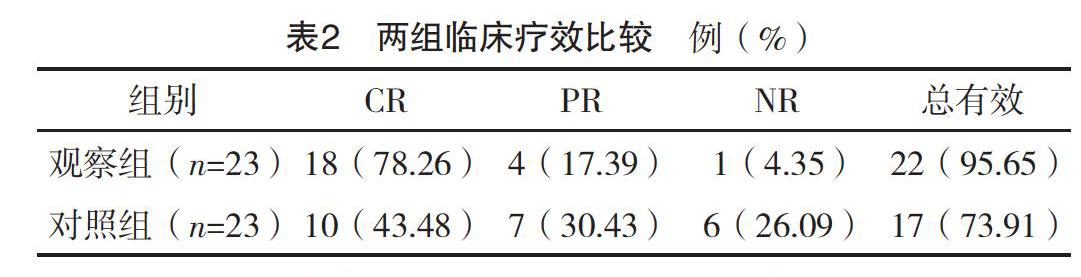
2.3 两组临床疗效比较 观察组总有效率较对照组更高,差异有统计学意义(字2=4.212 5,P=0.040 1),见表2。
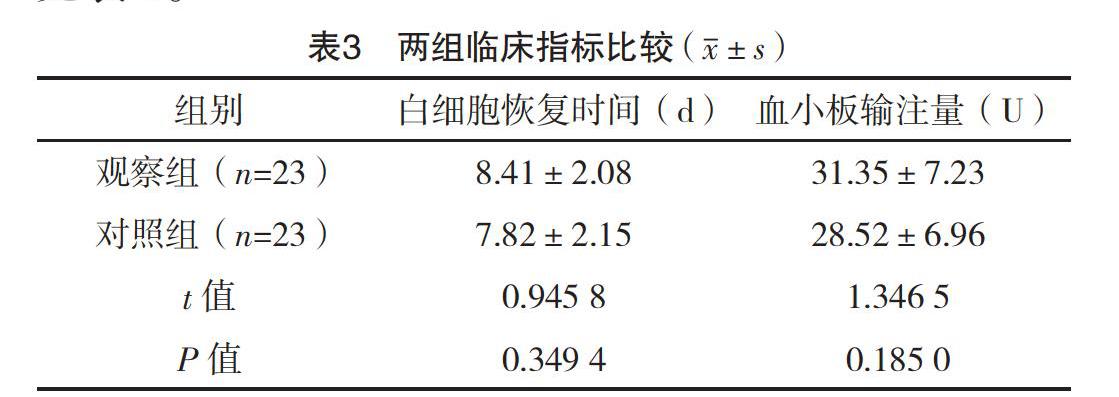
2.4 两组临床指标比较 两组白细胞恢复时间、血小板输注量比较,差异均无统计学意义(P>0.05),见表3。
2.5 两组不良反应发生情况比较 两组各项不良反应率比较,差异均无统计学意义(P>0.05),见表4。
3 讨论
有研究报道,CAG方案+地西他滨治疗老年AML患者能提高疗效,分析发现:(1)CAG方案中,G-CSF药物结合受体后,可促使细胞从G0期向S期转变,使幼稚细胞对化疗药敏感度增加,增强药物杀伤白血病细胞的能力,同时促进粒细胞成熟、释放,使患者骨髓抑制时间缩短,保证用药安全[13];阿糖胞苷为细胞周期特异性药物,对处于S期增殖期细胞的作用最敏感,可通过抑制细胞DNA的合成,干扰细胞的增殖;而阿柔比星(阿克拉霉素)属于常用的抗肿瘤药物,其亲脂性较强,以磷脂双分子层为特点,到达肿瘤细胞核内发挥作用,对肿瘤细胞DNA转录、复制产生阻碍,避免肿瘤细胞增殖。上述3种药物可相辅相成,发挥强效抗肿瘤机制、达到疾病缓解,但CAG方案治疗老年AML患者总体有效率不高,且短期内易出现疾病复发,效果不够理想[14-15]。(2)地西他滨是2-脱氧胞苷酸的腺苷类似物,去甲基化作用明显,分析作用机制为:此药可阻碍肿瘤DNA甲基转移酶活性,快速改善细胞抑癌基因的过渡甲基化,逆转DNA的甲基化过程[16-17],达到治疗肿瘤的效果,且重新启动细胞的正常衰老凋亡系统,对癌细胞增殖产生抑制,将失活的抑癌基因激活、发挥抗肿瘤机制,还能避免耐药性出现;还可抑制肿瘤细胞合成DNA、抑制肿瘤生长,因此联合治疗能发挥协同作用,进一步促进白血病细胞凋亡,临床应用效果更佳[18-19]。
本研究结果显示:用药前,两组免疫细胞比较,差异均无统计学意义(P>0.05);用药后与对照组比较,观察组CD3+、CD4+及CD4+/CD8+指标降低更明显(P<0.05),表示化疗药物在杀伤白血病细胞的同时,也会损伤免疫细胞、造成机体免疫功能降低,但在单用CAG方案的基础上,联合用药并未抑制免疫功能,说明联合用药具有可行性及可靠性。观察组的总有效率为95.65%高于对照组的73.91%(P<0.05),表示联合治疗能增强疗效,控制疾病进展。两组白细胞恢复时间、血小板输注量比较,差异均无统计学意义(P>0.05),表示联合地西他滨治疗并无加重骨髓抑制程度或增加患者负担。两组各项不良反应率比较,差异均无统计学意义(P>0.05),结论与刘静等[20]研究相似,因此联合治疗可保证用药安全,改善患者预后,具实践价值。
综上所述,地西他滨联合CAG治疗TET2阳性老年AML患者能提高有效率,且不良反应较轻,可在临床推广应用。
参考文献
[1]孙富英,李志春,纪国超.地西他滨联合CAG方案治疗老年急性髓系白血病患者疗效及预后的影响观察[J].医药论坛杂志,2019,40(10):146-148.
[2]顾丽丽,何涛.地西他滨联合CAG方案治疗老年急性髓系白血病的疗效观察[J].中国医院用药评价与分析,2018,18(5):613-615.
[3]孫令凤,陈晓霞,王娟.地西他滨联合CAG方案治疗老年急性髓系白血病疗效观察[J].海南医学,2017,28(18):3037-3039.
[4]王秀梅,王淋.地西他滨治疗老年急性髓系白血病的疗效观察及安全性分析[J].中国临床医生杂志,2017,45(10):62-64.
[5]刘晓,秦兰,李巍,等.CAG方案联合地西他滨治疗老年急性髓系白血病40例应用分析[J].肿瘤学杂志,2017,23(2):150-153.
[6]陈雪瑜.地西他滨联合CAG方案治疗老年急性髓系白血病的效果及对患者免疫功能的影响[J].中国老年学杂志,2017,37(14):3500-3502.
[7]何继祥,姜义荣,黄振华,等.地西他滨联合半量CAG方案治疗老年急性髓系白血病的疗效观察[J].热带医学杂志,2019,19(7):871-874.
[8]沈悌,赵永强.血液病诊断及疗效标准[M].4版.北京:科学出版社,2018.
[9]龚辉,陈姣.地西他滨联合半量CAG方案治疗骨髓增生异常综合征-伴原始细胞增多和急性髓细胞白血病的疗效分析[J].内科急危重症杂志,2019,25(3):206-209.
[10]范玉芳,郑翠苹.DCAG方案治疗复发难治性急性髓系白血病的效果与预后影响因素分析[J].广东医学,2020,41(1):34-38.
[11]陆小云,徐瑞琴.地西他滨联合CAG方案治疗老年急性髓系白血病的临床效果分析[J].临床血液学杂志,2017,30(9):697-700.
[12]陈亨,蒋元强,沈云峰,等.地西他滨联合小剂量HAG在老年急性髓系白血病患者中的应用[J].中国肿瘤临床与康复,2017,24(9):1074-1077.
[13]申晗.地西他滨联合CAG方案对老年急性髓系白血病患者疗效及不良反应的影响[J].医药论坛杂志,2018,39(11):58-59.
[14]谢春红,韦敏,刘琴,等.地西他滨联合CAG方案治疗老年急性髓系白血病的Meta分析[J].检验医学与临床,2019,16(22):3284-3288.
[15]刘林,黄小丽,王三斌,等.低剂量地西他滨、高三尖杉酯碱联合CAG方案治疗急性髓系白血病的临床效果[J].白血病·淋巴瘤,2019,28(8):479-484.
[16]宋岭,曹波,安博文,等.地西他滨联合CAG方案对老年急性髓系白血病患者的有效性及安全性分析[J].实用癌症杂志,2019,34(5):840-842.
[17]潘鹏吉,罗章琴.小剂量HAG及地西他滨联合方案治疗老年AML患者疗效的研究[J].中国实验血液学杂志,2020,28(3):828-832.
[18]白雪,肖霞,赵明峰,等.CAG及CAG联合地西他滨化疗方案治疗老年急性髓系白血病的疗效比较[J].临床荟萃,2018,33(3):240-243.
[19]杨昆,马春蓉,何旭,等.低剂量地西他滨联合半量CAG治疗老年急性髓系白血病的临床研究[J].成都医学院学报,2019,14(1):103-106.
[20]刘静,贾晋松,宫立众,等.地西他滨联合半量CAG方案治疗骨髓增生异常综合征伴原始细胞增多和急性髓系白血病伴骨髓增生异常相关改变[J].中华血液学杂志,2018,39(9):734-738.
(收稿日期:2020-12-25) (本文编辑:刘蓉艳)

