α-氯醛糖和右美托咪定对貂的口服麻醉效果观察
张海洋,翁晨曦,赵振宇,吴东霖,刘涛,冯国峰,马海鹍,范宏刚
(东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
在临床诊疗过程中,动物的麻醉方式主要以吸入和注射麻醉为主[1-2],但对于貂、狐和貉这类经济动物而言,较为实际的麻醉方式为注射麻醉[3]。近年来,随着经济动物人工饲养量不断增加,相应的临床诊疗、电采精及长途运输等工作也逐渐增多,其中多数现场操作需要安全确实的麻醉保障,这不仅关系着人畜安全,还关系到动物福利[4]。口服麻醉技术与其他麻醉技术相比,具有操作便捷、可不接触动物的情况下对其实施化学保定,有效保证麻醉人员的安全。此外,在畜禽长途运输、繁殖育种以及野外动物抓捕等过程中口服麻醉技术也具有明显的优越性。α-氯醛糖曾是一种主要用于实验动物的全身麻醉药物,多被用于制药企业、药物研发机构等猫降压试验中的化学制动。本课题组在前期试验中发现,犬、狐和狼等动物口服α-氯醛糖后可产生一定深度的镇静和全身麻醉作用,且在服药过程中无明显的毒副作用[5]。以此基础上,本试验将α-氯醛糖与右美托咪定进行复合对貂实施口服麻醉,观察2种药物复合后对貂的主要生理指标和生物反射活动的影响,以及麻醉时期、镇静、镇痛及肌松等作用效果,为进一步开展麻醉安全性研究提供试验依据。
1 材料与方法
1.1 试验动物
选取健康成年咖啡貂10只,8~10月龄,体重1.2~1.4 kg,雄性,由黑龙江省佳木斯市某貂养殖基地提供。单舍规范饲养14 d后,仔细观察貂无异常情况时,可进行下一步正式试验研究,本课题设计和试验内容均得到东北农业大学实验动物伦理委员会同意并批准。
1.2 麻醉药品和配制
α-氯醛糖原粉,购于德国Sigma公司,纯度99.9%;右美托咪定标准品,购于上海延慕实业有限公司,纯度99.8%。将右美托咪定用注射用水溶解成2 mg/mL的浓度;将α-氯醛糖通过1,2丙二醇溶解成160 mg/mL的浓度。将两者过滤灭菌,避光、低温保存,备用。
1.3 麻醉试验
试验前对貂禁食12 h,禁水6 h,并尽量减少与试验无关的应激刺激。在本课题组前期研究[5]以及预试验的基础上,本研究中α-氯醛糖和右美托咪定的剂量分别定为320 mg/kg和1 mg/kg。试验开始时将已配制的α-氯醛糖和右美托咪定溶液分别按照320 mg/kg和1 mg/kg的剂量均匀混拌于日常半流体饲料中供貂自由采食,每貂1份,采食完毕后每间隔10 min监测1次,一直监测至60 min(这时个别貂有苏醒迹象,出现体动现象),在麻醉的过程中还应对貂的嘴部和四肢进行简单确实的物理保定,防止试验过程中发生人畜伤害和设备损毁。主要的监测项目主要包括:体温(T)、呼吸频率(RR)、心率(HR)和脉搏血氧饱和度(SpO2)等,除RR进行人工测取外,其他项目由监护仪器实施监测[5]。同时监测的项目还有麻醉时期(使用电子计时器)、作用效果和生物反射活动等,具体方法见表1、2和3。
1.4 数据统计与分析
采用Microsoft Excel 2018整理试验数据,并采用SPSS 23.0进行数据的分析和处理,数据以“平均值±标准差”,采用单因素分析、post Hoc Tests多重比较检验LSD和S-N-K法,P<0.05为差异显著。

表1 麻醉时期的监测方法

表2 镇静、镇痛及肌松效果评分标准[5]
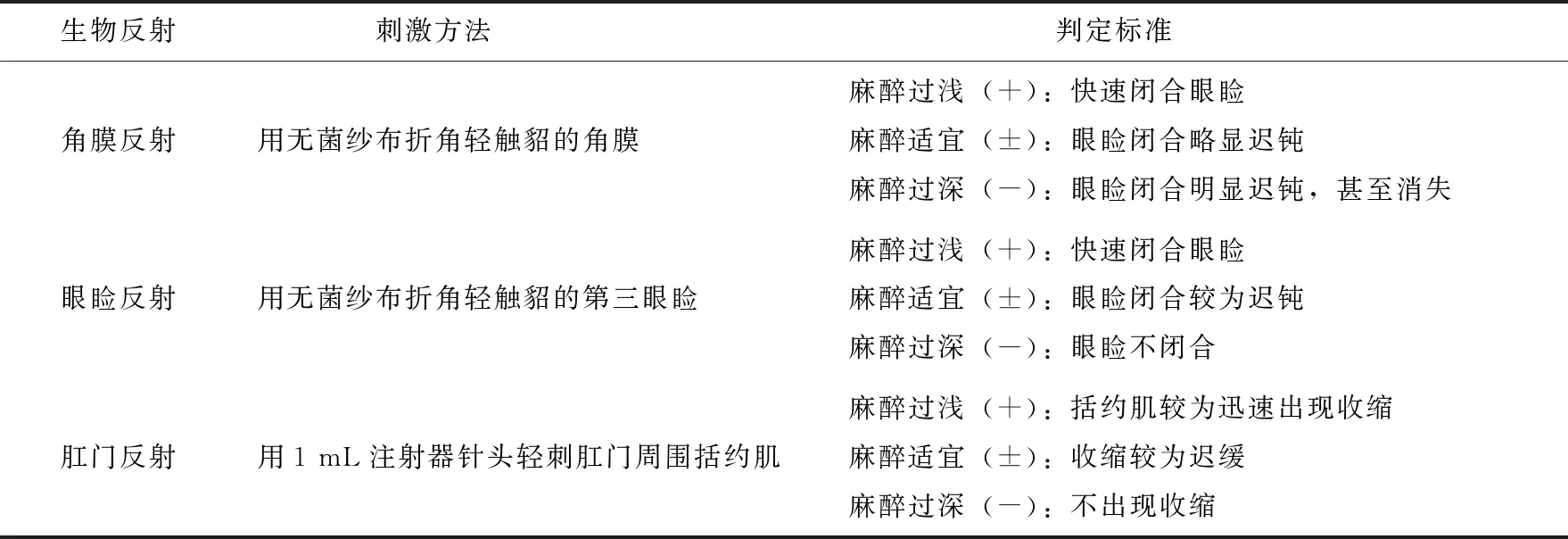
表3 生物反射判定标准
2 结果与分析
2.1 主要生理指标的监测
在口服药物后貂体温显著降低(P<0.05或P<0.01),监测结束时体温降至最低值,与采食前比较下降了1.4 ℃;貂采食完毕后呼吸频率逐渐降低,在采食完毕后50 min时降至最低(P<0.05),与采食前比较降低了18.7%,之后逐渐恢复;采食后心率的变化趋势与呼吸频率相似,最低值也是出现于采食完毕后50 min(P<0.05),与采食后10 min比较降低了24.6%,之后逐渐恢复;脉搏血氧饱和度呈现先降低后升高的变化趋势,最低值(95%)出现在采食完毕后30 min,具体结果见表4。

表4 麻醉作用效果的监测结果(n=10)
2.2 麻醉时期的监测
貂在口服药物后均表现出活动减少、反应迟钝、行动迟缓,随后共济失调的现象较为明显,之后无法保持站立状态,趴卧在地,翻正反射消失,在诱导过程中流涎、呕吐且无异常兴奋现象,诱导期最短时间为5.6 min,平均为(9.1±2.0)min。在麻醉维持期间,貂表现为意识消失、可平稳仰卧、全身松弛等现象,维持时间最短为67.9 min,最长为79.4 min,平均为(71.7±4.1)min。苏醒期较为平稳,在苏醒期未出现复睡及其他神经系统异常现象,平均苏醒时间为(38.2±4.5)min。对监测结果综合分析发现,该复合口服麻醉方式诱导迅速,维持时间适宜,苏醒较为平稳。具体结果见表5。

表5 麻醉时间监测结果(n=10) min
2.3 麻醉作用效果的监测
试验结果表明(见表6),貂口服药物10 min后镇静和肌松效果较为良好,而镇痛效果也在20 min时进入良好状态,之后这种良好且均衡的麻醉效果持续约30 min。之后,镇静、肌松和镇痛效果均开始减弱,其中镇痛效果消失的较为迅速。
2.4 对生物反射活动的监测
采食后10 min时,50%的貂角膜和眼睑反射出现迟钝的现象,90%的貂肛门反射反应迟钝,在20~50 min时间段,从整体上看3种生物反射受到了明显的抑制作用,产生的麻醉深度较为适宜,从60 min开始这3种生物反射开始出现不同程度恢复,相对而言,角膜反射恢复情况更为明显。具体试验结果见表7。

表6 麻醉作用效果的评分(n=10)
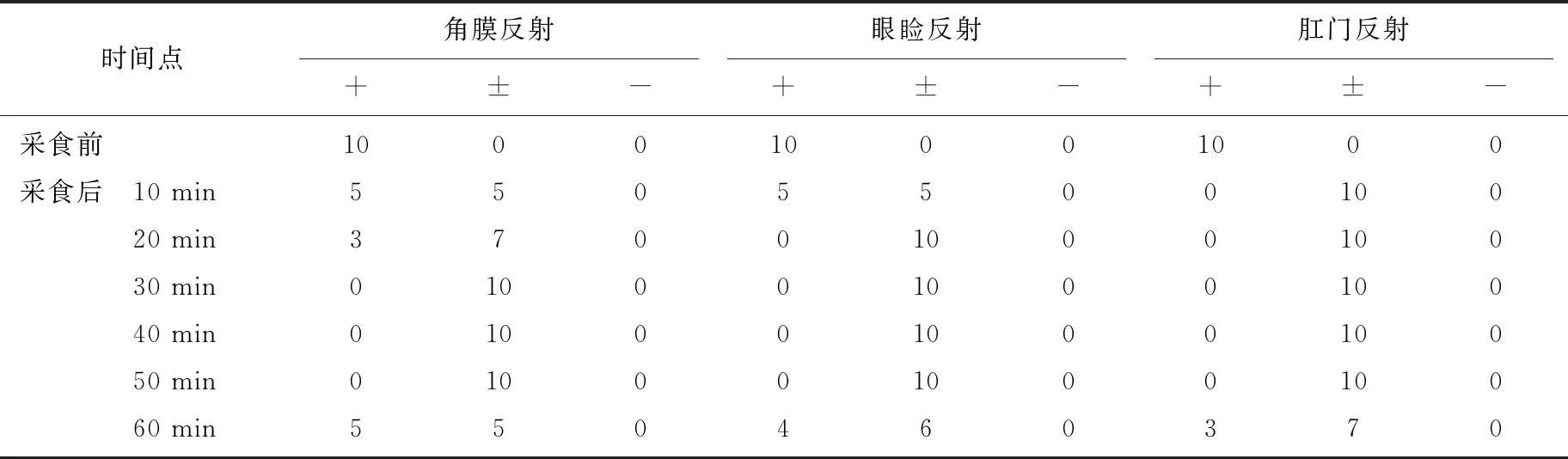
表7 生物反射活动的监测结果(n=10) 只
3 讨论
3.1 口服麻醉对貂常规生理指标的影响
对麻醉药物影响生理功能方面的监测,可以很好地反映药物的安全性[3]。如果在麻醉过程中不及时纠正生理指标的异常变化,可导致围麻期出现明显麻醉并发症,甚至可导致麻醉失败,动物死亡。在本次试验中呼吸频率和心率出现了显著变化,主要与右美托咪定药效作用密切相关,该药具有明显的镇静和阻滞交感神经的作用,这也在前期预试验及其他动物麻醉试验中也得到了证实,呼吸频率和心率受到抑制程度与该药使用剂量密切相关[6-10]。体温在麻醉过程中也出现了明显的降低,因此建议在麻醉过程中应及时采取保温措施,防止术后出现寒战[3]。
3.2 口服麻醉对貂麻醉时期的影响
麻醉时期主要记录麻醉的诱导、维持和苏醒等不同阶段的时长。全麻诱导期对于诊疗前暴躁、易应激饲养动物以及野生动物较为重要,保持该期平稳决定后续的麻醉是否能顺利进行[11],另外在野外抓捕动物时要求诱导期越短越好。全麻维持期的长短则关系着诊疗的内容,也是调整药物使用剂量重要的参考指标。苏醒期的长短可以指导麻醉监护工作的进度。在本次研究中发现该口服麻醉方式诱导迅速,未出现明显的并发症;维持时间适宜,对于貂临床诊疗麻醉而言,时间较为充裕;苏醒较为平稳,这有助于诊疗后的护理工作。
3.3 口服麻醉对貂麻醉作用效果的影响
监测麻醉状态下的镇静、镇痛和肌松效果是评价麻醉药物或方法是否适合临床应用的重要指标,特别关系着貂外科诊疗和开展伤害性试验的内容和范围,并保证这些外科诊疗及试验过程中人畜安全。α-氯醛糖可明显增强γ-氨基丁酸(GABA)A型受体对GABA的亲和力,相关研究发现其本身也可激活该受体[3],因此α-氯醛糖具有较为确实的麻醉效应;而右美托咪定具有镇静、肌松和镇痛效果,被使用于多种动物复合麻醉的临床研究中,该药有很强的表面穿透能力,可通过皮肤和黏膜发挥麻醉效应[12]。将2种药物进行复合使用,不仅是为了降低两药的毒副作用,但更主要的目的还是为了达到平衡麻醉效果。本次试验中观察到在口服这2种药物后20~50 min,镇静、镇痛和肌松效果较为确实均衡,综合麻醉效果较为良好。另外,结合对常规生理指标的监测结果分析发现,两药复合后对机体造成的影响是短暂可耐受的,这些均体现出复合麻醉的优势。
3.4 口服麻醉对貂生物反射活动的影响
眼睑、角膜和肛门等生物反射活动是判定麻醉深度的重要方面,此方面的监测的优势在于便捷、实用、无创和准确,常被用于全麻监测过程中[3,13]。在本次麻醉过程中这3种生物反射始终存在,表明未出现麻醉过深的现象,其中在20~50 min 3种生物反射受到了明显的抑制作用,产生的麻醉深度较为适宜,将此部分监测结果与镇静、镇痛和肌松作用效果结合进行分析,可进一步证实这种口服麻醉方式可产生30 min深度适宜、作用均衡的良好麻醉时间。
4 结论
将α-氯醛糖和右美托咪定进行复合使用,可以达到平衡麻醉的效果。使用320 mg/kg α-氯醛糖联合1 mg/kg右美托咪定对貂进行口服麻醉,麻醉诱导迅速,可产生30 min深度适宜、作用均衡的良好麻醉效果,且苏醒较为迅速、平稳,但在麻醉过程中出现了体温降低的情况,因此建议在麻醉过程中应及时采取保温措施,防止术后体温过低。

