腰椎间盘髓核组织中TrkB、NDRG2表达及其与衰老髓核细胞的关系
蔡正生,孙竹清,杨晓松,赵宏宇,郑基永
(沈阳市骨科医院综合外科,辽宁沈阳,110000)
脊柱退行性疾病为临床常见慢性病,主要表现为颈肩痛、腰腿痛,近年来逐渐呈年轻化态势[1-2]。从病理基础上来看,椎间盘退变为脊柱退行性疾病发生的关键,但目前其确切机制尚未明晰[3]。近年有研究报道,椎间盘特定基因表达可致部分细胞功能异常,进而参与椎间退变进程[4-5]。研究表明,微小RNA(microRNA,miR)表达异常与椎间盘髓核细胞过度凋亡存在关联性[6]。对于严重腰椎间盘突出症患者,具有调节细胞凋亡作用的miR-200c在髓核组织中表达明显增高,提示miR-200c或参与椎间盘退变进程。且有研究发现,miR-200c能够调节酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)水平,从而对肿瘤细胞增殖及凋亡进行调控[7]。N-Myc下游调节基因2(N-myc downstream regulatory gene 2,NDRG2)属于NDRG家族,可作为抑癌候选基因,在肿瘤发生发展及转归过程中承担着重要角色,并可调节细胞分化、增殖与凋亡。NDRG2第一内含子区有P53结合点,为P53新靶基因。在退变椎间盘组织中,P53表达明显增高,提示其参与椎间盘退变病理过程[8]。然而现阶段,TrkB、NDRG2在髓核退变中的作用在有关研究中较为鲜见。基于此,本研究对不同退变程度腰椎间盘髓核组织中miR-200c与TrkB、NDRG2与P53的表达变化进行分析,旨在为探讨TrkB、NDRG2在髓核退变进程中的作用提供理论依据。
1 资料与方法
1.1 一般资料
选取2018年1月~2020年4月在本院行腰椎手术摘除的髓核组织标本75份,其中,男51例,女24例;年龄40~51岁。所有患者术前均行MRI检查,基于Pfirrmann分级标准,依据髓核退变程度分级进行组别划分。其中,Ⅱ级组:腰椎爆裂骨折25例,男16例,女9例,年龄(44.06±5.03)岁;Ⅲ级组:腰椎间盘突出症25例,男18例,女7例,年龄(43.75±4.89)岁;Ⅳ级组:腰椎间盘突出症25例,男17例,女8例,年龄(43.82±4.94)岁。三组患者性别、年龄等一般资料比较,差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准。患者均对本研究内容知情并签署同意书。
1.2 实验方法
1.2.1 髓核组织中衰老髓核细胞检测
采用细胞衰老β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-gal)试验对髓核组织中衰老髓核细胞进行检测。取髓核标本制冰冻切片,大小为15 μm,加入SA-β-gal染色固定液(上海碧云天生物技术有限公司),室温下固定15 min,应用PBS(0.01 mol/L)进行洗涤,重复3次后,置于摇床上轻摇,将PBS吸除,滴加SA-β-gal染色工作液,置于湿盒孵育过夜(37℃、避光)。光学显微镜下观察细胞染色情况,衰老髓核细胞呈现为蓝绿染色,即为阳性。随机选取5个高倍视野,计算衰老髓核细胞百分比。
1.2.2 髓核组织中miR-200c、TrkB mRNA表达检测
采用RT-PCR技术进行检测,应用TRIzol试剂(厂家:Invitrogen公司)对总RNA进行提取,而后去RNA 2 μg进行逆转录,合成cDNA,再取cDNA 1 μL进行RT-PCR检测。相关引物序列见表1,均由上海吉凯基因公司设计合成。反应条件:95℃ 30 s预变性,95℃ 5 s,60℃ 35 s,40个循环。采用2-ΔΔCT法计算目的基因相对表达量,重复3次取平均值。

表1 miR-200c、TrkB及内参基因PCR引物序列
1.2.3 髓核组织中NDRG2 mRNA、P53 mRNA表达检测
采用RT-PCR技术进行检测,取髓核组织标本100 mg,加入RNAiso Plus(厂家:日本Takara公司)1 mL,按说明书进行操作,提取组织总RNA,溶于20 μL DEPC水,应用Prime Script RT reagent Kit试剂盒(日本Takara公司),逆转录合成cDNA,取cDNA 1 μL作为模板,用特异性引物进行PCR反应,引物序列见表2。采用SYBR©Premix ExTaq Ⅱ反应试剂盒(日本Takara公司),依据说明书配成10 μL反应体系,每个样本做3个腹孔,另增设不加模板cDNA作为阴性对照,应用美国 Bio-Rad公司进行基因扩增。反应条件:95℃预退变 5 min,95℃退变20 s,60℃退火20 s,65℃延伸20 s,40个循环。最后一循环结束后,72℃延伸10 min。采用2-ΔΔCT法计算目的基因相对表达量。

表2 NDRG2、P53及GAPDH的PCR引物序列
1.2.4 髓核组织中TckB、NDRG2蛋白检测
均采用Western blotting法。TrkB蛋白表达检测:选取冻存组织标本,应用蛋白裂解液进行裂解,应用匀浆器进行研磨,冰上裂解,经离心处理,收集上清液,采用BCA法测定蛋白样品浓度。取蛋白上清液样品,每组等量,置于10% SDS-聚丙烯酰胺凝胶上进行电泳分离,室温下,加入5%脱脂牛奶,封闭1 h,再各自加入等量适当浓度一抗;4℃环境下孵育过夜后进行漂洗,室温环境下加入二抗,孵育1 h,洗膜,ECL发光。TrkB蛋白相对表达量=Image J分析条带灰度值/管家基因GAPDH条带灰度值。NDRG2蛋白表达检测:称取髓核组织100 mg,将其充分剪碎,应用PMSF裂解液进行裂解,4℃环境下经离心10 min,收集上清液,测定总蛋白浓度。将5×SDS样品缓冲液加入其中,95℃加热5 min,应用SDS-PAGE(10%)进行电泳,而后转移至PVDF膜。洗膜5 min,室温环境下应用封闭液封闭60 min,应用洗涤液进行洗涤,重复3次,每次5 min,滴加兔抗人NDRG2单克隆抗体(厂家:美国abcan公司),4℃环境下孵育过夜,应用洗涤液进行洗涤,而后应用辣根过氧化物酶标记的二抗,在室温环境下孵育60 min,再应用洗涤液进行洗涤,重复3次,每次5 min。在黑暗的室内环境下,与发光剂作用适量时间,曝光后再进行显影及定影。
1.3 统计学处理

2 结果
2.1 三组髓核组织中衰老髓核细胞比例
就髓核组织中衰老细胞比例而言,Ⅱ级组衰老髓核细胞所占百分比为(13.6±3.8)%,Ⅲ级组为(25.1±5.4)%,Ⅳ级组为(33.7±7.5)%。三组比较,差异有统计学意义(F=145.315,P<0.001),见图1。
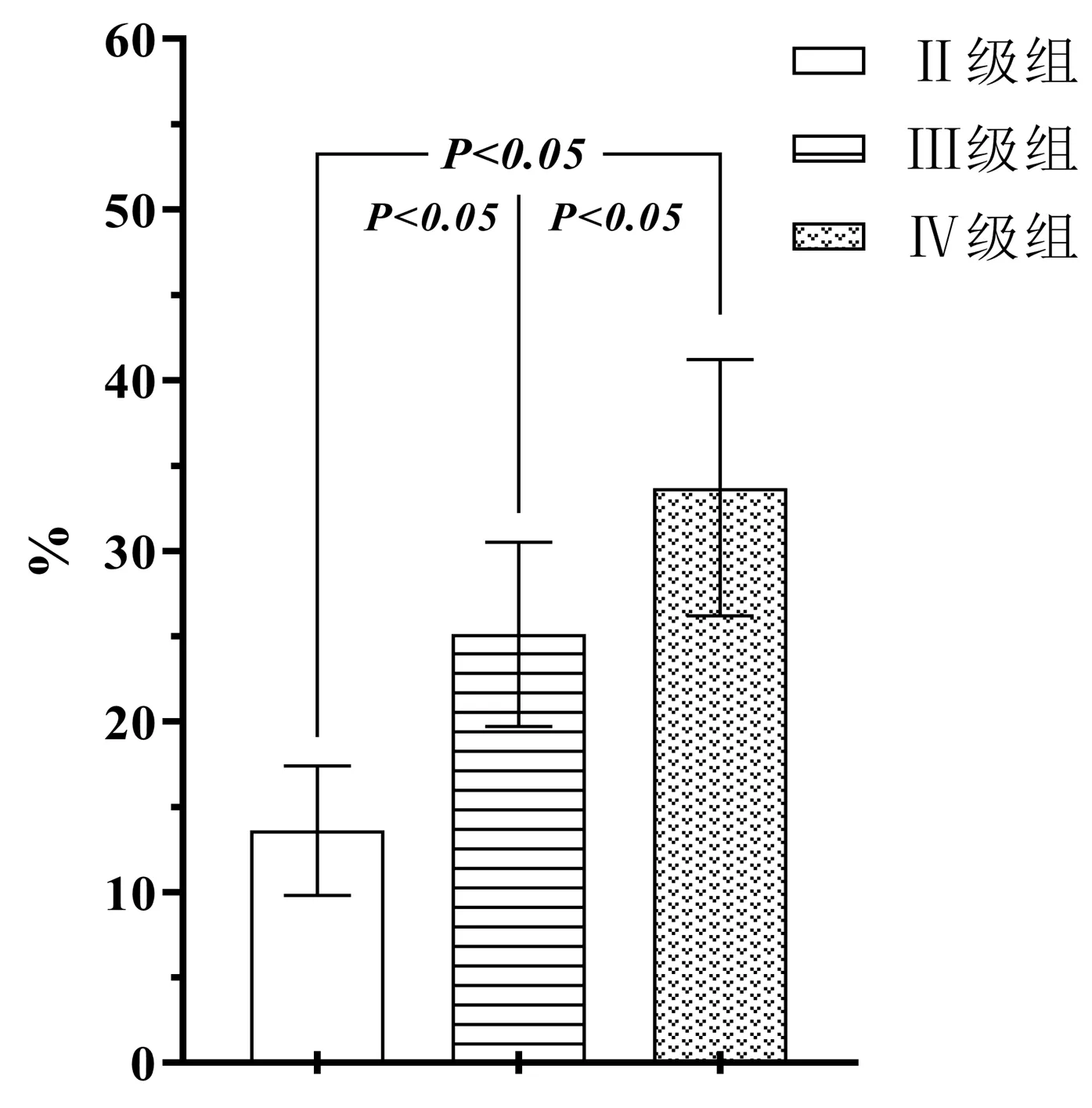
图1 三组髓组织中衰老髓核细胞占比比较
2.2 三组miR-200c、TrkB mRNA及蛋白表达比较
miR-200c相对表达量:Ⅱ级组<Ⅲ级组<Ⅳ级组,差异均有统计学意义(P<0.05);TrkB mRNA与TrkB蛋白相对表达量:Ⅱ级组>Ⅲ级组>Ⅳ级组,差异均有统计学意义(P<0.05),见表3和图2。

表3 三组miR-200c、TrkB mRNA及蛋白相对表达量比较
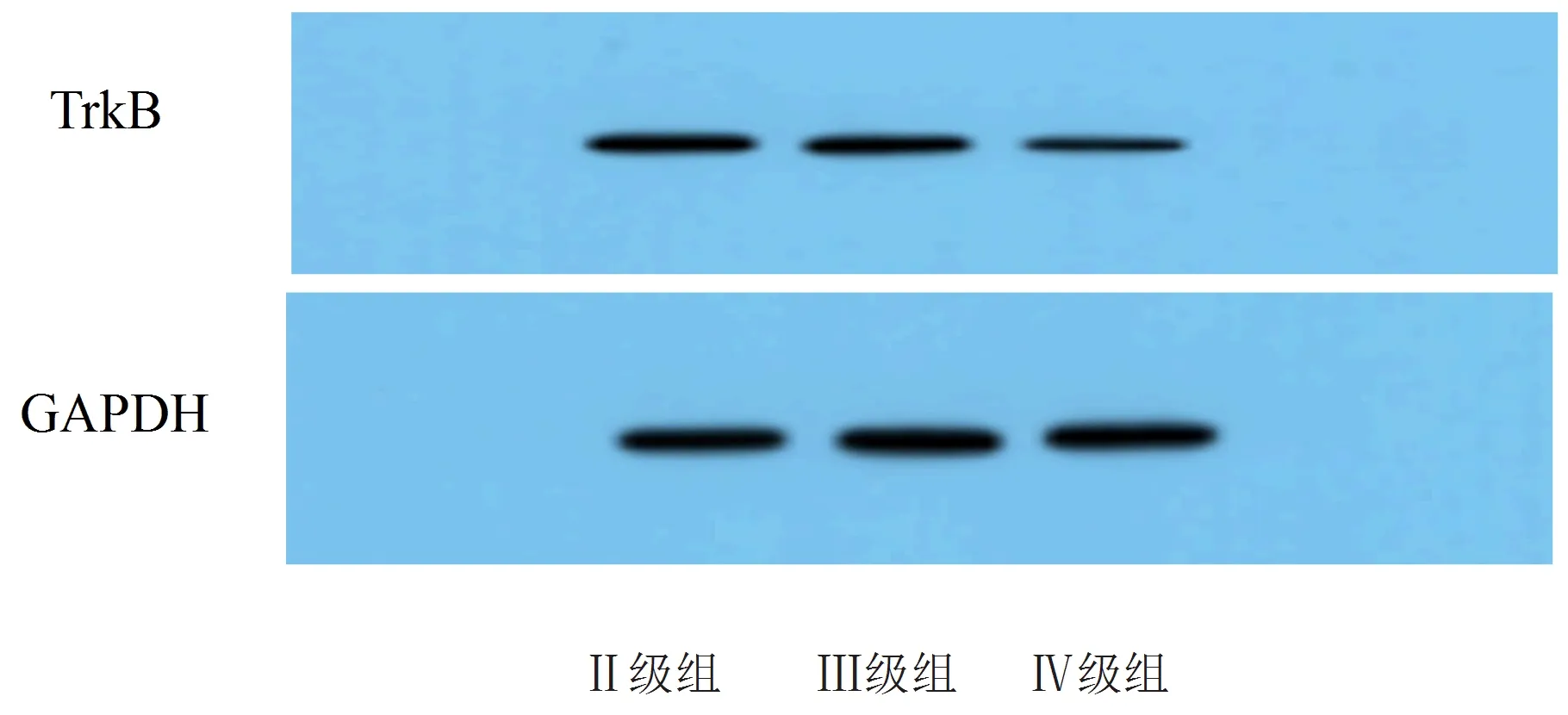
图2 TrkB的蛋白电泳图
2.3 三组P53 mRNA、NDRG2 mRNA与NDRG2蛋白相对表达量比较
三组P53 mRNA、NDRG2 mRNA与NDRG2蛋白相对表达量均存在显著差异,Ⅱ级组<Ⅲ级组<Ⅳ级组,差异均有统计学意义(P<0.05),详见表4和图3。
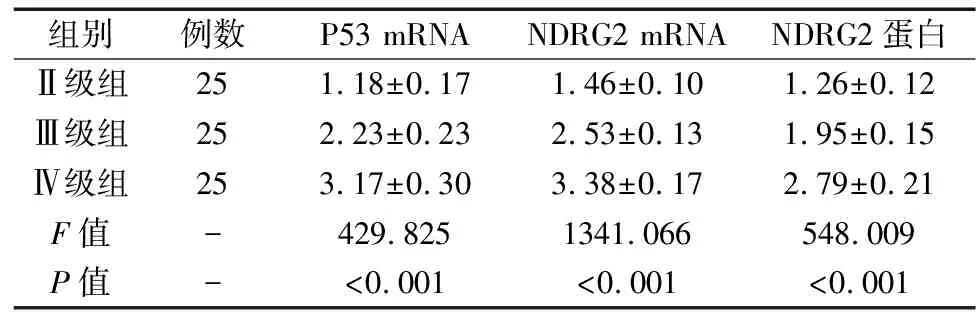
表4 三组P53 mRNA、NDRG2 mRNA与NDRG2蛋白相对表达量比较
2.4 相关性分析
Pearson相关性分析显示,TrkB mRNA相对表达量、TrkB蛋白相对表达量与髓核组织中髓核细胞占比呈显著负相关(P<0.05);NDRG2 mRNA相对表达量、NDRG2蛋白相对表达量与髓核组织中髓核细胞占比呈显著正相关(P<0.05),见表5;并且,miR-200c与TrkB mRNA呈显著负相关(r=-0.792,P<0.05),P53 mRNA与NDRG2 mRNA呈显著正相关(r=0.974,P<0.05)。应用Graghpad Prism软件进行相关散点图绘制,见图4的①~⑥。

图3 NDGR2的蛋白电泳图
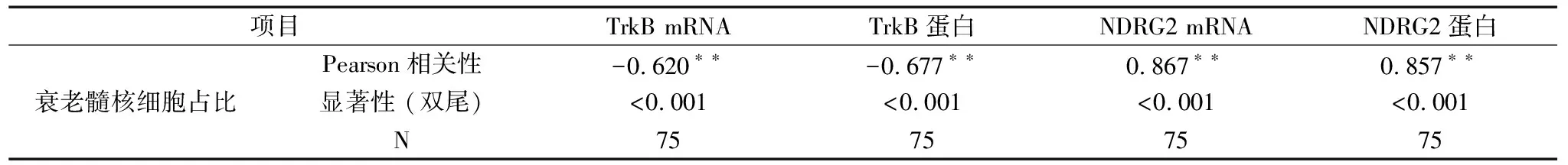
表5 TrkB、NDRG2表达与髓核组织中衰老髓核细胞的相关性分析
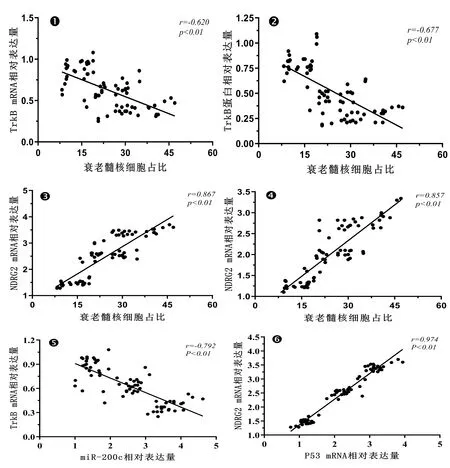
图4 相关性分析散点图
3 讨论
椎间盘髓核细胞衰老为引发椎间盘退变的重要因素[9]。然而,目前髓核细胞衰老的分子机制尚未清晰,因此,为寻找预防、治疗椎间盘退行性病变的新思路及新策略,或可从髓核细胞衰老的发生及其调节机制与衰老信号通路着手深入研究。
Pfirrmann分级的原理在于MRI成像技术,常用于退变椎间盘分级。本研究选取因腰椎手术摘除的髓核组织标本75例,基于术前Pfirrmann予以分析并分组。同时,研究样本仅选取40~50岁年龄段患者髓核组织,以此排除年龄因素对髓核衰老凋亡所产生的影响。在该年龄阶段,Pfirrmann Ⅰ级椎间盘已经不存在,且Pfirrmann Ⅴ级近乎不存在髓核组织,因此,本研究中髓核组织样本选取Pfirrmann Ⅱ~Ⅳ级。近年来学者们发现,退变与正常髓核组织细胞中存在一些特异性及差异表达的miR,由此提示miR或参与椎间盘退变发生及发展[10]。本研究发现,三组髓核组织中的衰老髓核细胞百分比存在显著差异,髓核组织随Pfirrmann分级增加,衰老髓核细胞增多,miR-200c表达水平增高。TrkB属于Trk家族成员,其编码基因称为神经营养酪酸受体激酶2(neurotrophic tyrosine kinase receptor type 2,NTRK2)。TrkB为脑源性生长因子受体,也为细胞增殖、分化、凋亡信号通路中的关键调控因子[11]。有研究发现,miR-200c在乳腺癌中呈现低表达,而NTRK2(TrkB)表达增高,上调miR-200c表达可下调NTRK2(TrkB)表达进而促使凋亡启动,并且,经挽救实验证实,上调NTRK2(TrkB)能够有效抑制miR-200c的促凋亡作用[12]。本研究发现,TrkB mRNA相对表达量与TrkB蛋白相对表达量:Ⅱ级组>Ⅲ级组>Ⅳ级组,差异均有统计学意义(P<0.05),提示随着Pfirrmann分级增高,TrkB mRNA与TrkB蛋白表达水平下降;Pearson相关性分析显示,TrkB mRNA相对表达量、TrkB蛋白相对表达量与髓核细胞占比呈显著负相关,miR-200c与TrkB mRNA呈显著负相关,提示miR-200c及TrkB表达异常与椎间盘退变发生及发展存在关联。
P53为肿瘤抑制基因,可参与细胞凋亡、DNA损伤及基因转录调节等过程[13]。同样,P53亦为典型衰老相关基因,机体内绝大多数细胞衰老均经P53-P21-pRB与P16-PRb两通路介导,前者可通过介导髓核细胞衰老进而引发椎间盘退变[14]。另有研究发现,P53可促新生血管形成以及毛细血管浸润,以此参与椎间盘退变[15]。NDRG2为新近发现的P53下游靶基因,常作为抑癌基因,参与细胞增殖、分化以及凋亡。临床研究发现,NDRG2在白内障脑组织与晶状体上皮细胞中均有增高表达,由此提示,P53-NDRG2途径或与衰老联系密切[16]。本研究显示,三组P53 mRNA、NDRG2 mRNA与NDRG2蛋白相对表达量均存在显著差异,Ⅱ级组<Ⅲ级组<Ⅳ级组(P<0.05);并且,Pearson相关性分析显示,NDRG2 mRNA相对表达量、NDRG2蛋白相对表达量与髓核组织中髓核细胞占比呈显著正相关,P53 mRNA与NDRG2 mRNA呈显著正相关。结果提示,随着椎间盘退变程度加重,NDRG2表达不断增高,说明NDRG2参与腰椎间盘退变的病理过程,或可介导髓核细胞衰老以促使椎间盘退变发生。
综上所述,TrkB、NDRG2可参与腰椎间盘退变的病理过程,或经介导腰椎间盘髓核细胞衰老,促使椎间盘退变。本研究不足在于:样本量较小,并且,椎间盘髓核组织选择较为单一局限,还有待进一步作大样本、多中心的深入研究。

