损伤电流在主动电极导线植入术中的临床价值和应用
盛琴慧 褚松筠 王玉玲 蒋捷 李康 陈尔冬 金汉 周菁
电极脱位及术后阈值增高是起搏器植入术较为常见的并发症,其原因除了患者局部心肌组织可能存在病变,多数是由于术中电极导线固定不良导致术后发生脱位或微脱位。术中可以通过多种途径和多项参数的检测,帮助判断电极导线是否固定牢靠以及植入部位是否理想,以最大程度地降低术后电极导线相关并发症的风险。电极接触尤其是主动电极旋入心肌时,会造成局部心肌及周围组织的损伤,形成损伤电流(current of injury,COI),COI的大小对主动电极导线的稳定性有很好的指导作用[1]。但由于描述的标准和测试的过程相对繁琐,并未在临床得到广泛的应用。笔者对比观察了术中行COI测试和/或常规起搏参数测试的房室双主动电极导线植入的患者,探讨COI对主动电极导线植入过程的指导意义和心房、心室间的差异,以及术中如何简化使用COI测试的临床策略。
1 资料与方法
1.1 病例资料 收集2018年1月至2019年12月于北京大学第一医院新植入永久心脏起搏器,术中同时行COI和常规起搏参数测试的患者;本项研究中以下患者除外:①植入单腔起搏器的患者;②含被动电极植入的患者;③行希浦系统起搏的患者;④植入心脏再同步化起搏/除颤器的患者。符合上述条件的为COI测试组(COI组);同期收集了符合上述条件植入同一品牌起搏器,但术中未行COI的患者,即常规起搏参数测试组(常规组)作为对照。
1.2 手术及术中COI和起搏参数测试 所有患者均采用1% 利多卡因局部麻醉,经左侧或右侧锁骨下静脉或腋静脉,在二维X 线指引下,分别植入心房和心室电极导线。常规组采用Merlin 3650程控仪,分别测试起搏阈值、电极阻抗、感知振幅;COI组使用Merlin 3650程控仪和Merlin PSA EX 3100分析仪,在电极导线螺旋旋入心肌后即刻和旋入后5 min,先记录COI,然后再分别测试起搏阈值、电极阻抗和感知振幅。COI及两组起搏参数均为双极记录和测试。COI组以PR 段或ST 段抬高的幅度来判定COI是否符合标准:旋入后即刻PR 段或ST段抬高,心房≥2.0 m V,心室≥10.0 m V;或者PR段或ST 段抬高的振幅高度达到自身P波或R 波的25%以上。常规组以起搏阈值为主要标准来判断:心房≤2.0 V,心室≤1.0 V。如果电极植入后不满足上述测试标准,则重新更换植入位置,直到符合上述标准。
1.3 随访 所有患者基于本院随访体系进行随访,设计随访次 数 包 括:术 后1 个 月、3 个 月、6 个 月、1年、此后每年1次;随访内容:患者一般状况及症状、起搏器囊袋及伤口愈合情况、体表心电图、起搏器程控及参数测试,根据需要可能进一步完善动态心电图、超声心动图或胸片等检查。
1.4 统计方法 分类变量以频数和百分率表示,正态分布的连续变量以均数±标准差表示,两组数据间比较采用t检验。采用SPSS21.0进行统计分析,以P<0.05为差异有显著性。
2 结果
2018年1月至2019年12 月于本中心新植入的符合本研究的患者共97例,有8例在植入术后6个月未进行复诊随访,4例术中及随访期间持续心房颤动未能获得完整起搏参数,最终共有85例患者入选本研究,所有患者均符合起搏器植入适应证,植入起搏器及电极如下:Victory XL DR 5816,Zephyr XL DR 5826,Accent MRI PM2124;Tendril ST 1888TC52/58,Tendril MRI LPA 1200M52/58(St.Jude Medical,CA USA)。两组患者基本信息见表1。

表1 两组患者基本信息
所有患者均成功植入了心房、心室主动电极导线,详细记录COI和/或起搏参数。前期我们已观察到心房、心室电极导线在螺旋旋入前普遍存在高阈值、高阻抗,COI幅度小、不稳定。通常在旋入后电极阻抗即明显下降,但阈值下降的速度和幅度不一致,与旋入前的参数亦无明显相关性,因此测试主动电极旋入前的COI和参数意义不大。
在COI组,心房和心室电极导线可靠旋入后即刻,COI即达到最高峰,表现为最大幅度的PR 段或ST 段抬高和最长的腔内心电图时限,随后COI强度即振幅和时限均逐渐下降,但持续至少5 min以上。如果初次植入部位不符合COI的标准,则更换部位重新植入。图1为术中记录的达标和不达标的COI示例。本组患者中,心房和心室电极导线旋入后5 min与旋入后即刻相比,其振幅和时限均有明显下降,P 均<0.001,但均保持在最初强度的50%以上。旋入后即刻测得的阈值显著高于旋入后5 min(P<0.001),但阻抗和感知振幅均无显著性差异,见表2。心房旋入后即刻的阈值普遍高于心室,下降的程度及速度慢于心室,部分患者在旋入后5 min阈值下降不明显或不理想,个别患者心房高阈值甚至长达20 min。因此,旋入后5 min的阈值和术中最后测得的阈值比较,心房仍可见到明显的下降,(1.1±0.61)V vs(0.85±0.34)V,P=0.04;而 心室则无明显变化,(0.59±0.23)V vs(0.61±0.14)V,P>0.05。
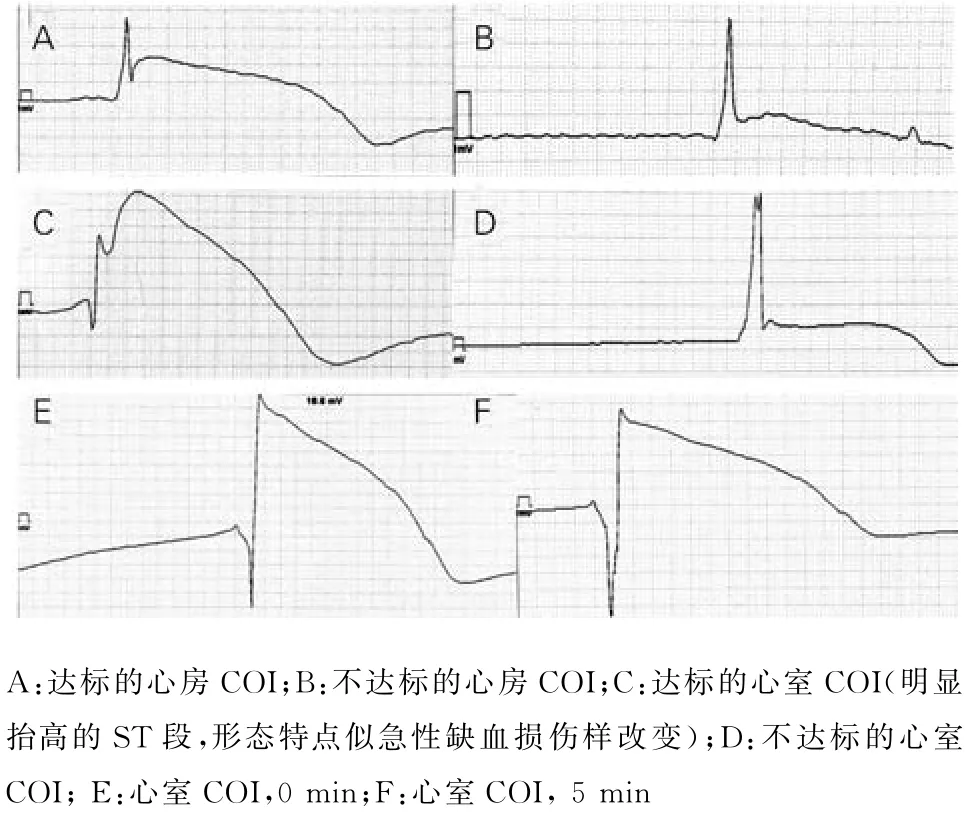
图1 术中采集的COI
两组患者均成功完成手术,COI组有1例出现囊袋轻度血肿,常规组有1例术后2周发生伤口缝线外露,均局部对症处理后恢复,随访期间无其他手术相关并发症。两组各项起搏参数的比较见表3。在COI组,术后各随访时间与术中相比,心房、心室电极导线的阈值、阻抗、感知基本无明显变化。常规组,总体参数在1年的随访期间也保持满意水平,但与术中相比,可以看到有个别参数发生了变化。最为明显的是心房阈值,术后1~12个月,均较术中明显下降。心室阈值在术后6个月和12个月时较术中增高。COI组有1例患者术后早期出现了心房间歇性失夺获,但阈值等各项起搏参数测试良好,胸片显示电极导线位置较前无变化,回顾术中记录的COI符合标准(0 min 3.1 m V,5 min 2.0 m V),判断电极导线无脱位,将起搏频率提高至70次/分时,心房可完全夺获。1个月后,复查各参数正常,起搏频率恢复至60次/分,起搏正常。
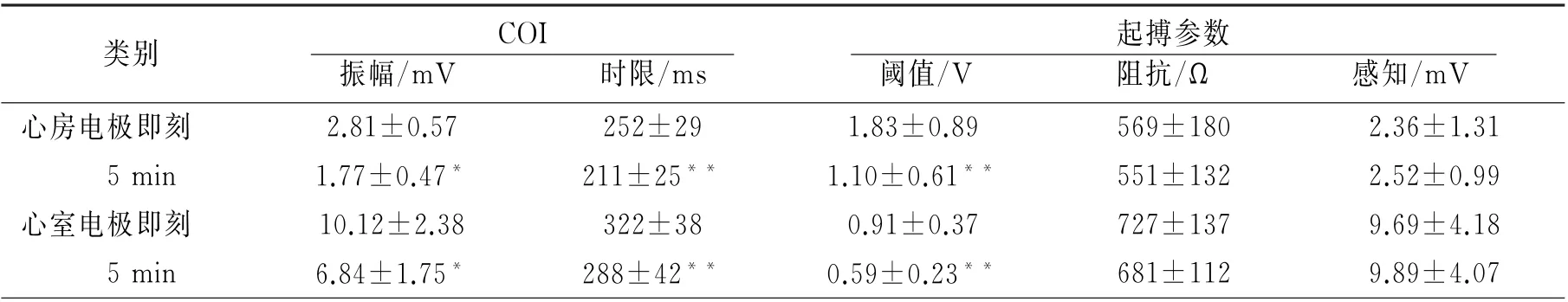
表2 心房、心室电极导线旋入即刻与旋入后5 min COI和起搏参数的比较(n=40)
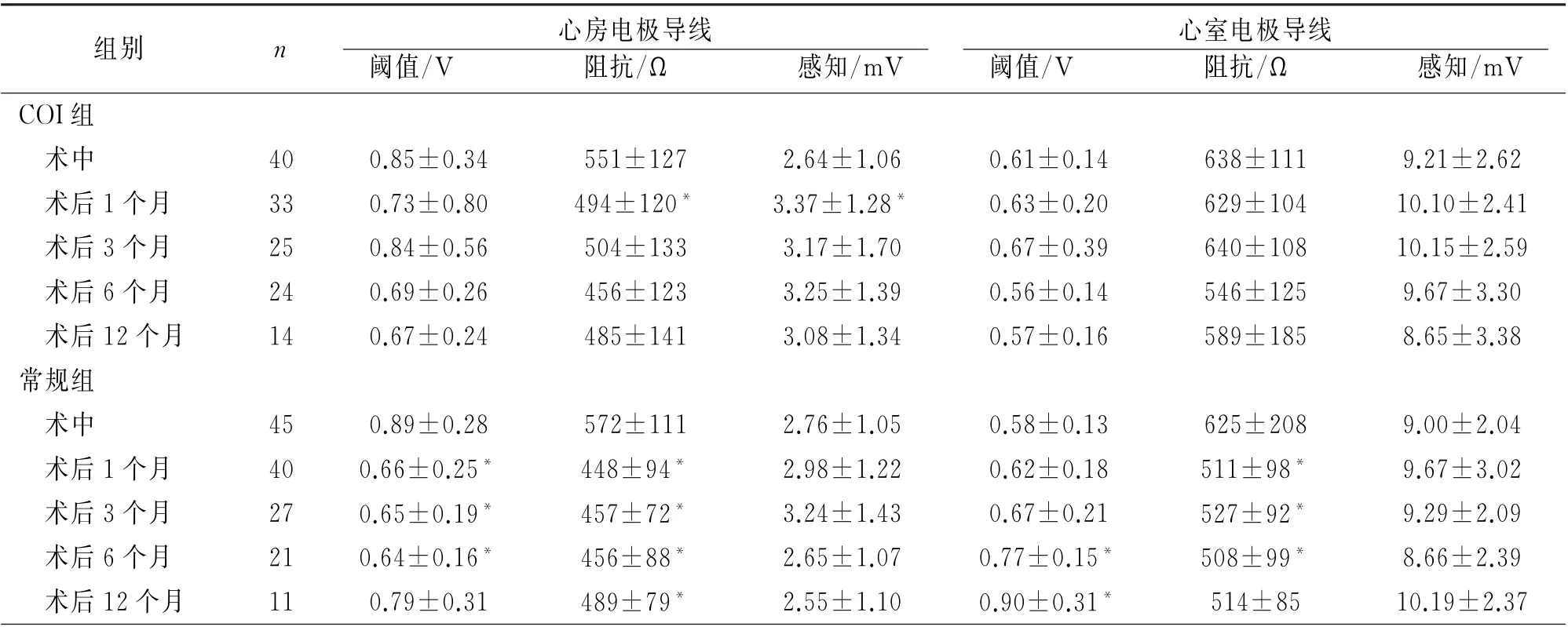
表3 两组术中和术后随访测试参数比较
3 讨论
早在1979年,有研究发现电极植入时COI的大小即PR 段或ST 段抬高的幅度,在术后电极脱位组明显低于非脱位组,因此可以预测植入电极导线的稳定性[1]。早年使用的被动固定电极导线产生的COI相对较小,所以COI并没有像常用的起搏参数(起搏阈值、电极阻抗、感知振幅等)一样在临床普遍使用。随着主动电极导线开始应用于临床,尤其是使用初期,主动电极导线的脱位或穿孔等并发症时有发生,为了提高主动电极导线术中及术后长期的安全性,COI重新被大家关注。我国主动电极导线的使用较晚,尤其是心房电极导线,不少中心至今仍然使用被动电极导线或刚开始尝试使用主动电极导线。主动电极导线植入过程中的起搏参数和变化特点不同于被动电极导线,造成初期使用时存在安全性的顾虑。COI对主动电极导线的植入可以起到更多的指导作用,选择合适的判断标准、简化术中测试的流程有助于实际操作和推广。
主动电极导线旋入心肌组织后,心肌组织被旋入电极损伤,会立刻出现心内电图的改变,主要表现为与基线电图相比,PR 段或ST 段明显抬高,随后随时间延长逐渐降低消失。研究发现,紧密接触即固定良好的电极,会形成足够大的COI,并与螺旋旋入的深度相关,其出现到消失的变化过程有一定的规律性[2]。概括来看,判断COI是否理想,主要有以下标准:①PR 段或ST段抬高的幅度:与旋入前COI相比,心房增加1 m V 以 上,心 室 增 加5 m V 以 上;或 者PR 段/ST段抬高的振幅高度达到自身P波或R 波的25%以上[3];旋入后即刻PR/ST 段抬高,心房≥2.0 m V ,心室≥10.0 m V[4]。②COI持续的时间:旋入后不同时间COI强度与旋入即刻相比,5 min维持在50%以上,10 min 维持在20%以上[5]。③心腔内电图时程:与旋入前相比,旋入后心腔内电图时程延长50 ms以上[3]。上述标准中,旋入后即刻COI的大小最为重要,也是其他判断标准的前提。而旋入前的COI不仅形态特点不显著,增加了测量的误差;而且个体之间差异较大,即使是同一个体,笔者尝试不同压力作用于电极头端时,也可能形成大小不等的COI。徐勋龙等[6]报道,心室主动电极导线螺旋旋出前COI与旋出后高阈值或急性脱位无相关性。因此相比旋入后COI,旋入前基线COI及旋入前后COI的变化量的判断价值有限。相反,旋入后即刻明显增大的COI,形态变化特点显著(和心肌缺血持续时产生损伤性的ST 段抬高一样),即使不经过特殊的测量也很容易立刻被识别出来,结合自身P波和R 波的高度,可以迅速判断是否形成了足够大的COI。本组病例研究结果显示,最终判断理想达标的COI,心房振幅均大于2 m V、心室振幅>10 m V,COI/P 或R 比 值 达1/3,其 中 超50%的患者COI/P或R 比值达1/2以上。因此,笔者推荐以图形特点作为简易的COI的判断标准:旋入后即刻出现可以清晰辨认的PR 段或ST段明显抬高,即可迅速做出判断。此时如果测试阈值过高,则可以等待5 min重新测定,如果阈值下降不明显,则再次记录COI,如果COI仍然明显存在,则可以继续延长等待时间。如果5 min时COI已经不明显而阈值仍无明显下降,则更换起搏位置。
我们早期的研究发现[7],主动电极旋入后,阈值会出现短暂的明显升高,随后5~10 min逐渐下降,受当时植入条件的影响,仅有2例心房主动电极导线的植入,主要观察的是心室主动电极导线的阈值变化,但这种现象在心房电极导线可能更为明显。因此,本研究入选了心房、心室同时植入主动电极导线的患者,比较主动电极导线在心房、心室植入术中的变化规律和差异,以及COI的不同意义。结果发现,心房主动电极导线旋入前后阈值的变化更加明显,高阈值持续的时间更长,最长的高阈值持续时间达20 min以上,由于术中同时记录到了非常显著理想的COI,避免了该例患者术中更换起搏位置。而以往的经验此类患者容易导致多次反复的更换电极导线位置。国内文献报道最多一例患者心房电极导线在植入过程中更换了17个部位[8]。从最后阈值及术后不同时间的随访,可以看到心房阈值下降后的长期阈值持续稳定。因此,对主动电极导线,尤其是心房主动电极导线,如果旋入后COI明显,即使出现即刻的阈值增高,可延长等待时间,从而避免反复多次地调整电极位置,减少术中反复操作带来的风险。
本研究还发现,COI除了植入术中对阈值及电极稳定性的指导作用,对少数患者,COI还有助于术后电极故障的分析和鉴别,避免不必要的二次手术。本组中有1例患者在术后出现了心房间歇性失夺获,回顾患者术中COI明显且持续时间充分,结合影像和程控测试,考虑电极移位的可能性极小,经过调整起搏频率证实患者系心房内慢频率依赖型传导阻滞,提高起搏频率后心房完全夺获,1个月后,传导阻滞改善,随访无异常。
如前所述,COI表现特征和变化规律已有文献清淅展示,所有患者均行COI测试意义有限,术中详细测量COI所有数值变化及持续时间也无必要,增加手术总时间。尤其对心室电极导线,多数患者的常规参数稳定,可以满足术中测试的需要。笔者推荐在以下情况进行COI的测试有较好的指导作用。①初期开展心房主动电极导线植入;②常规植入位置阈值过高,尤其是旋入后短期阈值增高;③多部位阈值过高或参数不理想;④电极脱位或故障行电极重置。对上述患者选择性地进行COI的测试,可以简化手术流程,避免仅因阈值短暂增高造成的重复操作,降低手术风险,提高术后长期的安全性。
致谢:感谢雅培医疗用品有限公司心脏节律管理部门的艾志勇、魏英男,对术中损伤电流采集的技术支持。

