常温机械灌注对大鼠心脏死亡器官捐献供肝微循环保护作用的研究
杨柳,曹欢,孙东,侯宾,林玲,宋红丽(.天津医科大学一中心临床学院,天津3009;.天津市第一中心医院器官移植科,天津市器官移植重点实验室,中国医学科学院移植医学重点实验室,国家卫生健康委员会危重病急救医学重点实验室,天津3009)
心脏死亡器官捐献(donation after circulatory death, DCD)供肝经历较长时间的热缺血和缺血再灌注损伤(ischemia reperfusion injury, IRI),静态冷保存(static cold storage, SCS)下,肝脏能量代谢和线粒体功能易于受损,对SCS 相关的IRI 特别敏感,应该限制暴露于SCS[1]。常温机械灌注(normothermic machine perfusion, NMP)模仿体内正常的代谢状态,很大程度上改善了DCD 供肝质量,优于SCS[2-3]。肝脏微循环结构和功能的变化在很大程度上影响着肝脏的生理功能,微循环障碍是导致肝脏损伤的决定因素[4-5],本研究致力于探索NMP 对DCD 供肝的微循环的影响,研究其发挥保护作用的机制。
1 材料与方法
1.1 实验材料:血管性血友病因子(von Willebrand factor, vWF)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)抗体购自美国圣克鲁斯公司;内皮型一氧化氮合酶(endothelial nitric oxide synthetase,eNOS)抗体购自美国细胞信号技术公司;诱导型一氧化氮合酶(inducible nitric oxide synthetase,iNOS)、细胞间黏附分子(intercellular cell adhesion molecule-1, ICAM-1)抗体购自中国武汉三鹰公司;内皮素-1(endothelin-1,ET-1)抗体购自中国博奥森公司。选取6 ~ 8 周、200 ~ 220 g 雄性SD 大鼠(n =42)获取DCD 肝脏;实验动物由中国食品药品检定研究院提供,合格证号:SCXK(京)2017-0005。
1.2 实验方法
1.2.1 大鼠DCD 肝脏获取及肝脏NMP 系统建立:SD 大鼠麻醉后,腹部中央切口暴露肝脏,结扎左膈下静脉、右肾静脉、肾上腺静脉丛和肝动脉;游离门静脉并结扎幽门静脉及脾静脉,插入胆管支架。剪开膈肌夹闭胸主动脉、棉棒压迫心脏模拟心脏死亡过程;温盐水纱布覆盖腹腔30 min 后取下肝脏。本研究大鼠NMP 系统是单循环系统设备,主要包括离心泵,膜氧合器,器官室,加热器,压力、温度监测器等。灌注液为含20 % FBS 和1 % 双抗的DMEM/F12 (1:1)培养液60 ml,并添加20 ml 新鲜血液、肝素、胰岛素和地塞米松。
1.2.2 实验分组和处理:实验分为3 组(n =42):Normal 组(n =6),SCS 组(n =6),NMP 组(n =30)。 NMP 组,灌注后0、2、4、6 和8 h 收集流入道、流出道灌注液待检,并收集肝脏标本;SCS 组肝脏以 20 ml 4 ℃ UW 液(the University of Wisconsin solution)冲出肝内血液,并于UW 液中4 ℃ SCS6 h 后收集肝脏标本;Normal 组大鼠留取血清及肝脏待用。肝脏标本随机留取肝脏组织福尔马林固定,2.5 %戊二醛溶液固定,部分肝脏剪碎后液氮速冷,所有标本置于-80℃冻存待检。
1.2.3 肝功能及乳酸检测:检测流出道灌注液白蛋白(albumin, ALB)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和碱性磷酸酶(alkaline phosphatase, ALP)的水平;血气分析检测流入道灌注液乳酸水平。
1.2.4 肝脏病理苏木精-伊红(hematoxylin and eosin, HE)染色:随机取各组肝脏组织,4 %甲醛溶液固定,制成石蜡切片进行HE 染色,显微镜镜下观察肝组织病理学改变;根据Suzuki 的标准进行分级评分[6],具体评分标准见(表1)。
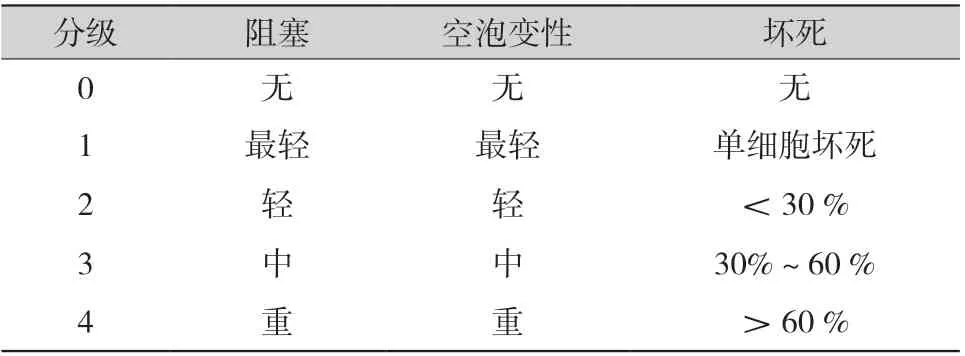
表1 Suzuki’s 评分标准
1.2.5 细胞凋亡检测(terminal deoxynucleotidyl transferase dUTP nick end labeling, TUNEL):石 蜡切片经烤片、二甲苯脱蜡,梯度酒精水化,蛋白酶K 通透、TUNEL 试剂反应,观察肝脏细胞凋亡情况。
1.2.6 透射电镜检测:随机取新鲜肝组织,切成2 mm×3 mm 的样品,2.5 %戊二醛溶液固定, 包埋、超薄切片后在透射电子显微镜下观察肝组织的超微结构。
1.2.7 Western blot:提取肝脏总蛋白并测定蛋白浓度,经行电泳、转膜,标记ET-1(1 ∶500)、eNOS(1 ∶500)、iNOS(1 ∶500)、ICAM-1(1 ∶500)、VCAM-1(1 ∶100)、vWF(1 ∶500)和GAPDH(1 ∶3000)。
1.2.8 统计学方法:采用SPSS 17.0 进行统计分析,全部数据均为计量资料,正态分布的数据处理均以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用q 检验。P <0.05为差异有统计学意义。
2 结 果
2.1 大鼠NMP 系统评价
2.1.1 大鼠NMP 系统对DCD 供肝肝功能、乳酸及胆汁分泌量的影响:各时间点ALB 水平无显著差异;ALT 和AST 表现为升高趋势,4 h 和6 h 的ALT、AST 水平无显著差异,其余各时间点之间水平差异显著,灌注6 h 以后,ALT 和AST 升高幅度显著,差异显著(P <0.05);ALP 水平逐渐下降,各时间点水平无显著差异。灌注0 h 乳酸迅速下降至低水平,灌注6 h 以后,乳酸出现升高趋势,2 h 和6 h 乳酸水平差异显著(P <0.05);胆汁分泌量水平逐渐增高,灌注6 h 以后胆汁分泌幅度减小(图1)。
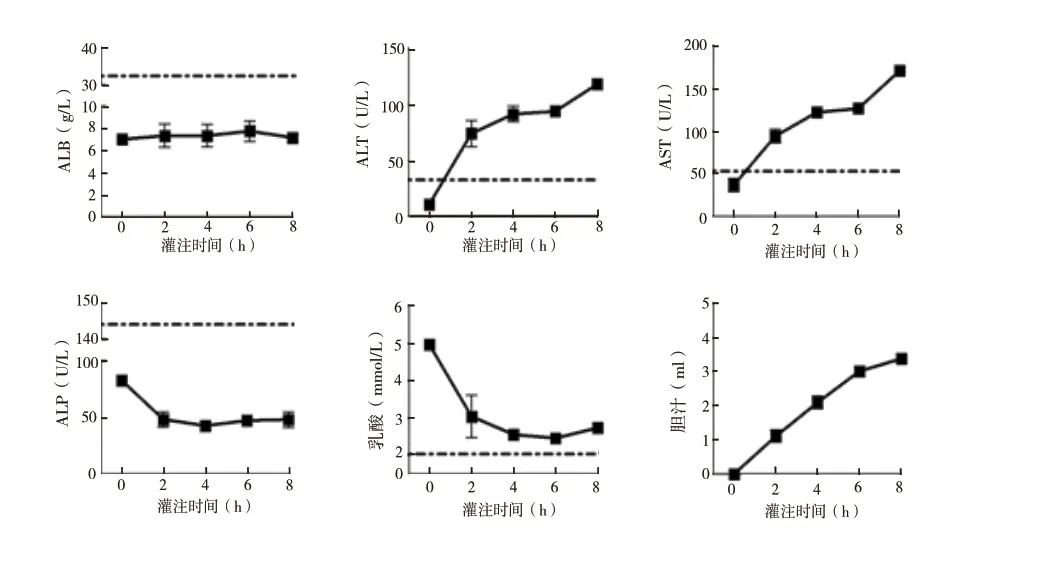
图1 大鼠NMP 系统对DCD 供肝肝功能、乳酸及胆汁分泌量的影响
2.1.2 大鼠NMP 系统对肝脏组织病理学的影响:随灌注时间的延长,肝细胞空泡变性、水肿及肝窦淤血逐渐减轻,6 h(2.80±0.84)h 肝脏无明显病理损伤,灌注8 h(5.80±0.45)h 的肝脏病理表现恶化;灌注4 h(3.40±0.55)h 和6 h 的肝脏Suzuki 评分较低,无显著差异,肝脏病理表现最佳,提示随着灌注时间的延长IRI 逐渐得到改善,但灌注6 h 以后出现肝脏损伤(图2)。

图2 大鼠NMP 系统对DCD 供肝病理的影响
该大鼠NMP 系统可显著改善DCD 供肝的肝功能和肝脏组织病理学,但是灌注6 h 时供肝质量下降,提示该大鼠NMP 系统保存DCD 供肝的最佳、最长时间为6 h,进一步灌注可能影响供肝质量。
2.2 NMP 改善DCD 肝脏组织病理学:SCS 组肝细胞空泡变性、水肿及肝窦淤血较重、NMP 组肝细胞几乎无空泡变性、无肝细胞水肿及肝窦淤血。NMP(3.40±0.55)组Suzuki 损伤评分显著低于SCS(7.00±0.71) 组(F =229.75,P <0.05),提示NMP 保存DCD 供肝可改善供肝病理(图3)。2.3 NMP 减 轻DCD 肝 脏 细 胞 凋 亡:Normal(3.20±1.10)组凋亡小体最少,SCS(33.40±4.39)组凋亡小体最多,NMP(9.80±1.48)组凋亡显著低于SCS 组(F =166.58,P <0.05),提示NMP可减轻DCD供肝细胞凋亡,优于单SCS方式 (图3)。
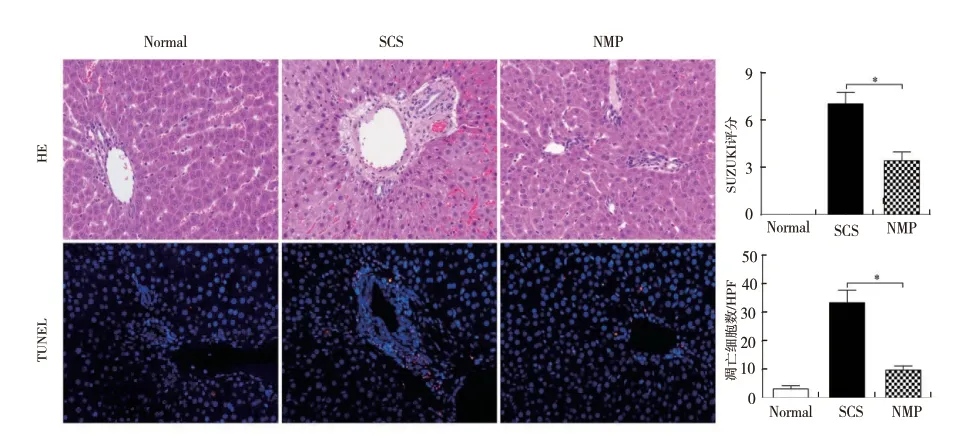
图3 不同保存方式对DCD 供肝质量的影响
2.4 NMP 减轻DCD 肝脏细胞线粒体损伤:SCS 组肝细胞线粒体严重水肿、空泡变性,线粒体嵴结构紊乱、大部分消失,线粒体不可逆损伤严重(2.80±0.45),部分线粒体坏死溶解;NMP 组肝细胞线粒体几乎无肿胀、空泡变性,线粒体嵴结构完整,线粒体不可逆损伤较少(1.60±0.55,F =36.29,P <0.05)。提示NMP 可改善线粒体损伤(图4)。
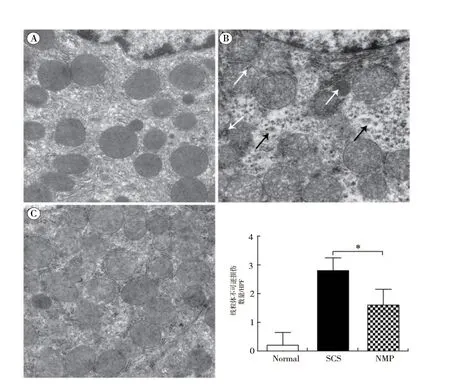
图4 各组DCD 供肝组织超微结构的变化(×25 000)
2.5 NMP 改善DCD 肝脏微循环
2.5.1 NMP 抑制细胞间黏附和改善内皮细胞损伤:ICAM-1 和VCAM-1 是细胞间黏附分子,是炎症反应的产物,提示肝窦阻塞程度。NMP 组肝内ICAM-1(F =1728.45,P <0.05)和VCAM-1的表达显著低于SCS 组(F =254.72,P <0.05),提示:NMP 保存可减轻肝窦阻塞(图5)。NMP 组肝内vWF(F =595.30,P <0.05)的表达量显著低于SCS 组(P <0.05)。提示NMP 保存方式可减少肝脏内皮损伤(图5)。
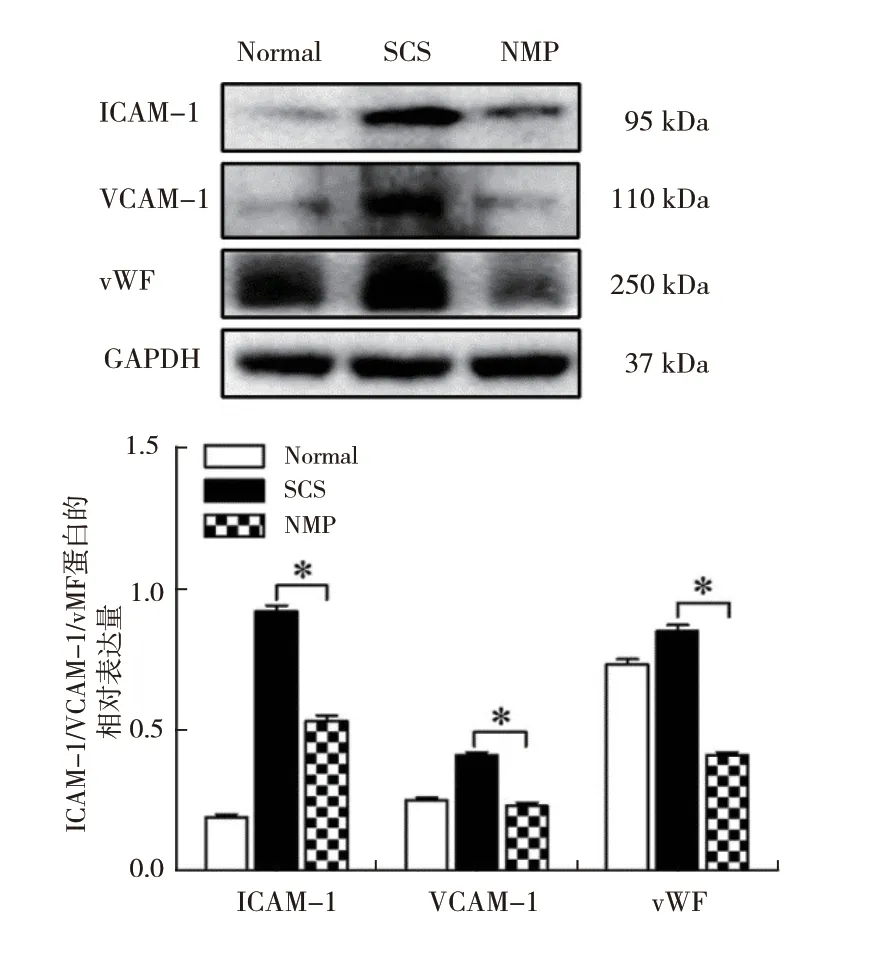
图5 各组DCD 供肝黏附分子和vWF 的表达情况
2.5.2 NMP 改善ET-1/NOS 平衡和微循环灌注:肝内ET-1 表达于肝内血管及肝窦,NMP 组ET-1 的表达水平显著低于SCS 组 (F =1372.51,P <0.05)。提示NMP 抑制了肝内分泌ET-1 的作用,减少肝窦收缩,改善肝窦血流灌注(图6)。
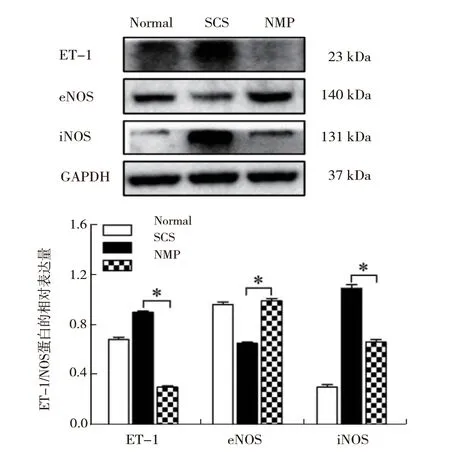
图6 各组DCD 供肝ET-1/NOS 表达情况
肝内eNOS 表达于肝窦内皮和血管内皮,可产生NO,是内皮舒张因子,具有扩张血管和肝窦的作用。NMP 组肝内eNOS 表达水平显著高于SCS 组(F =271.66,P <0.05)。 肝 内iNOS表达于肝窦,由应激和炎症诱导产生,提示巨噬细胞活化程度。NMP 组肝内iNOS 表达量显著低于SCS 组(F =1102.20,P <0.05)。提 示NMP促进了DCD 肝脏合成eNOS,抑制iNOS 的生成(图6)。
3 讨 论
在该项研究中,我们采用稳定的单循环NMP系统,灌注时间选择0、2、4、6 h 和8 h,检测了肝功能、乳酸和胆汁分泌量指标,发现随着灌注时间的延长,灌注6 h 以后ALT 和AST 出现了明显的升高,乳酸水平在灌注6 h 后出现明显反跳升高,同时胆汁的分泌量升高幅度降低。组织病理学方面的表现,灌注后肝脏缺血/再灌注(ischemia reperfusion,IRI)逐渐得到改善,4 h 和6 h 的病理表现最佳,与肝功能表现一致的是,灌注6 h 以后出现了肝细胞水肿、肝窦淤滞等病理恶化的表现。为了研究效果的稳定性,综合评价该NMP 系统对供肝质量的影响,我们选择了NMP系统保存后供肝质量最佳的6 h 的肝脏进行后续的研究。我们评估了NMP 保存方式和SCS 保存方式对DCD 供肝质量的影响,发现保存DCD 供肝6 h,NMP 显著改善肝功能、肝脏病理和IRI,减少肝细胞凋亡,NMP 明显优于SCS;进一步发现NMP 对肝脏线粒体也具有保护作用。线粒体对缺氧和氧化应激非常敏感,与肝脏微循环的关系密切[7]。
缩血管因素ET-1 和扩血管因素NOS 两者之间的平衡对肝脏微循环稳态的维持具有重要作用。ET-1 是目前发现的最强的内源性缩血管肽,缺血、缺氧是ET-1 表达上调的重要刺激因素[8]。肝脏受损时,内皮细胞表达ET-1 增加,NO 产生减少,使得血管收缩、肝窦淤滞[9-10]。NOS 合成NO,主要是eNOS 和iNOS,eNOS 具有 改 善IRI作用,而iNOS 主要在炎症刺激下诱导产生,过度表达可促进ONOO-的产生,导致内皮功能障碍,促进IRI 的发生[11-13]。我们的检测结果发现NMP 保存方式抑制了DCD 供肝肝内ET-1 和iNOS的过度合成,促进了eNOS 的合成增加,NMP 对肝内ET-1 和NOS 的表达产生了显著的调节作用,NMP 对ET-1/NOS 平衡的调节可能与其持续灌注、供氧,改善肝窦淤滞有关,因此我们认为NMP 的保存方式可改善DCD 供肝微循环灌注,优于SCS。
研究表明,持续的NMP 可以建立保护级联,改善缺血缺氧造成的氧化应激损伤,ROS 释放发生限制到最低,减轻组织炎症[14-15]。ICAM-1 和VCAM-1 是炎症反应的产物,是细胞间黏附和浸润的标志,提示肝窦阻塞程度[16-17],也是内皮功能障碍的特征性分子[18]。我们的研究发现NMP的保存方式显著抑制DCD 供肝肝内ICAM-1 和VCAM-1 的表达,优于SCS,提示了NMP 可通过持续灌注、供氧及提供代谢物质来减轻肝窦阻塞,减少肝窦内皮和血管内皮损伤。von Willebrand 是内皮损伤的标志,肝内vWF 水平的升高的程度提示内皮损伤程度和肝窦阻塞程度[19],检测发现了NMP 的保存方式可以显著抑制DCD 肝脏vWF 的表达,内皮细胞损伤程度和肝窦阻塞程度最低,进一步验证了NMP 在改善DCD 供肝肝窦微循环障碍和内皮损伤的作用。
本研究表明,NMP 通过抑制DCD 供肝内细胞间黏附,改善肝窦阻塞和内皮损伤,调节肝内ET-1/NOS 平衡改善肝脏灌注进而改善DCD 供肝微循环来发挥保护作用。本研究中的NMP 系统是单循环系统,灌注系统没有设立排泄装置,灌注时间过长限制了灌注体系的器官修复水平,下一步我们将进一步改良灌注方法,做进一步的研究。

