MRI 联合CT 定位在局部进展期低位直肠癌新辅助放化疗中的应用
王晓亮,钟美霞,吴培信,冯梓贤*(广东省廉江市人民医院.肿瘤科;.普通外科,广东廉江54400)
大肠癌我国恶性肿瘤的发病率和病死率均是第5 位,其中直肠癌约占大肠癌的50%~70%,而且近年来直肠癌趋向年轻化和发病率呈现上升趋势[1-2]。新辅助放化疗因为有降低术后复发率、提高完整切除率等作用,目前已成为局部进展期低位直肠癌的标准治疗方案[3]。目前的放疗设备常采用电子计算机断层扫描(CT)进行靶区勾画,但磁共振成像(MRI)对软组织鉴别率高,因此对肿瘤、肛提肌、正常肠壁、肝门括约肌等之间的鉴别有很大的帮助,进而有可能提高局部进展期低位直肠癌靶区勾画的准确性和疗效[4]。本研究通过探讨MRI 联合CT 定位在局部进展期低位直肠癌新辅助放化疗中的应用价值,以期为局部进展期低位直肠癌的治疗提供依据。
1 资料和方法
1.1 一般资料
回顾性分析2017 年5 月-2020 年5 月廉江市人民医院收治的70 例初治局部进展期低位直肠癌患者的临床资料。所有患者均经病理确诊为直肠癌。纳入标准:(1)肿瘤下界距肛缘≤5 cm;(2)血红蛋白≥120 g/L,白细胞≥4.0×109/L,中性粒细胞≥2.0×109/L,血小板≥100.0×109/L;(3)体力状况评分0~1 分,KPS 评分均≥80 分;(4)肝肾功能正常。排除标准:(1)严重营养不良者;(2)有盆腔放疗史;(3)体内有金属;(4)有明显伪影者。根据靶区勾画方法的不同将患者分为观察组和对照组,每组35 例。两组一般情况的差异无统计学意义(P>0.05),见表1、2。
1.2 方法
两组均是采用调强放疗技术进行放疗。95%计划肿瘤靶区接受的最小剂量为DT50 Gy/25 次/5 周。50%膀胱照射剂量小于50 Gy,照射50 Gy 的股骨头体积小于5%,50%小肠照射剂量小于15~20 Gy。采用卡培他滨(上海罗氏制药有限公司,国药准字H20073024)1 600 mg/(m2·d),从放疗第1 天开始,每天分2 次口服,每周5 次,直到放疗治疗结束。
观察组在定位前排空膀胱和肠道,排空后饮入1 000 mL含20 mL 碘海醇的水。随后按照调强放疗体位进行机位固定。采用40 排螺旋CT 定位扫描。扫描基线与水平面垂直,扫描范围为股骨中段水平到第二腰椎上缘。扫描层厚为5 mm。行增强CT 时给予静脉注射浓度为30%的碘海醇,速度为3.0 mL/s,剂量为1.0 mL/kg,注射35 s 后进行图像采集。CT 图像采集结束后随即进行MRI(德国西门子公司,型号:magnetom skyra 3.0T)定位扫描。MRI 定位扫描的定位前准备、固定装置、扫描体位、扫描层厚均与CT 定位扫描相同。扫描范围为会阴至第3 腰椎上缘。扫描序列为T2 加权序列和弥散加权序列。将CT 和MRI 的扫描结果均传输至放射治疗计划系统(瓦里安TPS11.0)勾画危险器官和靶区。
对照组仅采用CT 定位扫描(扫描方案与观察组相同),随后将CT 扫描结果传输至放射治疗计划系统(瓦里安TPS11.0)勾画危险器官和靶区。
1.3 评价指标
评估对比两组放化疗后的肿瘤分期情况。肿瘤分期标准依据UICC/AJCC 分期标准第7 版。新辅助放化疗结束后评价两组的疗效。疗效评价标准:所有靶病灶完全消失且没有新病灶出现为完全缓解;靶病灶最大径之和减少≥30%为部分缓解;靶病灶最大径之和缩小或增大未达部分缓解为疾病稳定;靶病灶最大径之和至少增加≥20%或出现新病灶为疾病进展[5]。检测比较两组的大体肿瘤靶区(gross tumor volume,GTV)体积、GTV 长度和GTV 下界距肛缘距离。统计对比两组的放疗Ⅱ~Ⅲ度不良反应,不良反应的判定依据美国国立癌症研究所通用毒性标准NCICTC 3.0 版。
1.4 统计学处理
2 结果
2.1 放化疗后的肿瘤分期及疗效
两组放化疗后的T 分期、N 分期、临床分期和疗效的差异均无统计学意义(P>0.05),见表3。
2.2 GTV 体积、GTV 长度和GTV 下界距肛缘距离
与对照组相比,观察组的GTV 体积明显缩小,GTV 长度明显变短,GTV 下界距肛缘距离明显增长(P<0.01 或0.05)。见表4。
2.3 两组新辅助放化疗Ⅱ~Ⅲ度不良反应比较
本研究无超敏反应、死亡病例和Ⅵ度不良反应。观察组Ⅱ~Ⅲ度的骨髓抑制和胃肠道反应发生率均明显低于对照组(P<0.05)。见表5。
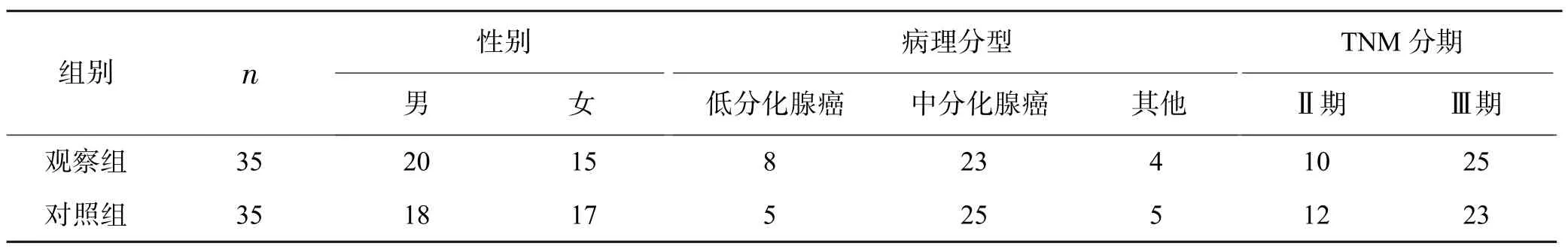
表1 两组性别、病理分型及TNM 分期情况比较 (例)
表2 两组年龄、指检肿瘤下极距肛门距离及癌胚抗原水平比较 (±s)
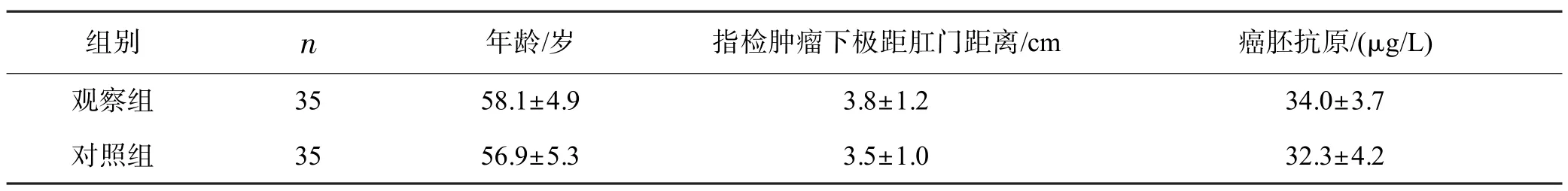
表2 两组年龄、指检肿瘤下极距肛门距离及癌胚抗原水平比较 (±s)
两组比较均P>0.05

表3 两组放化疗后的肿瘤分期比较 例(%)
表4 两组的GTV 体积、GTV 长度和GTV 下界距肛缘距离比较 (±s,n=35)
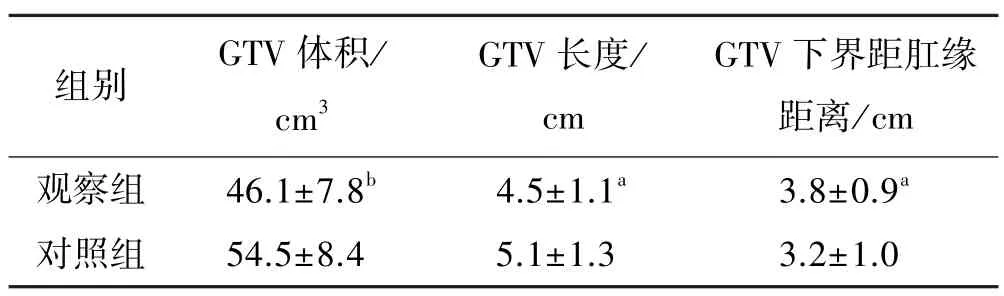
表4 两组的GTV 体积、GTV 长度和GTV 下界距肛缘距离比较 (±s,n=35)
与对照组比较:aP<0.05,bP<0.01
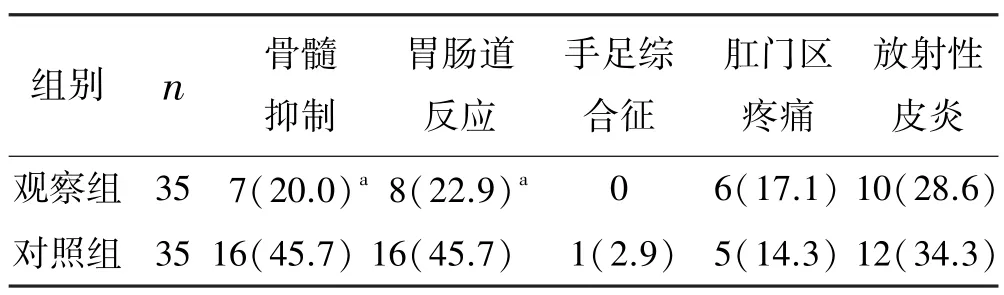
表5 两组新辅助放化疗Ⅱ~Ⅲ度不良反应比较 例(%)
3 讨论
本研究两组新辅助放化疗后,T 分期、N 分期及临床分期的降期和部分缓解的构成比均大于50.0%,而T、N 及临床分期的升期和疾病进展的构成比均小于3.0%,提示新辅助放化疗可使大部分局部进展期低位直肠癌患者获益,这为提高局部进展期低位直肠癌患者根治切除率、手术成功率、保肛率等创造条件,也可使部分不能切除病灶转变成可切除病灶[6]。两组放化疗后的T、N 及临床分期和疗效的差异均无统计学意义,提示两种勾画危险器官和靶区的方案对局部进展期低位直肠癌的新辅助放化疗效果影响不大。
与传统的三维适形放疗相比,调强放疗技术的靶区适形度更精准,正常组织边缘剂量跌落明显更陡,正常组织受量更低,但调强放疗技术对靶区勾画的要求也非常高,如果靶区勾画不精确,则会增加正常组织的损伤和降低肿瘤控制率,因此靶区勾画在调强放疗中至关重要。与对照组相比,观察组的GTV 体积明显小,GTV 长度明显短,GTV 下界距肛缘距离明显长(与直肠指检基本一致),提示采用CT 定位联合MRI 定位勾画靶区的准确度更高。分析原因可能如下:直肠、阴道、肛提肌、前列腺等组织之间的间距非常近,而且密度接近,同时直肠癌周围没有明显空腔形态,进而导致CT 鉴别直肠癌与正常组织存在一定的局限性,而MRI 对软组织的分辨率高,而且可以多方位进行定位,因此两者联合后对肿瘤及其周围组织的定位更为准确,从而降低把直肠癌周围正常组织也勾画到GTV 中的概率[4,7]。
新辅助放化疗方案作为直肠癌的重要放化疗方法,在给局部进展期低位直肠癌患者带来显著疗效获益的同时,也存在骨髓抑制等不良反应,进而增加局部进展期低位直肠癌患者使用集落刺激因子、感染、输血、延长住院、降低疗效的概率[8],如何进一步降低新辅助放化疗不良反应发生率成为局部进展期低位直肠癌的研究热点。本研究观察组Ⅱ~Ⅲ度骨髓抑制的发生率明显低于对照组,分析原因可能如下:骨髓干细胞对放射线高度敏感,它们一旦被破坏则导致骨髓抑制,因此减少骨髓接受低剂量放疗体积可降低急性血液学不良反应发生率和严重程度[9]。MRI 鉴别分布不对称和不均匀的骨髓非常成熟,而CT 则比较困难,从而导致对照组骨髓受量明显大于观察组[10],因此观察组Ⅱ~Ⅲ度骨髓抑制的发生率明显低。小肠是局部进展期低位直肠癌新辅助放化疗中重要的剂量限制器官,腹泻、恶心呕吐等胃肠道反应是局部进展期低位直肠癌新辅助放化疗中常见不良反应,这些不良反应会影响患者的生活质量和治疗耐受性[11]。因此,在保证放化疗疗效基础上,如何进一步降低严重胃肠道不良反应成为肿瘤科研究热点。观察组Ⅱ~Ⅲ度胃肠道反应发生率均明显低于对照组,分析原因可能如下:CT 不能区分直肠壁层次结构,难以准确评估原发病灶对直肠壁各层结构、壁外血管的侵犯及环周切缘情况,而MRI 具有较高的软组织分辨力,可以任意断面成像,可清晰显示直肠壁层次结构,进而准确评价直肠癌肿与肠壁各层结构及周围器官的位置关系,因此MRI 联合CT 定位勾画靶区的精确度更高,GTV 范围更小,使危及小肠等消化道组织的受量明显降低,进而减轻胃肠道反应[12-13]。
综上所述,MRI 联合CT 定位勾画出的GTV 体积更小,GTV 长度更短,确定肿瘤下界更精确,同时可降低Ⅱ~Ⅲ度骨髓抑制和胃肠道反应的发生率。

