非肝硬化门脉高压患者临床特点分析*
周 慧,冯晓宁,任 浩,刘杜先,杨永峰,熊清芳
肝硬化是导致门脉高压症的最主要的原因,但约20%门脉高压发生于肝硬化以外的多种疾病,统称为非肝硬化性门脉高压(noncirrhotic portal hypertension, NCPH)[1]。NCPH的病因广泛,包括门静脉、脾静脉血栓形成等肝前性因素,严重的右心衰和缩窄性心包炎等肝后性因素以及胆道疾病、肝窦阻塞综合症(hepatic sinusoidal obstruction syndrome, HSOS)、布加综合征等肝内因素[1-4],其中较罕见的特发性门脉高压(idiopathic portal hypertension, IPH)是一种排除了肝硬化、由未知原因引起的肝内窦前性门脉高压,其肝功能大多良好,肝酶仅轻度异常,肝性脑病等很少出现,以印度和日本发病率较高[5,6]。IPH的病因和具体发病机制一直不明确,临床上只能对症治疗[5-7]。其它类型的非特发性门脉高压(non-idiopathic portal hypertension, NIPH)都有较为明确的病因和/或相对有效的治疗方法,如HSOS为吡咯生物碱损伤肝血窦等内皮细胞从而形成微血栓,引起肝内淤血和门脉高压等[4,8];布加综合征由血管内膜性和血栓形成所致,可抗凝治疗或者手术治疗[9];多数缩窄性心包炎由结核引起,可通过抗结核治疗和/或心包膜剥脱术,解除门脉高压。胆道疾病,如原发性胆汁性胆管炎(primary biliary cirrhosis,PBC),可通过长期服用熊去氧胆酸缓解疾病的进展。由于NCPH在世界范围内发病率较低,临床医生对这类疾病的认识不足,容易把它们混淆为“肝硬化”或者简单地归类为“IPH”。故了解NCPH中IPH和NIPH的临床特征以及肝静脉压力梯度(hepatic venous pressure gradient,HVPG)变化,从而了解它们的临床规律,做到早发现和早治疗,以便能有效地缓解疾病的进展,预防严重并发症的发生有着重要的意义。我们回顾性分析了我院诊治的28例NCPH 患者的临床资料和HPVG的变化,现报道如下。
1 对象与方法
1.1 研究对象 2017年1月~2019年12月南京市第二医院住院并行肝静脉压力梯度测定的门脉高压患者66例,经病史询问、化验、影像学和/或组织学检查确诊为NCPH患者28例(其中IPH 11例,NIPH 17例),排除无肝组织学检查的NCPH 5例和肝组织检查提示原发性胆汁性肝硬化1例和肝炎肝硬化32例。IPH诊断依据日本标准[10]:即有明显的脾肿大伴有(或无)脾功能亢进症、贫血、消化道出血和门脉高压。PBC诊断标准符合下列三个标准中的两项:①反映胆汁淤积的生物化学指标如碱性磷酸酶(alkaline phosphatase,ALP)升高;②血清抗线粒体抗体(anti-mitochondrial antibody,AMA)或AMAM2阳性;③肝组织病理学检查符合PBC[11,12]。HSOS诊断依据明确的用药史和典型的影像学资料[4,8]。NIPH诊断标准为有门脉高压表现,肝组织病理学检查无纤维化改变。
1.2 资料收集 采集临床资料,包括一般资料、病史;实验室检查包括血常规、血生化,影像学检查包括彩色超声或CT或MRI检查肝胆胰脾门静脉系统。
1.3 HVPG测定 采用Seldinger法穿刺右侧颈内静脉,使用一次性球囊导管(波士顿科学公司,2.8F)测定肝静脉压力,按照公式计算 HVPG=肝静脉楔入压(wedged hepatic venous pressure,WHVP)-肝静脉自由压(free hepatic venous pressure,FHVP)。术中重复测量3 次,取平均值。
1.4 肝活检 在B超定位和引导下,使用18G“枪式切割式穿刺针”(美国巴德公司)经皮肝穿刺活检,取3~5 cm肝组织1条,经处理后行组织病理学和免疫组化检查。
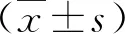
2 结果
2.1 一般资料 本文纳入IPH患者 11例和NIPH患者17例[包括布加综合征 3例、PBC 1例、原发性硬化性胆管炎(primary sclerosing cholangitis, PSC) 1例、HSOS 6例、易栓症 1例、抗磷脂综合征1例、硬皮病1例、淋巴瘤1例、地中海贫血所致血色病1例、先天性肝纤维化1例]。IPH组和NIPH组男/女比例分别为8:3和8:9(P>0.05),IPH组平均年龄为(40.55±15.75)岁,NIPH组为(53.00±12.91)岁(P<0.05)。
2.2 两组血常规和肝功能指标的差别 IPH组白细胞计数(white blood cell, WBC)、红细胞计数(red blood cell, RBC)计数、血红蛋白(hemoglobin, Hb)水平、血小板(platelet, PLT)计数、 总胆红素(total bilirubin ,TBIL) 、谷丙转氨酶(alanine transaminase, ALT)、 谷草转氨(aspertate Aminotransferase,AST)、谷氨酰转肽酶(glutamyl transpeptidase, GGT)、ALP水平与NIPH组相比皆无显著性差异(P>0.05);NIPH组血清白蛋白(serum albumin,Alb)和胆碱酯酶(cholinesterase,CHE)水平显著低于IPH组(P<0.05,表1、表2)。

表1 两组血常规【】比较

表2 两组肝功能【】比较
2.3 两组HVPG比较 IPH组WHVP和FHVP水平与NIPH组比无显著性差异(P>0.05),而IPH组HVPG水平显著低于NIPH组(P<0.05,表3)。

表3 两组比较
2.4 两组影像学表现特征比较 经B型超声或CT检查或询问病史,发现NIPH组腹水发生率显著高于IPH组(P<0.05,表4、图1)。腹水与HVPG高度相关(r=0.66,P<0.01),而消化道出血和食管胃底静脉曲张的发生与HVPG无显著性相关(r=0.193,P=0.324;r=-0.197,P=0.315)。

表4 两组并发症发生率(n,%)比较

图1 IPH患者腹部CT表现
2.5 不同疾病肝组织病理学表现 10例IPH患者和5例NIPH患者接受了B超引导下肝组织活检术,其共同的组织病理学特征为均无纤维化改变。IPH患者肝组织病理学表现为肝小叶结构清楚,肝细胞浊肿,多个汇管区门脉扩张、疝入(图2A);PBC患者表现为汇管区淋巴细胞浸润、旺帜性胆管炎和胆管缺失(图2B);PSC患者表现为胆管洋葱皮样改变(图2C);HSOS患者表现为在肝小叶3区可见明显的肝窦扩张、充血、肝板萎缩,汇管区基本正常,无淤胆,胆管正常,纤维化不明显(图2D)。

图2 肝组织病理学表现(HE,20×)
3 讨论
NCPH于1970年由国外医师发现,国内外鲜有报道。NCPH按其病因分为:血管病变(如布加综合征、HSOS)、凝血异常(如骨髓增殖性肿瘤、易栓症、抗磷脂综合征)、免疫异常(如普通可变性免疫缺陷病、结缔组织病、克罗恩病、实体器官或造血干细胞移植)、感染 (肠道感染、腹腔感染、 HIV感染 )、药物/毒素(嘌呤类似物、砷剂、维生素A)中毒、基因异常(Adams-Oliver综合征、Turner综合征、磷酸甘露糖异构酶缺乏)[1,2,13-15]。虽然病因不一样,但中后期都表现为门脉高压。
本研究IPH组平均年龄比NIPH组小,但比文献报道的30岁平均年龄要大[3],而两组WBC、RBC、Hb和PLT无显著性差异,但其均值或中位数都正常或者低于正常值,特别是与脾功能亢进有关的白细胞和血小板计数表现明显。NIPH组有1例地中海贫血所致血色病,该患者直到68岁时出现门脉高压症状时才开始查找病因,其可能的病因为突变位点致病性较低,长期慢性溶血导致轻度贫血(血红蛋白维持在90~110g/L),所以没引起足够的重视。两组TBIL、ALT、 AST 、GGT和ALP水平都正常或者稍高于正常值。与此同时,IPH组白蛋白和胆碱酯酶水平在正常范围,而NIPH组均低于正常值范围,说明NIPH组肝细胞合成能力受损伤程度比IPH组严重,可能系本研究中有6例HSOS患者,因为HSOS往往在年龄较大并有基础疾病的患者中容易发生有关。总体说来,NCPH患者肝细胞损伤轻,因此此类患者很少需要进行肝移植,可通过行内镜下治疗和经颈静脉肝内门体分流术(transjugular intrahepatic portosystem stent-shunt,TIPS)治疗缓解门脉高压症状[16]。
HVPG是WHVP和FHVP之间的差值,反映了门静脉和腹内腔静脉之间的压力差,可以更好地反映门静脉压力。IPH组HVPG低于NIPH组,与文献报道IPH的HVPG正常或稍高一致[1-3]。NIPH组中HSOS是由含有吡咯生物碱的药物导致肝窦内皮细胞的急性损伤,导致HVPG升高和顽固性腹水。我们发现腹水与HVPG呈正相关。研究证实IPH患者出现长期腹水预示着疾病的恶化,与本研究中IPH组出现腹水且HVPG明显升高一致,可能需要肝移植治疗[4,17-19]。
本研究中组织病理学变化因基础疾病的不同而变化。由于胆管、血管或者肝窦内皮细胞的损伤,或者异常细胞导致血窦的堵塞等[20],出现门脉高压的表现,但都有一个共同的特点就是无肝细胞损伤所致的肝纤维化。

