淋巴瘤化疗诱发肝衰竭患者临床特点与预后分析*
刘松涛,孟庆华,闾 军,刘 梅,许 媛,周建新,胡中杰
淋巴瘤是一种起源于淋巴结或淋巴组织的血液系统恶性肿瘤,其发病率逐年升高,在临床确诊并明确其病理学分型后,及时给予化疗可延缓病情进展或者获得临床治愈。但是,在治疗过程中,部分患者可发生肝损伤,甚至肝衰竭,严重影响预后。对此类患者的临床特点,目前文献多以病例报道为主[1-3]。本文对我院近10年诊治的在化疗后发生亚急性肝衰竭的淋巴瘤患者的临床资料进行了回顾性分析,以总结其临床特点,并分析了影响预后的因素,现报道如下。
1 对象与方法
1.1 研究对象 2010年8月~2019年10月首都医科大学附属北京佑安医院收治的化疗后发生肝衰竭的淋巴瘤患者,淋巴瘤诊断符合2016年世界卫生组织修订的《髓系肿瘤和急性白血病分类》的标准[4],肝衰竭的诊断符合中华医学会修订的《肝衰竭诊治指南(2018年版)》的标准[5]。
2 结果
2.1 基本资料 本组纳入21例患者,男15例,女6例;平均年龄为55.6±15.2(29~76)岁。均否认有长期大量饮酒史。2例有高血压病史,3例有糖尿病病史,1例有癫痫病史。在21例患者中,其淋巴瘤分型包括非霍奇金淋巴瘤20例,其中弥漫大B细胞淋巴瘤15例,小B细胞淋巴瘤2例,边缘带B细胞淋巴瘤1例,滤泡型淋巴瘤1例,外周T细胞淋巴瘤1例和霍奇金淋巴瘤1例。21例患者化疗方案分别为:利妥昔单抗、阿霉素类、环磷酰胺、长春新碱和泼尼松联合方案15例,阿霉素类、环磷酰胺、长春新碱和泼尼松联合方案2例,表柔比星、博莱霉素、长春新碱和氮烯咪胺联合方案1例,利妥昔单抗、依维莫司和异环磷酰胺联合方案1例,长春新碱和环磷酰胺联合治疗1例,苯丁酸氮芥单药治疗1例。21例患者肝衰竭病因分析:HBV被激活所致12例,HEV感染2例,淋巴瘤浸润2例,药物性因素引起者5例(中药2例,化疗药物3例)。在21例患者中,有14例合并HBV感染,其相关资料见表1。9例患者未接受抗病毒治疗,2例患者在抗病毒治疗过程中自行停药,1例患者在抗病毒治疗的同时进行系统化疗。2号患者在发生肝衰竭时血清HBV DNA阴性,虽然10号患者血清HBV DNA阳性,但是腹部影像学检查提示肝内多发低密度灶,考虑淋巴瘤肝脏浸润。

表1 14例合并CHB患者血清HBV标记物、HBV DNA和抗病毒治疗情况
2.2 临床表现 本组病例中18例患者主诉有乏力、纳差症状,3例患者有低热。查体均可见皮肤、巩膜黄染,4例患者肝脾肿大,2例患者腹部移动性浊音阳性。2例患者扑翼样震颤阳性。
2.3 实验室检查 常规实验室检测结果见表2。
2.4 治疗情况 在12例因HBV复制被激活所致的肝衰竭患者,除3号患者继续服用恩替卡韦外,另8例加用恩替卡韦,1例服用替诺福韦,2例应用恩替卡韦联合阿德福韦抗病毒治疗。在21例患者中,7例患者接受生物型人工肝治疗,6例患者接受单纯血浆置换,血浆置换量均为2000 ml/次,4例治疗1次,1例治疗2次,1例治疗6次,1例患者接受血浆置换联合双重血浆分子吸附治疗,共计2次。4例患者入院后在监测肝功能未改善的情况下,给予糖皮质激素治疗,给予2例甲泼尼龙静脉滴注治疗,其中1例用药方案为60 mg.d-1~30 mg.d-1,共6 d;1例为80 mg.d-1~40 mg.d-1,共4 d;给予1例地塞米松10 mg静脉注射,连用3 d后调整为5 mg,再用2 d;另1例为地塞米松5 mg静脉注射,连用5 d。
2.5 预后和影响因素 在21例患者中,11例生存,10例因病情持续恶化死亡,其中6例死于肝功能衰竭,2例患者死于肾功能衰竭,1例死于脓毒性休克,1例死于上消化道出血。自入院确诊至死亡的中位生存时间为14(4~40) d。根据不同发病诱因分类,在12例因HBV感染所致的患者,6例肝功能逐渐恢复正常,6例死亡;在4例药物性肝损伤患者,3例生存,1例死亡;在2例HEV感染患者,肝功能均恢复正常;3例因淋巴瘤浸润患者均死亡。表2显示血清AST、Cr、INR和MELD评分是影响死亡的因素,而采用Cox回归分析之向前步进法,结果显示血清Cr和MELD评分变化是影响死亡的独立危险因素(表3)。经ROC曲线分析,发现在住院过程中MELD评分比入院时升高超过5.34是最佳截断点,其预测死亡的敏感性为0.90,特异性为0.91。

表2 21例患者实验室检测结果
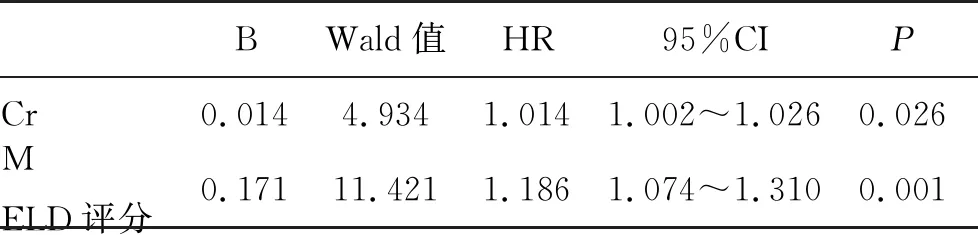
表3 Cox生存回归分析影响生存的预测因素
3 讨论
在本组淋巴瘤化疗后发生肝衰竭的21例患者,12例为HBV被激活所致,是最主要的诱发因素,既往也有类似的文献报道[2,3]。我国慢性HBV感染者人数众多,在此基础上罹患淋巴瘤的患者也非常多见。非霍奇金淋巴瘤患者HBV感染率显著高于普通人群[4-7]。文献报道HBV感染14年后患非霍奇金淋巴瘤的比例约为19.4/10万[8]。合并HBV感染也增加了治疗的复杂性。
利妥昔单抗是一种抗人CD20单克隆抗体,能特异性与B细胞表面的CD20抗原结合发挥免疫抑制作用,在临床上是治疗B细胞非霍奇金淋巴瘤的常用药物。但是,利妥昔单抗可导致体内CD8+T淋巴细胞的细胞毒作用增强,从而使HBV复制增强并引起肝损伤[8-10],即使是HBsAg阴转的患者也有发生HBV再次激活的风险[11]。虽然在化疗过程中肝功能受损常见,但进展至肝衰竭者,则预后较差。已有指南和共识强烈推荐预防性应用核苷(酸)类似物避免HBV再激活[12,13]。本组14例患者合并HBV感染,但是分析显示只有12例系HBV再激活导致肝衰竭,其中利妥昔单抗引起者10例。由于该组病例时间跨度长,在早期预防性抗病毒治疗还不够重视。在该类患者,及时给予强效低耐药抗病毒药物非常重要。有些患者虽然也接受了抗病毒治疗,但仍然发生了肝衰竭,可见即使预防性用药仍有潜在发生肝损伤的风险,需密切监测肝功能和HBV DNA变化,必要时可考虑联合用药。
除HBV感染外,其次是药物性肝损伤,本组有5例患者系药物性肝损伤导致肝衰竭,其中3例服用中药,还有2例系化疗药物引起。存在HBV感染的1例患者发生肝衰竭时检测血清HBV DNA阴性,不考虑HBV再激活所致。中药引起的药物性肝衰竭排在我国肝衰竭诱因的首位[14-16]。由于中药制剂成分复杂,单用或联合治疗时发生肝损伤,难以准确分析何种成分为致病因素,增加了诊断的难度。本组2例因化疗药物引起的肝衰竭患者,其化疗方案均为利妥昔单抗、阿霉素类、环磷酰胺、长春新碱和泼尼松联合治疗,究竟何种药物引起肝衰竭难以明确[17]。
随着淋巴瘤病情进展可累及全身各个系统。本组有2例患者系淋巴瘤浸润肝脏,导致肝功能进行性恶化发生肝衰竭,虽积极给予对症支持治疗,但是均治疗无效死亡,可见一旦发生淋巴瘤转移引起器官功能衰竭时,预后极差。还有2例患者系感染HEV引起肝衰竭,虽然无死亡病例,也给治疗带来了难度。
因HBV再激活诱发肝衰竭的患者均接受了抗病毒治疗,但是仍有6例死亡,其教训值得总结。密切监测评估和早期抗病毒治疗非常重要,否则将增加治疗难度。本组有部分患者接受了人工肝或糖皮质激素治疗方案,效果并不理想。由于例数不多,难以评价治疗效果。21例患者均在淋巴瘤基础上发生肝衰竭,在大部分治疗方案中均已含有强的松等糖皮质激素类药物,加上化疗因素,机体免疫功能受损严重,在此类患者继续应用皮质激素需慎重考虑。
通过Cox生存分析显示Cr和MELD评分是影响生存率的最重要因素。文献报道最多的是MELD评分、胆红素水平和多器官功能障碍等[18,19]。本文通过分析发现肝功能持续恶化和出现肝外器官功能受损,其病死率明显升高。有研究发现血清AST升高明显时提示淋巴瘤分期较晚[20],需要仔细鉴别引起AST升高的原因。在治疗过程中,动态监测肝脏功能的变化非常关键,如肝功能持续异常,在谨慎评估病情和淋巴瘤状态的情况下,可考虑行肝移植治疗[2]。
本组病例数不多,随着淋巴瘤和肝衰竭相关诊治指南的更新和临床诊疗水平的提高,在治疗淋巴瘤过程中发生肝衰竭的危险性在逐渐下降。在密切评估治疗效果时,也需密切监测肝功能变化。当出现肝损伤时要及时分析原因,并采取合理有效的措施,以免病情持续恶化,影响治疗效果。

