慢性丙型肝炎合并非酒精性脂肪性肝病患者血清A-FABP水平变化及其临床意义
郝肖伟,白 娜,郭小军,陈永刚
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒、肝组织出现与酒精性肝病类似表现的综合征,肝组织病理学上表现出大量的肝实质细胞脂肪变。随着病情进展,可能出现非酒精性脂肪性肝炎和肝硬化等[1-4]。近年研究指出,约50%CHC患者合并NAFLD。两种疾病相互促进,引起患者体内糖脂代谢紊乱、加速肝纤维化进程[5-7]。脂肪细胞型脂肪酸结合蛋白(adipocyte type fatty acid binding protein,A-FABP)是一种可以调节脂类生成和降解的基因,与脂质代谢性疾病关系密切[8-10]。本研究检测了慢性丙型肝炎(chronic hepatitis C,CHC)合并NAFLD患者血清A-FABP水平,并分析了其临床意义,现报道如下。
1 资料与方法
1.1 研究对象 2017年4月~2020年4月我院收治的CHC患者85例,男46例,女39例;年龄31~58岁,平均年龄为(42.6±3.7)岁。CHC诊断符合《diagnosis and management of hepatitis C》的诊断标准[11]。排除标准:有饮酒习惯(女性大于20 g/d,男性大于40 g/d)或酒精性肝炎、其他病毒性肝炎、合并甲状腺功能改变性疾病、合并恶性肿瘤、近2个月内应用过抗病毒药物治疗或其它影响免疫功能的药物者。另选择同期健康人85例,男50例,女35例;年龄30~60岁,平均年龄为(41.9±5.4)岁。两组性别(x2=0.383,P=0.536)和年龄(t=0.986,P=0.0326)比较,差异无统计学意义(P<0.05)。本研究纳入的所有CHC患者签署知情同意书,本研究经本院医学伦理委员会审核。
1.2 血清指标检测 采用ELISA法检测血清A-FABP水平(优尼康公司试剂,美国Bio-Rad公司生产的680型全自动酶标仪);使用LWC-360型全自动生化分析仪及其配套试剂盒检测血生化指标(天津冠嘉医疗设备有限公司),应用稳态模型评价胰岛素抵抗指数(HOMA-IR)=[空腹血糖(FBG mmol/L)×胰岛素(FINS mmol/L)]/22.5;采用荧光定量聚合酶链反应法测定血清HCV RNA(试剂盒购自贝克曼库尔特有限公司)。
1.3 肝组织病理学检查 在MX-01000305型彩色超声诊断仪(南京贝登医疗股份有限公司)的引导下,行经皮肝脏穿刺术,获取肝组织,行病理学检查。
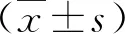
2 结果
2.1 各组血清A-FABP、HCV RNA和肝功能指标比较 在本组85例CHC患者中,经肝组织病理学检查,发现合并NAFLD患者42例。CHC和CHC合并NAFLD患者血清A-FABP、ALT和AST水平均显著高于健康人,CHC合并NAFLD患者血清A-FABP水平显著高于CHC患者(P<0.05,表1)。
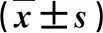
表1 各组血清A-FABP、HCV RNA及和肝功能指标比较
2.2 各组糖代谢指标比较 CHC和CHC合并NAFLD患者血清FIN、FPG和HOMA-IR水平均显著高于健康人,CHC合并NAFLD患者FIN和HOMA-IR显著高于CHC患者,差异有统计学意义(P<0.05,表2)。
2.3 各组脂代谢指标比较 CHC和CHC合并NAFLD患者血清TC、TG和LDL-C水平均显著高于健康人,CHC合并NAFLD患者血清TC和TG水平显著高于CHC患者,差异有统计学意义(P<0.05,表3)。
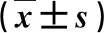
表2 各组糖代谢指标比较
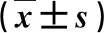
表3 各组脂代谢指标比较
3 讨论
肝脏是人体糖、蛋白质和脂肪的代谢中心,兼具转化、蛋白合成等多种功能,是功能最复杂的器官之一。其中,由肝脏分泌的胆汁酸在脂质的消化、吸收、分解、运输过程中占有重要的地位,而机体摄入多余的脂肪亦会沉积在肝脏,诱发脂肪肝[12,13]。目前,CHC被认为与代谢相关,可能诱发高血脂、糖尿病、NAFLD等多种疾病,且疾病之间相互促进,加速肝硬化、肝纤维化过程,最终导致肝癌的发生[14]。为了进一步探究CHC并发NAFLD的发病机制和危险因素,本研究纳入CHC合并NAFLD患者并与CHC患者进行对比分析,我们同时与脂质代谢相关的A-FABP指标,讨论了其与糖脂代谢和病毒载量的关系。
A-FABP是脂肪酸结合蛋白家族的一员,在细胞和组织中广泛存在,巨噬细胞和脂肪细胞是其主要的表达场所。研究指出,A-FABP与炎症和代谢性疾病联系密切[15]。由于NAFLD患者肝脏脂质沉积,激活体内氧化应激反应和脂代谢异常,导致胰岛素抵抗,而胰岛素抵抗又将促进脂代谢异常[16]。在本研究中,CHC合并NAFLD患者血清A-FABP水平显著高于CHC患者和健康人,说明CHC合并NAFLD患者血清A-FABP水平异常升高,究其原因可能是机体A-FABP过饱和,影响脂质正常代谢,可能加速了NAFLD的发生,这一结论在有关研究中也有报道[17]。CHC患者体内胰岛素敏感性和葡萄糖利用率都有所降低,胰岛素抵抗可能是患者脂代谢紊乱的主要原因[18,19]。在本研究中,CHC合并NAFLD患者血清FIN和HOMA-IR水平显著高于CHC患者和健康人,也提示CHC合并NAFLD患者体内胰岛素水平和胰岛素抵抗出现异常,这可能与A-FABP水平异常升高引起患者脂代谢异常,进而诱发胰岛素抵抗,两者相互作用有关。所以,如果CHC患者出现胰岛素抵抗或胰岛素水平异常升高,需要筛查是否出现NAFLD[20,21]。本研究对肝功能指标进行比较,发现CHC患者血清ALT和AST水平显著高于健康人,提示CHC患者肝细胞受到了一定的损伤。研究认为,HCV基因3a型感染的CHC患者处于病毒高载量时更容易导致NAFLD。本研究CHC组和CHC合并NAFLD组病毒载量比较无显著差异。通过对患者和健康人血脂指标的比较,发现CHC合并NAFLD患者血清TC和TG水平显著高于CHC患者和健康人,提示CHC合并NAFLD患者体内脂代谢异常情况更甚,考虑原因可能为HCV与脂蛋白和载脂蛋白结合引发脂代谢异常,导致TG在肝脏沉积,最终出现肝脏脂肪变性[22]。
在本研究中,血清高水平A-FABP的CHC合并NAFLD患者血TG、HOMA-IR和FIN水平均显著高于血清低水平A-FABP患者,提示CHC合并NAFLD患者体内A-FABP水平受多种因素的影响,包括糖代谢指标如FIN和HOMA-IR,同时也受脂代谢指标如TG的影响,推测其原因可能是由于CHC患者自身合并肥胖等代谢性疾病,引起肝脏出现代谢性脂肪变性和血清A-FABP水平异常升高,进一步加速了NAFLD的发生。今后在临床上,可以对糖脂代谢异常的CHC患者进行NAFLD筛查,以早期发现病例,早期干预,延缓肝硬化等不良结局的出现。与此同时,血清A-FABP有可能成为干预NAFLD患者的新的切入点。本研究选择病例来自同一医院,研究结果可能存在一定的偏差,而且没有对入组患者进行治疗观察,有待扩大样本量进行多中心、前瞻性的干预研究,以进一步探究CHC合并NAFLD患者血清A-FABP检测的临床意义。
综上所述,CHC合并NAFLD患者血清A-FABP水平异常升高,其改变与患者糖脂代谢水平密切相关,而与病毒载量不相关。临床应对糖脂代谢指标异常和血清A-FABP水平升高的CHC患者进行NAFLD筛查,以早期发现合并症,进行合理的治疗指导和干预。合并NAFLD是否会对检测结果产生影响?是否会对抗病毒应答产生影响?这些患者的长期随访结局如何?都需要认真地随访研究。

