外泌体非编码RNA在肺癌肿瘤微环境中的作用*
林敏敏,何露露,王筝扬,齐宏妍,沈 静△
(1浙江大学医学院病理学与病理生理学系,浙江杭州 310058;2浙江大学医学院附属邵逸夫医院,浙江杭州 310058)
肺癌是全球发病率和死亡率第一的恶性肿瘤。2018 年约有210 万例新增肺癌患者及180 万死亡病例,严重威胁着各地人民的健康[1]。根据细胞的病理特征和分化程度,肺癌主要被分为非小细胞肺癌(non-small-cell lung cancer,NSCLC)和小细胞肺癌。前者占所有肺癌类型的85%左右[2-3],其主要亚型包括腺癌、鳞状细胞癌和大细胞癌。近年来,随着科学技术的飞速发展以及对细胞外囊泡,尤其是外泌体探索的日趋深入,外泌体检测逐渐成为液体活检技术的重要组成部分,为肺癌研究提供了新思路。
外泌体是一类直径为40~160 nm(平均100 nm)的细胞外囊泡,起源于核内体系统,通过质膜的双重内陷,形成含有腔内囊泡的多囊泡体。当多囊泡体与细胞膜融合后向细胞外基质胞吐时,腔内囊泡可以以外泌体的形式被分泌出去[4-5]。外泌体可以从各种体液中分离出来,包括血液、尿液、胸腔积液、唾液、母乳、羊水、腹水、脑脊液、胆汁和鼻分泌液。几乎所有的细胞类型,包括肿瘤细胞在内,都可以分泌外泌体[6]。近年来研究发现,外泌体作为一种重要的信号分子,含有多种生物活性分子如DNA、RNA、脂质、代谢物、蛋白质等,在肺癌发生发展过程中扮演着重要角色。外泌体从细胞中去除过量或不必要的成分以维持细胞稳态,还可以作为细胞间物质和信息交流的工具,不仅是细胞微环境也是肺癌微环境形成中的重要参与者,在血管生成、上皮-间充质转化(epithelial-mesenchymal transition,EMT)、侵袭转移、免疫逃避、耐药等多方面发挥作用,具有极好的临床应用前景[7-8]。
1 肺癌与外泌体非编码RNA(noncoding RNA,ncRNA)
随着过去十年的工作,我们对ncRNA 的认知从“垃圾”转录产物转变为介导染色质重塑、转录、转录后修饰和信号转导等细胞进程的功能性调节分子[9]。细胞内成千上万的独立ncRNAs 可以形成网络,影响众多分子靶标以驱动特定的细胞生物学反应。ncRNAs 作为生理和疾病过程中的关键调节因子,与癌症关系密切,在多种癌症中被鉴定为致癌或抑癌因子。各种研究表明,外泌体ncRNAs因受到外泌体膜的保护作用而具有较好的稳定性,在肺癌肿瘤微环境(tumor microenvironment,TME)中具有重要意义[10-11]。
根据ncRNA 的长度,我们以200 bp 为界将其分为长链非编码RNA(long noncoding RNA,lncRNA)和短链非编码RNA。短链非编码RNA 又包括微小RNA(microRNA,miRNA,miR)、环状RNA(circular RNA,circRNA)、核糖体RNA、小干扰RNA、核小RNA、转移RNA、PIWI 相互作用RNA 等[12]。外泌体源性的miRNA、lncRNA 和circRNA 近年来已被国内外肺癌研究领域所关注。本文将对外泌体ncRNA中miRNA 和lncRNA 在肺癌TME 中的作用进行总结,以增加我们对外泌体ncRNA 在TME 中功能的了解,并为开发基于外泌体ncRNA的抗肿瘤治疗策略提供基础。
2 外泌体ncRNA在肺癌TME中的作用
TME 通常指实体肿瘤附近区域,除肿瘤细胞外,还包含免疫细胞、间充质细胞、内皮细胞、细胞外基质以及肿瘤的酸性和低氧环境。TME 与肺癌细胞之间存在复杂、动态的相互作用。伴随着炎症反应,TME 可在促癌或抑癌中扮演不同角色,进而促进局部平衡[13]。近年研究表明,外泌体ncRNA 在肿瘤细胞与TME 细胞的沟通中起重要作用,可参与肿瘤的发生发展、血管生成、EMT、侵袭、转移、耐药等众多生物学过程[7],如图1所示。
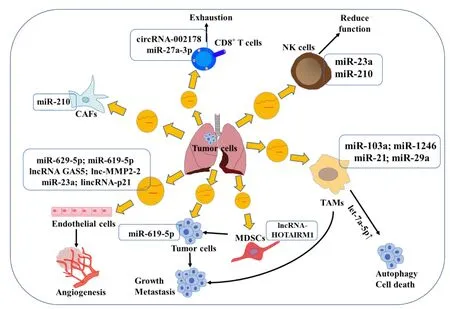
Figure 1.The role of exosome noncoding RNA in the microenvironment of lung cancer.Tumor cells secrete exosomes which contain diverse ncRNAs to modify tumors cells and stromal cells in the tumor microenvironment such as endothelial cells,myeloidderived suppressor cells(MDSCs),cancer-associated fibroblasts(CAFs),tumor-associated macrophages(TAMs),natu⁃ral killer(NK)cells for their own advantage.图1 外泌体ncRNA在肺癌肿瘤微环境中的作用
2.1 外泌体ncRNA 与内皮细胞 血管内皮细胞是TME 的重要组成部分,可影响肿瘤血管的生成。肺癌细胞外泌体来源的miRNA 在肿瘤血管浸润过程中起着重要作用。Li 等[14]发现,miR-629-5p 与肺腺癌的侵袭能力呈正相关,其经由外泌体进入内皮细胞后,可通过靶向抑制非典型钙黏蛋白CELSR1(cadherin,EGF LAG seven-pass G-type receptor 1)的表达增加内皮细胞的单层通透性和血管生成。Kim等[15]进一步研究发现,miR-619-5p 还可靶向抑制内皮细胞和肺癌细胞中的钙调磷酸酶调节因子1(regu⁃lator of calcineurin 1,RCAN1),从而发挥既促进肿瘤细胞增殖和转移,又促进内皮细胞血管生成的双重作用。除miRNA 外,lncRNA 也被发现可影响肿瘤新生血管的形成。最近的研究表明,lncRNA GAS5(growth arrest-specific 5)不仅在肺癌组织及血清外泌体中水平较低,而且在肺癌细胞(A549、H1299 和95D)及其外泌体中的水平明显低于正常人支气管上皮细胞[16]。lncRNA GAS5可与第10号染色体缺失的磷酸酶及张力蛋白同源蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)竞争性结合miR-29-3p,从而起到上调PTEN 表达、抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/AKT)通路的作用。转化生长因子β(transforming growth factor-β,TGFβ)是最重要的EMT 诱导剂之一。Wu 等[17]发现,经TGF-β 预处理的A549 肺癌细胞,其培养上清来源外泌体能够显著增强血管内皮细胞的通透性。进一步研究发现,lncRNA MMP2-2 在TGF-β 处理后的细胞外泌体中高度富集,继而通过增加内皮细胞基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)的表达,调节肺癌细胞向血管的侵袭和迁移。另一方面,TME 的缺氧环境也可通过增加肺癌细胞来源外泌体中特定ncRNA 的表达,促进肿瘤血管生成。如缺氧可诱导miR-23a分泌增加,作用于内皮细胞的紧密连接蛋白ZO-1以及脯氨酰羟化酶PHD1/2,导致缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)激活,增加血管通透性并破坏内皮细胞的完整性,从而促进肺癌侵袭[18]。lncRNA lincRNA-p21 在低氧NSCLC 细胞(H23 和HCC44)中表达明显升高,可促进血管形成和肿瘤细胞对内皮的黏附作用[19]。进一步研究发现,4 种血管生成和转移相关的miRNA(miR-23a、miR-146b、miR-330 和miR-494)在高lin⁃cRNA-p21 表达的细胞外囊泡中显著增加。总之,肿瘤细胞来源外泌体ncRNAs 可通过多种机制调控内皮细胞的生物学行为,进而影响肺癌的血管形成和疾病进展。
2.2 外泌体ncRNA 与浸润免疫细胞 免疫细胞作为肿瘤微环境的重要组分,可以特异性地识别和清除肿瘤细胞。而肿瘤细胞也可以抑制免疫细胞的功能,逃避免疫系统的识别和攻击,从而发生免疫逃逸。在肺癌肿瘤微环境中,外泌体ncRNAs在免疫细胞与肿瘤细胞之间的信号交换过程中起着重要作用,与疾病的预后密切相关。
2.2.1 外泌体ncRNA 对“抗肿瘤免疫细胞”的调控 T 细胞在机体杀伤肿瘤细胞的过程中发挥重要作用。表达CD8 的细胞毒性T 细胞(cytotoxic T-lym⁃phocyte,CTL)可识别特定的肿瘤抗原,分泌穿孔素、肿瘤坏死因子等效应分子,参与抗肿瘤的细胞免疫。Wang 等[20]证实肺腺癌细胞(A549、PC9 和95D)可经由外泌体将circRNA-002178 转移至肺癌细胞,进而通过靶向结合miR-34 促进程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)的表达。同时,circRNA-002178 还可以转移至CD8+T 细胞中,通过抑制miR-28-5p 增加程序性细胞死亡蛋白1(pro⁃grammed cell death protein 1,PD1)的表达,诱导T 细胞衰竭。Fan等[21]的研究发现,肥胖肺腺癌患者的诱导性共刺激分子(inducible costimulatory molecule,ICOS)水平升高,这一结果可能是肥胖个体脂肪细胞外泌体miR-27a-3p水平下调所致。ICOS 是T 细胞行使功能时必不可少的共刺激分子,而miR-27a-3p 可以直接抑制ICOS,两者表达存在负相关。低miR-27a-3p 水平的外泌体可以促进ICOS+T 细胞增殖和干扰素γ 的分泌,增强抗肿瘤免疫反应,在免疫治疗中发挥作用。
树突状细胞在启动先天性和适应性免疫反应中起重要作用,它能高效摄取、加工处理和递呈肿瘤相关抗原。成熟的树突状细胞能有效激活T 细胞,以刺激宿主抗肿瘤免疫反应。肿瘤细胞可以诱导肿瘤微环境的免疫抑制效应。研究发现肺癌细胞来源外泌体可以阻断树突状细胞分化并诱导细胞凋亡[22],抑制树突状细胞向淋巴结的迁移以降低T 细胞免疫反应。外泌体miRNA 也可以直接抑制自然杀伤(natural killer,NK)细胞的抗肿瘤免疫反应。据Berchem 等[23]报道,低氧肿瘤外泌体对NK 细胞的抑制作用明显大于常氧外泌体。低氧肺癌外泌体分泌高水平的miR-23a 和miR-210,它们通过两种机制参与NK 细胞的细胞毒性杀伤过程。一方面,外泌体源性miR-23a通过靶向NK 细胞中CD-107a亚型并降低其水平,从而抑制NK 细胞的抗肿瘤免疫反应;另一方面,低氧肿瘤来源外泌体通过转移TGF-β 至NK 细胞,降低其表面活化性受体NKG2D(natural killer group 2,member D)的表达,进而抑制NK 细胞的功能。
2.2.2 外泌体ncRNA 对“促肿瘤免疫抑制细胞”的调控 骨髓来源的肿瘤相关巨噬细胞(tumor-associ⁃ated macrophages,TAMs)是浸润在肿瘤微环境中的一群异质性巨噬细胞,功能类似于M2 型巨噬细胞。与M1 亚型分泌肿瘤坏死因子、白细胞介素12/23 等而具有抗肿瘤作用不同,M2 亚型巨噬细胞往往高表达白细胞介素10、CC 家族趋化因子配体20 等,并促进肿瘤进展[24]。肺癌细胞外泌体ncRNA 可以调控TAMs介导的免疫调节。例如,肺癌细胞A549和SKMES 来源的外泌体可转移miR-21 和miR-29a 至人巨噬细胞,激活巨噬细胞中Toll 样受体(Toll-like recep⁃tors,TLR)家族的TLR8 和TLR7,继而诱导TLR 介导的促炎症细胞因子的分泌和NF-κB的活化[25]。
同时,TAMs也可以通过外泌体ncRNA介导肿瘤免疫应答,影响肺癌细胞的生长转移和血管生成等过程。例如,巨噬细胞外泌体来源的miRNA let-7a-5p 可以通过靶向Bcl-2 样蛋白1(Bcl-2-like protein 1,BCL2L1)抑制肺癌细胞的增殖、迁移和侵袭[26]。进一步研究发现,let-7a-5p的过表达可以通过PI3Kγ信号通路促进肿瘤的自噬和细胞死亡,但不影响肺癌细胞的凋亡和坏死。TAMs 会分泌细胞因子,如表皮生长因子、血小板衍生生长因子、血管内皮生长因子等促进血管生成。Hsu等[27]发现,巨噬细胞可摄取缺氧肺癌细胞外泌体来源的miR-103a,增加血管内皮生长因子和血管生成素1 的表达,从而增强肺癌的血管生成和迁移、侵袭。同时,miR-103a还可直接作用于抑癌基因PTEN,从而激活PI3K/AKT 和信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号传导通路,并促进巨噬细胞向M2 亚型转化。另一项研究也发现,p53 突变的癌细胞可产生富含miR-1246 的外泌体,通过被巨噬细胞摄取促进其分化成M2 亚型[28]。这些结果提示外泌体ncRNA 在调控TAMs 向M2 型巨噬细胞极化过程中起重要作用,可能作为抗肿瘤免疫治疗的潜在靶点。
骨髓来源的抑制细胞(myeloid-derived suppres⁃sor cells,MDSCs)是一种具有免疫抑制功能的未成熟骨髓来源细胞群,是TME 的主要成分之一。在生理条件下,这些未成熟的骨髓细胞可以立即分化为成熟的粒细胞、单核细胞和巨噬细胞,但是在肿瘤等疾病条件下,MDSCs的分化受阻,从而导致其数量增加[29]。最近的一项研究表明,lncRNA HOTAIRM1 可增加MDSCs 中同源异形盒基因A1(homeobox A1,HOXA1)的表达,进而促进抗肿瘤免疫应答;肺癌患者外周血中的HOTAIRM1 水平显著下降,通过调节MDSCs的免疫作用加速肿瘤进程[29]。
由于肿瘤免疫疗法在目前的抗肿瘤治疗中发挥着不可忽视的作用,阐明外泌体ncRNA 调控肿瘤微环境免疫应答的分子机制,可为我们将外泌体ncRNA 作为新型非侵入性生物标志物用于癌症诊断、寻找新的治疗靶点、改善临床肿瘤免疫治疗提供新的方向。
2.3 外泌体ncRNA 与肿瘤相关成纤维细胞(cancerassociated fibroblasts,CAFs)CAFs 被认为是“活化的成纤维细胞”,具有显著的表型异质性,是TME 中最丰富的基质细胞之一,与肿瘤进展密切相关。Fan等[30]的研究发现,肺癌细胞可通过外泌体转移miR-210 到成纤维细胞,靶向抑制TET2(ten-eleven trans⁃location 2)的表达,从而诱导成纤维细胞转化为CAFs。miR-210 还可通过激活成纤维细胞的Janus激酶2(Janus kinase 2,JAK2)/STAT3 通路,诱导CAFs 分泌多种促血管生成因子如基质金属蛋白酶2、成纤维细胞生长因子2、血管内皮生长因子等,并募集内皮祖细胞,从而促进肿瘤血管生成。除影响肺癌发生发展的进程外,CAFs 也参与转移前肿瘤微环境的营造,在肿瘤转移中起着重要作用。例如miR-1247-3p 可以随着外泌体到达转移前微环境,调控受体细胞的生物学信息,更好地适应转移性生长,促进肺转移[31]。
2.4 外泌体ncRNA 与间充质干细胞(mesenchymal stem cells,MSCs)MSCs 是一种普遍存在于结缔组织的多能间充质细胞,能分化成软骨细胞、骨细胞、脂肪细胞等。Wang 等[32]的研究发现,肺癌细胞可以通过外泌体抑制MSCs 的成骨和成脂分化。进一步分析lncRNA 转录组表达模式,发现大约9%的ln⁃cRNA 在肺癌外泌体处理后发生表达变化。表明肺癌外泌体可以通过影响lncRNA 表达谱刺激MSCs 进入活化状态。
肺癌细胞还可以将MSCs 募集到肿瘤微环境中,并通过摄取其外泌体miRNA 影响肿瘤进展。最近的一项研究表明,来自低氧骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的外泌体被邻近肺癌细胞摄取后,可以通过携带的miR-193a-3p、miR-210-3p 和miR-5100,激活肺癌细胞STAT3 信号通路,增加间质相关分子表达,诱导EMT 发生,进而促进肺癌细胞侵袭能力[33]。此外,Liang 等[34]发现,携带miR-144 的BMSCs 外泌体可以通过下调NSCLC 细胞的细胞周期蛋白E1(cyclin E1,CCNE1)和细胞周期蛋白E2(cyclin E2,CCNE2)表达水平,抑制肿瘤的生长和转移。
3 外泌体ncRNA介导肺癌细胞之间的通讯
3.1 外泌体ncRNA 与肺癌细胞增殖转移等 肺癌细胞在增殖、迁移等能力上存在显著异质性。越来越多的研究表明,肺癌细胞之间可通过外泌体ncRNA 促进或抑制自身的增殖和迁移潜能,诱导肿瘤细胞入侵血管。Wu 等[35]的研究发现,miRNA-96是侵袭性肺癌的生物标志物,其表达水平随着NSCLC 细胞侵袭性的增强而升高。富含miR-96 的高侵袭性细胞外泌体可被低侵袭性细胞摄取,进而通过靶向抑制LIM 域特有蛋白7(LIM-domain only protein 7,LMO7)增强细胞活力、迁移能力和顺铂耐药性。此外,Zhang 等[36]发现NSCLC 患者血清外泌体中lncRNA MALAT-1 水平显著升高,可促进肺瘤细胞的生长、迁移并抑制其凋亡。He 等[37]发现,更高骨转移能力的肺癌细胞,其外泌体中miR-499a-5p水平更高。用高表达miR-499a-5p 的细胞外泌体处理细胞,可显著促进肺腺癌细胞的增殖、迁移和上皮间质转化能力,且这一过程可能与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路相关。TGF-β 是最重要的EMT 诱导剂之一。研究表明,TGF-β 预处理的A549 细胞外泌体中ln⁃cRNA MMP2-2[17]和miR-23a[38]水平升高。通过外泌体作用,lncRNA MMP2-2 可增加未经TGF-β 处理A549 细胞中MMP2 的表达,提高肺癌细胞的迁移和侵袭能力;miR-23a 可以刺激A549 细胞TCF4/βcatenin 的转录活性,激活经典的Wnt 信号通路,诱导肺癌细胞的EMT状态。
3.2 外泌体ncRNA 与肺癌细胞的耐药性 耐药是临床上常见的问题,吉非替尼和厄洛替尼属于一代表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EG⁃FR-TKIs),随着使用增加获得性耐药成为主要的临床问题。耐吉非替尼细胞可以转移外泌体miRNA[39](如miR-21[40]和miR-522-3p[41])于敏感细胞,通过激活AKT 信号通路诱导耐药。Lei 等[42]发现,lncRNA H19 在耐吉非替尼细胞系中表达显著升高,异生胞核核糖核蛋白A2/B1(heterogeneous nuclear ribonu⁃cleoprotein A2/B1,hnRNPA2B1)可通过结合lncRNA H19 的5'端特异性基序(GGAG),介导其装载入外泌体中,从而转移吉非替尼耐药性。Zhang 等[43]发现,血清外泌体lncRNA RP11-838N2.4 高表达的患者存在厄洛替尼抗性,且lncRNA RP11-838N2.4 在耐厄洛替尼细胞中表达明显增高,并且可以通过外泌体转移,使敏感细胞也拥有耐药性。
除了EGFR-TKIs 耐药,Wei 等[44]发现,耐吉西他滨的A549 细胞可通过外泌体转移miR-222-3p 至吉西他滨敏感细胞,从而增加耐药性。此外,外泌体miR-222-3p 可靶向吉西他滨敏感细胞的细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS3)基因,增加细胞的增殖、迁移、侵袭和抗失巢凋亡能力。Qin 等[45]发现,耐顺铂的A549 细胞可以通过外泌体miR-100-5p 增加受体细胞的顺铂敏感性,其机制可能与mTOR 信号通路相关。Tang 等[46]分析了肺癌患者放射治疗前后的血清miRNA,发现miR-208a 在放疗后显著增加。进一步研究发现,miR-208a 可通过外泌体转移到其他肺癌细胞,并通过靶向p21/AKT/mTOR 信号通路,促进肺癌细胞增殖并诱导放射抗性。
3.3 外泌体ncRNA 与肺癌干细胞(lung cancer stem cells,LCSC)LCSC 是肿瘤组织内一群具有干细胞特性的细胞,具有自我更新、增殖分化和较强的成瘤性。它们可能是肺癌的起源细胞,并经由外泌体ncRNA 介导在肺癌的发生发展、侵袭转移、抗辐射和耐药性获得等方面起至关重要的作用。例如,Wang等[47]发现,肺癌干细胞外泌体miR-210-3p 可以通过靶向肺癌细胞的成纤维细胞生长因子样受体1(fi⁃broblast growth factor receptor-like 1,FGFRL1)基因,增强肺癌细胞的迁移和侵袭能力,上调N-钙黏蛋白、波形蛋白和基质金属蛋白酶1/9的表达水平,并下调E-钙黏蛋白的表达。Rodrigues 等[48]发现,基质来源的细胞因子白细胞介素6、粒细胞集落刺激因子和激活素A 等可以介导肺癌细胞向肺癌干细胞的去分化过程。进一步研究发现,清除这些细胞因子和/或阻断外泌体介导的通讯,可以抑制该过程。
4 结语与展望
外泌体ncRNAs 在肺癌肿瘤微环境中扮演重要角色(表1):肺癌细胞可以向其他癌细胞、内皮细胞、间充质细胞和免疫细胞分泌含特定ncRNA 的外泌体,激活受体细胞信号通路,调控靶基因的表达,诱导血管生成、EMT和免疫逃逸等,促进癌症的发生发展;相反,免疫细胞、间充质细胞、内皮细胞和其他基质细胞也可以将外泌体传递给肺癌细胞,影响肿瘤细胞的增殖、侵袭和转移等。我们实验室的前期研究发现,肺癌患者的恶性胸腔积液与结核患者的良性胸腔积液相比,外泌体来源的miRNA和lncRNA表达谱发生显著改变,其中部分差异上调的miRNA 可与差异lncRNA 发生相互作用,进而通过协同作用参与对肺癌侵袭和转移能力的促进。然而,目前肿瘤外泌体研究中仍面临一些问题亟待解决:首先,微量外泌体ncRNA 的分离和鉴定方法需进一步优化,基于单个外泌体的技术可提高研究的分辨率,并大大加速其临床转化和应用;其次,不同细胞来源的外泌体如何将内容物准确转移到特定靶细胞的机制仍需阐明;再者,外泌体在肺癌诊断、预后以及疗效监测等临床过程中具有良好的应用前景,但相关研究的通量和重复性仍有待提高;最后,将外泌体ncRNA应用于临床靶向治疗亟需开发兼具安全性和高效率的递送工具。总之,外泌体作为细胞间遗传物质等信息沟通的有效载体,已成为研究肿瘤发病机制和开发液体活检技术的有力工具,将为肺癌的诊断和治疗开辟崭新的领域。

表1 外泌体ncRNA在肺癌肿瘤微环境中的作用Table 1.The role of exosomal ncRNA in the microenvironment of lung cancer
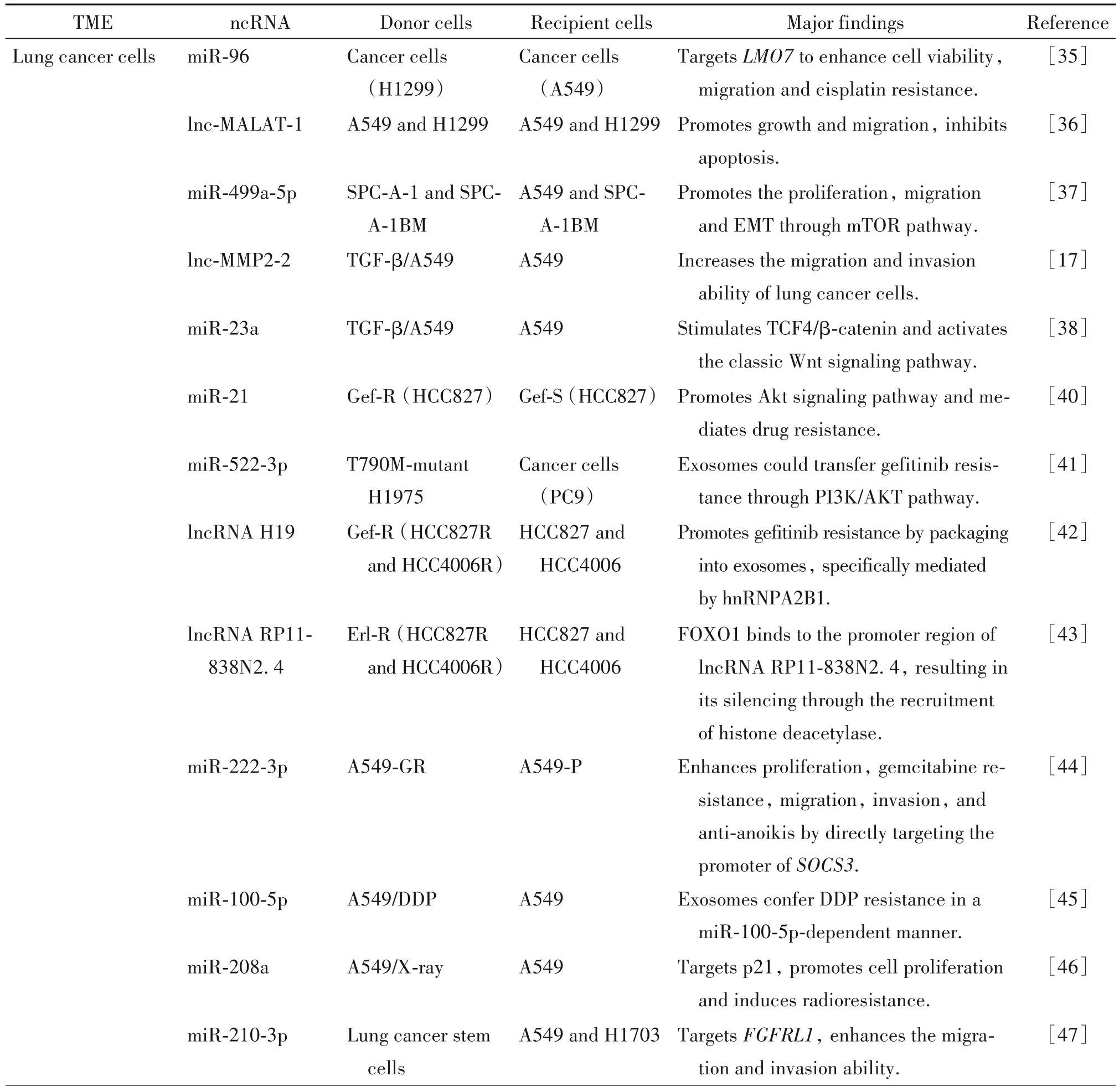
Table 1.(continued)
- 中国病理生理杂志的其它文章
- miR-23b通过靶基因Cxcl12调控肾性高血压*
- 基于冷冻电子显微术的阳离子通道结构与功能研究进展*
- 淫羊藿苷通过抑制内质网应激减轻异丙肾上腺素诱导的H9c2细胞肥大损伤*
- 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5-羟色胺代谢异常*
- 肠道ChREBP缺陷导致小鼠对果糖不耐受*
- Spheroid transplantable and functional retinal pigment epithelium derived from non-colony dissociated human induced pluripotent stem cells*

