壳聚糖基印迹水凝微球对Cr (VI)的选择性吸附研究
蔡伟成,郭牧林
(南京水利科学研究院 水利部水工新材料工程技术研究中心,江苏 南京 210029)
随着全球工业化的迅猛发展,重金属污染问题日益突出。我国在2015 年和2016 年颁布的《水污染防治行动计划》[1]和《土壤污染防治行动计划》[2]中明确提出:加强涉重金属行业的污染防控与治理;2018 年颁布的《关于加强涉重金属行业污染防控的意见》[3]中提出:到2020 年涉重金属重点行业排放量要比2013 年下降10%。目前去除水环境中重金属最常用的方法是沉淀法,会产生二次污染。而吸附法具有处理工艺简单、价格低廉、可塑性强和无二次污染等优点[4],但传统材料(活性炭、氧化铝、分子筛等)逐渐难以满足对成分复杂的水环境中重金属高效去除的要求;新型有机材料往往合成单体有毒性,不易降解回收。因此,研究高效低耗、生态环保的重金属吸附材料具有一定意义。
壳聚糖(Chitosan,CTS)无毒、易降解且含有大量活性功能基团,是一种理想的重金属吸附材料。有学者发现CTS 粉末对咖啡酸的吸附性能较好[5]。但作为粉末或片状材料,吸附过滤中存在水通量小、过滤阻力大且难以回收易造成水体的二次污染。近年来凝胶材料因其三维网状结构具有多孔隙结构、良好的亲水性而受到关注,相比于普通微球、树脂以至粉末吸附材料,凝胶材料可以溶胀并保有大量的水,有利于与废水中污染物进行传质[6]。例如:文献[7]以羧甲基纤维素和淀粉为基材,合成具有超大吸水量的复合凝胶微球;Wang 等[8]以聚乙烯醇和聚(丙烯酸-丙烯酰胺)制备复合凝胶材料,不仅具有超强的吸水性能,且对重金属的吸附量达到184 mg/g。而目前基于CTS 的凝胶微球用于水环境中Cr (VI)选择性去除的研究较少。因此,本文利用凝胶材料的特点,以CTS 为基材,通过离子印迹改性手段制备Cr (VI)-CTS 离子印迹凝胶球(Cr (VI)-CTS Ion-imprinted Gel Beads,CTS-IGB),对CTS-IGB 在Cr (VI)单一溶液和复杂混合溶液(模拟电镀废液)中对Cr (VI)的吸附行为特征及选择性去除能力进行研究。
1 试验内容
试验所用试剂主要有CTS(脱乙酰度87%)、乙酸、氢氧化钠、重铬酸钾等,均为市售分析纯。去离子水由实验室自制。
CTS-IGB 的制备过程如下:称取适量CTS 置于稀乙酸中,搅拌溶解4 h,然后将CTS 溶液逐滴滴入氢氧化钠溶液中,固化沉降30 min 后洗去碱液;随后取一定量上述产物加入到100 mg/L 的重铬酸钾溶液中预配位,2 h 后加入一定量交联剂进行交联反应1 h;最后置于碱液中将Cr (VI)模板洗脱,得产物CTS-IGB。
将约0.25 g CTS-IGB 放入Cr (VI)的单一溶液或者混合溶液中,于设定pH 值、设定温度下吸附一定的时间,通过电感耦合等离子体发射光谱仪(iCAP 6300, Thermo Fisher Scientific, United Kingdom)测定溶液Cr (VI)的质量浓度,通过式(1)计算吸附量。含Cr (VI)的混合溶液为模拟工业电镀废水,含有Cr (VI)、40 mg/L Ni (II)、Cr (III)、PO43-和SO42-。

式中:Q为Cr (VI)吸附量(mg/g);V为Cr (VI)溶液体积(L);C0和C1分别为吸附前和吸附后溶液中Cr (VI)质量浓度(mg/L);m为CTS-IGB 的质量(g)。
CTS-IGB 对Cr (VI)的选择性通过Q1/Q2表示,其中Q1和Q2分别指对混合溶液和单一Cr (VI)溶液中Cr (VI)的吸附量。所有吸附试验重复3 次,每次相对偏差不超过5%,结果取平均值。
2 结果与讨论
2.1 pH 值影响
pH 值决定CTS-IGB 的表面性质,影响Cr (VI)在溶液中的存在形态,与水解、配位、静电引力和氧化还原等反应有关。因此,本研究首先探究不同pH 值下CTS-IGB 对单一Cr (VI)溶液和混合溶液中Cr (VI)吸附量的影响,结果如图1 所示。
可以看出,随着溶液pH 值的增大,CTS-IGB 对单一Cr (VI)溶液和混合溶液中的Cr (VI)的吸附量均减小,在pH 值为3 时,吸附量均最大。这是因为在酸性溶液中,CTS 上的-NH2、-OH 易质子化变成-NH3+、-OH2+,与以阴离子态[9](主要为HCrO4-和Cr2O72-)存在的Cr (VI)通过静电引力而产生吸附作用,这与文献[10]结果一致:Cr (VI)的吸附不是全部与吸附材料表面的-NH2和-OH 通过配位键相结合,而是主要以静电引力结合。随着pH 值的增大,去质子化程度增加,静电引力减小,随之吸附量减小。此外,随着pH 值的增大,溶液中OH-含量逐渐增多,也出现了OH-和Cr (VI)阴离子的竞争吸附效应现象。
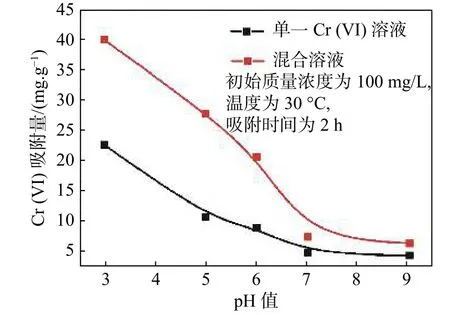
图 1 CTS-IGB 在不同pH 值下对单一Cr(VI)溶液和混合溶液中Cr(VI)吸附量Fig. 1 Effect of pH on Cr (VI) adsorption capacity of CTS-IGB in single Cr (VI) solution and mixed solution
2.2 吸附动力学
图2 为单一Cr (VI)溶液和混合溶液中Cr (VI)吸附量随时间的变化曲线。可以看出,CTS-IGB 对Cr(VI)的吸附在30 min 内吸附速率很快,均能达到各自饱和吸附量的70%以上,因为在吸附初期,微球含有大量活性印迹位点;180 min 后吸附基本趋于饱和,此时吸附量分别达到37.4 和44.3 mg/g。
此外发现,CTS-IGB 对混合溶液中Cr (VI) 的吸附量大于单一溶液中Cr (VI) 的吸附量。可能主要有两个影响因素:一是混合溶液中的共存离子(电解质)能压缩双电层厚度,减弱了Cr (VI)和CTS-IGB的静电引力作用,不利于吸附;二是Cr (VI) 质量浓度较高时,尤其是凝胶材料含有大量的水,Cr (VI)集聚在材料表面,阴离子之间的静电斥力阻碍吸附,但混合溶液中的共存离子(电解质)能减弱Cr (VI)之间的静电斥力,从而有利于吸附。从结果上看,后者的作用大于前者的作用[11]。
为更进一步研究其吸附动力学特征,采取准一级吸附动力学模型(式(2))[12]和准二级吸附动力学模型(式(3))[13]对Cr (VI)吸附数据进行拟合分析(图3),探究吸附机理。

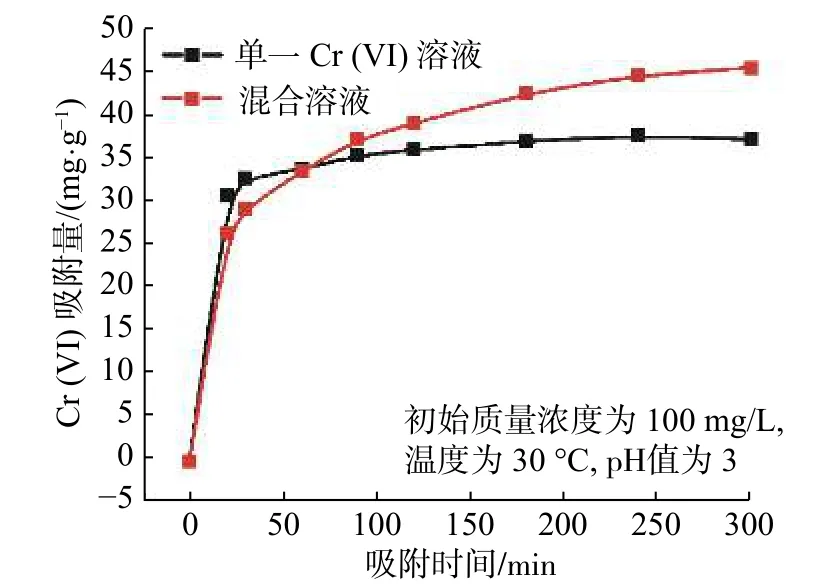
图 2 CTS-IGB 对Cr (VI)的吸附量随时间的变化曲线Fig. 2 Curves of adsorption capacity of CTS-IGB to Cr(VI)with time
式中:qe为平衡吸附量(mg/g);qt为时间t时刻的吸附量(mg/g);k1为准一级动力学速率常数(1/min)。以时间t为X坐标,以lg (qe-qt)为Y坐标,通过线形图的Y轴截距求出qe,通过线形图的斜率求出k1。

式中:k2为准二级动力学速率常数(g/(mg·min))。以时间t为X坐标,t/qt为Y坐标,通过线形图的斜率可求出qe,通过线形图的Y轴截距可求出k2。

图 3 CTS-IGB 对Cr (VI)的准一级和准二级吸附速率回归方程Fig. 3 Plots of pseudo-first-order and pseudo-second-order of CTS-IGB
一般认为,符合准一级动力学模型的属于物理吸附,吸附速率与吸附材料表面未占据位点数成正比。符合准二级动力学模型的为化学吸附,吸附材料通过静电吸引、电荷交换等形成化学吸附。从图3 可以看出,CTS-IGB 对Cr(VI)在单一Cr(VI)溶液和混合溶液的准二级动力学模型相关系数(R2=0.999 和R2=0.998)均大于准一级动力学模型的相关系数(R2=0.944 和R2=0.969)。因此,可用准二级动力学模型来描述CTS-IGB 对Cr(VI)的吸附行为过程。
半饱和吸附时间t1/2指吸附材料吸附一半饱和吸附量所需的时间,通常用来表征吸附材料的吸附速率。吸附材料在后期吸附速率很慢,因此不会等到吸附材料达到饱和才更换,半饱和吸附时间对吸附应用更具有实际意义。将半饱和吸附时间t1/2代入准二级动力学线性式可得在单一Cr (VI)溶液和混合溶液的半饱和吸附时间t1/2分别为5.8 和23.5 min,说明在短时间内CTS-IGB 就能达到饱和吸附量的一半。查阅文献对比半饱和吸附时间例如:Tavengwa 等[14]制备Quaternized Poly (4-VP)微球,在pH 值为4、温度为25 ℃时,t1/2为15 min。Wang 等[15]制备的KF/PAN 纤维,在pH 值为4.5、温度为30 ℃时,t1/2为20 min。相比之下,本研究的CTS-IGB 在吸附速率上有一定的优势。
为更进一步阐明CTS-IGB 具有快速吸附的能力,通过光学显微镜和环境扫描电镜对CTS-IGB 的形貌特征进行观测,如图4 所示。可以看出,CTS-IGB 内部具有丰富的三维网状多孔结构,有利于Cr (VI)的快速交换,使CTS-IGB 不同于普通微球而具备较快的吸附速率。

图 4 CTS-IGB 微观结构Fig. 4 Microstructure of CTS-IGB
2.3 吸附等温线
吸附等温线阐述在固定温度下,当吸附系统达到平衡时CTS-IGB 与Cr (VI)之间的数学关系,表征了CTS-IGB 的吸附性能,为热力学研究提供最基本的参数。图5 为单一Cr (VI)溶液和混合溶液在不同Cr(VI)初始质量浓度和不同温度下CTS-IGB 对Cr (VI)的吸附量。

图 5 CTS-IGB 对单一Cr(VI)溶液和混合溶液的吸附等温线Fig. 5 Adsorption isotherms of CTS-IGB on single Cr (VI) solution and mixed solution
如图5 所示,CTS-IGB 对Cr (VI)单一溶液和混合溶液中Cr (VI)的吸附量随着Cr (VI)初始质量浓度的增大而增大,Cr (VI) 质量浓度越高,功能基团与其结合概率越大,Cr (VI)吸附量相应增大。随着CTSIGB 功能基团的消耗,Cr (VI)吸附量逐渐趋于饱和。此外发现,在单一Cr (VI)溶液中,吸附量随着温度的升高而减小,而在混合溶液中,Cr (VI)吸附量受温度的影响较小。
使用Langmuir(式(4))[16]、Freundlich(式(5))[17]和Temkin(式(6))[18]吸附等温模型对CTS-IGB 的吸附数据进行拟合(图6 和7)。并由表1 中拟合相关系数R2可以看出,Freundlich 等温吸附模型的拟合效果最好,说明CTS-IGB 具有非均一的吸附表面,CTS-IGB 对Cr (VI)具有不同的吸附能,而且是多分子层吸附。Kf随着温度的升高逐渐降低,说明吸附是放热过程,随着温度升高而吸附作用力逐渐减弱。

图 6 不同温度下单一Cr (VI)溶液吸附等温模型的线性拟合Fig. 6 Linear fit of adsorption isothermal model of single Cr (VI) solution at different temperatures
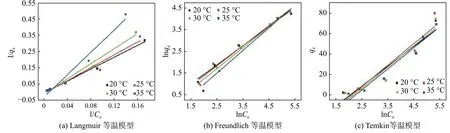
图 7 不同温度下混合溶液吸附等温模型的线性拟合Fig. 7 Linear fit of adsorption isothermal model of mixed solution at different temperatures

表 1 CTS-IGB 吸附等温拟合参数Tab. 1 Isotherm parameters for CTS-IGB

式中:qm为理论最大的吸附量(mg/g);Ce为吸附平衡时溶液中的Cr (VI) 质量浓度(mg/L);KL为Langmuir 吸附平衡常数(L/mg)。以1/Ce为X坐标,1/qe为Y坐标,Y轴截距为1/qm,直线斜率为1/(qmKL)。

式中:Kf为Freundlich 吸附平衡常数;n为非均质系数。以lnCe为X坐标,lnqe为Y坐标,Y轴截距为lnKf,直线的斜率为1/n。

式中:KT为Temkin 吸附平衡常数。以lnCe为X坐标,qe为Y坐标,Y轴截距为BTlnKT,直线斜率为BT。
2.4 吸附热力学
吸附热力学假设吸附体系孤立存在,热能变化是体系的唯一动力。通过前两节吸附数据计算该研究体系热力学参数,进一步研究吸附过程能量变化,计算如式(7)和(8)。

式中:K0为热力学平衡常数;T为开尔文温度(K);R为理想气体常数(R=8.314 J/(mol·K))。以qe为X坐标,ln(qe/Ce)为Y坐标,线性拟合可得Y轴截距为lnK0。以lnK0为X坐标,1/T为Y坐标,线性拟合得斜率为通过式(8)得ΔS0,结果见表2。
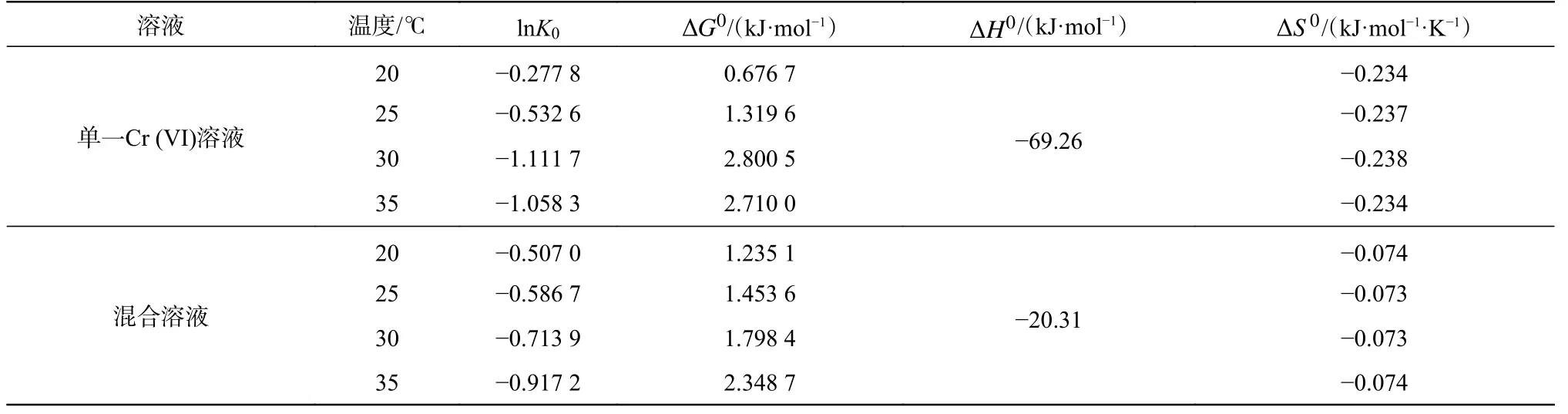
表 2 吸附热力学参数Tab. 2 Adsorption thermodynamic parameters
CTS-IGB 在不同温度下对Cr (VI)吸附的ΔG0均为正值,说明吸附过程在热力学上是非自发进行的。CTS-IGB 对Cr (VI)的吸附焓主要包括Cr (VI)吸附焓、分子链间作用力、链规整性破坏及构相变化所需能量、水分子脱附焓等,吸附过程总ΔH0是各个过程ΔH0的总和。对于此吸附体系来讲,Cr (VI)的吸附必然导致分子间氢键的改变,分子构象稳定性变差,会消耗较多的能量,表现为吸热;而Cr (VI)的吸附焓会放出一定热量,但是总体上多于总的吸热量,因此,ΔH0均为负值,说明该吸附反应为放热反应,升高温度不利于对Cr (VI)的吸附。单一Cr (VI)溶液比混合溶液吸附的ΔH0绝对值大,说明温度对Cr (VI)吸附量更加敏感,这与吸附等温线的数据相一致。ΔS0均为负值,表明吸附反应中表面无序度减小,熵减小。溶液中的Cr(VI)都是溶剂化的,当Cr (VI)吸附于CTS-IGB 表面,这些水分子会脱落,变为自由运动的状态,使得体系的无序度增大,但是,吸附反应对于吸附质Cr (VI)而言是无序度减小的过程,整个体系的总ΔS0为负是为Cr (VI)吸附(无序度减小)和水分子脱附(无序度增大)共同作用的结果。
2.5 吸附选择性
研究了CTS-IGB 在混合溶液(模拟电镀废水)和双组份干扰离子(金属阳离子、阴离子、表面活性剂等)下Cr (VI)的选择性,结果如表3 所示。在混合溶液中,相比于未改性CTS,CTS-IGB 对Cr (VI) 的选择性提高50%以上;而在F-/Cr (VI)、Cu2+/ Cr (VI)、C18H29SO3-/ Cr (VI)、Pb2+/ Cr (VI)四组双组份混合溶液中,CTSIGB 均呈现较好的离子选择性,选择性提高均在30%以上。因为在印迹凝胶球表面存在大量与Cr (VI)形状大小、电荷、三维结构等相一致的识别空穴位点,更容易识别出Cr (VI),尤其是对阳离子作为共存离子时选择性最高。

表 3 CTS-IGB 对Cr (VI)的吸附选择性Tab. 3 The Cr (VI) selectivity for CTS-IGB
3 结 语
通过离子印迹技术制备CTS-IGB 凝胶微球,研究其在单一Cr (VI)溶液和混合溶液(模拟电镀废水)中对Cr (VI)的吸附性能,试验结果表明:
(1)CTS-IGB 对单一Cr (VI)溶液和混合溶液中Cr (VI)的吸附量随pH 值的增大而逐渐减小,在pH 值为3 时对Cr (VI)的吸附量最大。温度为20 ℃、pH 值为3 时,CTS-IGB 对单一Cr (VI)溶液和混合溶液中Cr (VI)的饱和吸附量分别达到37.4 和44.3 mg/g,半饱和吸附时间最少仅为5.8 min,吸附行为均符合准二级动力学原理。
(2)吸附等温线拟合结果符合Freundlich 等温吸附模型,属于多分子层吸附。热力学参数表明吸附是放热反应且吸附后无序度减小,升高温度不利于吸附。相比于未改性材料,CTS-IGB 在共存干扰离子存在下对Cr (VI)的选择性能提高32%~74%。

