miR-133b通过介导TGF-βR1表达下调对食管癌细胞侵袭、迁移的抑制作用
米卫国,张 伟,刘建军,张昭鹏,杨 帆
陕西省汉中市中心医院胸外科,陕西汉中 723000
食管癌是全球常见的消化道恶性肿瘤,在世界范围内发病率居第7位,病死率居第6位[1]。晚期食管癌患者远处转移是其预后不良和高病死率的主要原因[2-3]。微小RNA(miRNA)是一种具有调节作用的非编码小RNA,通过靶向调节基因表达水平,在癌症的发生、发展和转移中起着重要的作用[4]。有研究报道,miR-133b的表达水平和食管癌的病理分级及预后密切相关[5-6],与食管癌的恶性进展密切相关。转化生长因子-β受体1(TGF-βR1)是miR-133b的靶基因之一,是转化生长因子-β(TGF-β)/SMAD3信号通路的关键蛋白,TGF-β/SMAD3信号通路激活[7-8]在诱导肿瘤细胞发生上皮间质转化(EMT),促进肿瘤细胞侵袭和迁移中发挥重要作用[9]。但关于食管癌中miR-133b是否通过调控其靶基因TGF-βR1激活TGF-β/SMAD3信号通路,促进食管癌的侵袭和迁移的研究鲜见报道。因此,本研究拟明确miR-133b通过调控其靶基因TGF-βR1发挥对食管癌侵袭和迁移的作用及机制,为进一步探讨miR-133b作为治疗食管癌侵袭和迁移的作用靶点提供一定的实验基础。
1 材料与方法
1.1材料来源 人食管癌OE19、ECA109细胞,人正常食管上皮细胞(HEEC细胞)均购自美国典型培养物保藏中心(ATCC);胎牛血清、RPMI1640细胞培养基购自Hyclone公司;Opti-MEM细胞培养基购自Gibco公司;抗菌药物(青霉素、链霉素)、胰蛋白酶均购自中国Solarbio公司;兔抗TGF-βR1抗体、兔抗SMAD3抗体均购自Cell Signaling Technology公司;兔抗p-SMAD3、兔抗E-cadherin、兔抗N-cadherin、兔抗β肌动蛋白(β-actin)抗体均购自Bioworld Technology公司;RNA提取试剂盒、Trizol、蛋白提取裂解液均购自碧云天生物科技有限公司;miR-133b mimic、miR-133b negative control(miR-133b NC)、WT-TGF-βR1、MUT-TGF-βR1荧光素酶报告基因载体均购自上海吉玛公司;Lipofectamine(R) 3000购自ThermoFisher公司;双荧光素酶报告基因试剂盒(RG027)购自碧云天生物科技有限公司。
1.2方法
1.2.1细胞培养 人食管癌OE19、ECA109细胞和HEEC细胞,均采用无菌且含10%胎牛血清和1%抗菌药物(青霉素、链霉素)的RPMI1640培养液在37 ℃、5%CO2的无菌细胞培养箱中培养。
1.2.2实时荧光定量PCR(qPCR)检测方法 收集对数生长期的人食管癌OE19和ECA109细胞,以HEEC细胞为对照。采用RNA提取试剂盒提取RNA:加入Trizol裂解液,匀浆,加氯仿,室温5 min,离心,转移上层水相,加异丙醇,室温10 min,离心,去上清液,加75%乙醇振荡混合,4 ℃离心,去上清液,EP管放置干燥,加入焦碳酸二乙酯水充分溶解RNA;采用qPCR检测RNA浓度;引物序列设计见表1,反转录合成cDNA,PCR反应(PCR反应条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s)检测miR-133b基因水平,基因的相对表达水平以2-ΔΔCt计算。引物序列由上海吉玛公司合成并鉴定,见表1。
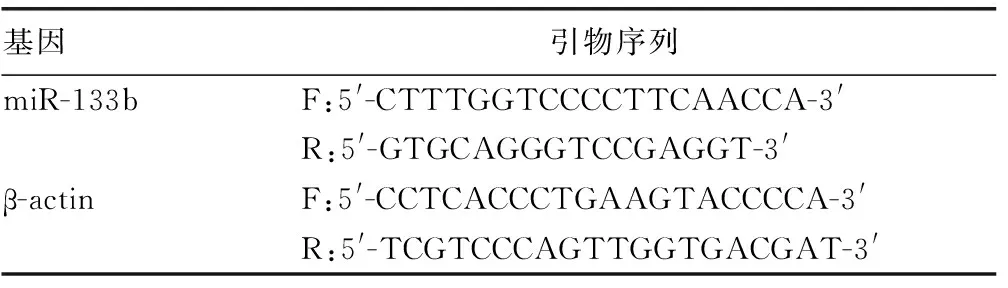
表1 PCR试验引物序列
1.2.3细胞转染 转染前24 h,将食管癌OE19、ECA109细胞以1×106个/孔的密度接种到6孔板中。次日,冰浴上吸取miR-133b mimic和miR-133b NC各6 μg,用预冷的无血清Opti-MEM培养基250 μL分别稀释,轻轻混匀后,在室温无菌台中静置5 min。同时吸取Lipofectamine(R) 3000转染试剂8 μL,用预冷的无血清Opti-MEM培养基250 μL稀释,轻轻混匀后,在室温无菌台中静置5 min。5 min后,分别混合Lipofectamine(R) 3000转染试剂、miR-133b mimic和miR-133b NC的稀释液,每份500 μL,轻轻混匀,室温无菌台上静置20 min。6孔板中细胞用无血清Opti-MEM培养基漂洗2次,每孔加入混合液500 μL。置于37 ℃、5%CO2培养箱中孵育6 h,然后更换含10%胎牛血清和1%抗菌药物(青霉素、链霉素)的RPMI1640培养液,继续培养48 h,用于后续实验。
1.2.4Transwell小室实验检测细胞侵袭和迁移能力 迁移实验:取对数生长期的人食管癌OE19、ECA109细胞和转染了miR-133b mimic(过表达miR-133b,OE miR-133b)、miR-133b NC的人食管癌OE19、ECA109细胞,调整细胞密度,吸取0.2 mL细胞悬液接种于24孔板的Transwell小室中,使细胞密度为4×104个/孔,小室下层相应加入含30%胎牛血清培养液600 μL,将Transwell小室置于孵箱中培养。培养24 h后弃掉Transwell小室内外液体,加入磷酸盐缓冲液(PBS)洗涤3次,然后每孔加入4%多聚甲醛1 mL,在室温条件下固定10 min。弃去多聚甲醛,用PBS洗涤3次。之后在Transwell小室孔中加入0.1%结晶紫1 mL,室温条件下染色10 min。用PBS洗涤3次,棉签擦掉Transwell上室中未迁移的细胞。然后将小室置于显微镜下拍照,随后在新的24孔板中放置小室,并加入33%冰乙酸800 μL进行脱色,振荡5 min使之充分溶解。用酶联免疫检测仪在570 nm波长下读取吸光度值(A570),观察细胞的迁移能力。
侵袭实验:用无血清的4 ℃预冷细胞培养液在冰浴上稀释Matrigel胶。稀释比例为培养基∶基质胶=9∶1;取100 μL稀释的基质胶加到Transwell上室中,置于37 ℃孵箱中孵育2 h,使基质胶充分胶凝。以下步骤同迁移实验。用酶联免疫检测仪在570 nm波长下读取A570,观察细胞的侵袭能力。
1.2.5蛋白免疫印迹(Western blot)法检测蛋白水平 收集对数生长期的人食管癌OE19、ECA109细胞,收集转染了miR-133b mimic和miR-133b NC的人食管癌OE19、ECA109细胞,每组收集的细胞加入蛋白裂解液220 μL,置冰浴上30 min提取细胞蛋白。以13 000 r/min低温高速离心20 min,弃去细胞沉淀,收集上清液。用考马斯亮蓝法进行蛋白定量。以40 μg蛋白量作为上样量,在6%浓缩胶、12%分离胶上进行SDS-PAGE电泳。湿法进行电转移,将电泳分离后的蛋白转移至NC膜上。用5%脱脂奶粉室温条件下封闭1.5 h,按照常规滴加一抗(TGF-βR1、SMAD3、p-SMAD3、E-cadherin、N-cadherin、β-actin,1∶1 000稀释),4 ℃孵育过夜。次日常温复温1 h,磷酸盐吐温缓冲液(PBST)洗膜3次,每次5 min。加山羊抗兔二抗(1∶8 000稀释),室温下孵育1.5 h。然后用PBST洗膜3次,每次5 min。最后在化学发光仪中显影,灰度扫描,以β-actin为内参。结果与β-actin比值做统计分析,检测TGF-βR1、SMAD3、p-SMAD3、E-cadherin、N-cadherin蛋白水平。
1.2.6双荧光素酶报告基因试验检测miR-133b对TGF-βR1的靶向调控 通过TargetScan数据库(http://www.targetscan.org)和miRPathDB数据库(https://mpd.bioinf.uni-sb.de/mirnas.html)检索,分析发现TGF-βR1的3′UTR区域可与miR-133b结合。通过上海吉玛基因有限公司构建野生型(WT)和突变型(MUT)基因靶点TGF-βR1的3′UTR荧光素酶报告基因载体(WT-TGF-βR1和MUT-TGF-βR1)。取对数生长期的人食管癌OE19、ECA109细胞接种于24孔板中,使细胞密度为5×104个/孔。采用Lipofectamine(R)3000转染试剂共转染WT-TGF-βR1、MUT-TGF-βR1和miR-133b NC、miR-133b,共转染36 h后,使用双荧光素酶报告基因试剂盒,严格按照说明书要求,检测萤火虫荧光素酶反应强度和内参海肾荧光素酶反应强度,计算2组数据比值进行统计学分析,观察miR-133b对TGF-βR1的靶向调控,实验重复3次。
2 结 果
2.1miR-133b在人食管癌OE19、ECA109细胞和HEEC细胞中的相对表达水平比较 结果显示,miR-133b在HEEC细胞中的相对表达水平为1.08±0.09,在人食管癌OE19、ECA109细胞中的相对表达水平分别为0.61±0.06、0.53±0.08,与HEEC细胞比较,人食管癌OE19、ECA109细胞中miR-133b的相对表达水平明显下调,差异均有统计学意义(P<0.01)。
2.2成功构建了过表达miR-133b的人食管癌OE19、ECA109细胞 采用miR-133b mimic和miR-133b NC,应用Lipofectamine(R) 3000转染试剂转染人食管癌OE19、ECA109细胞,qPCR检测转染细胞中miR-133b的相对表达水平。结果显示,转染细胞培养48 h后,转染miR-133b NC、miR-133b mimic的HECC细胞中miR-133b的相对表达水平分别为1.03±0.06和0.97±0.06,而转染miR-133b mimic的人食管癌OE19、ECA109细胞中miR-133b的相对表达水平分别为2.57±0.12和2.33±0.13,与HEEC细胞比较,转染miR-133b mimic的人食管癌OE19、ECA109细胞中miR-133b的相对表达水平上调(P<0.01),表明过表达miR-133b的人食管癌OE19、ECA109细胞构建成功。
2.3miR-133b对人食管癌OE19、ECA109细胞的迁移和侵袭能力的影响 结果显示,与未转染的人食管癌OE19、ECA109细胞和转染miR-133b NC的人食管癌OE19、ECA109细胞比较,转染miR-133b mimic的人食管癌OE19、ECA109细胞的迁移和侵袭能力均降低(P<0.01),见图1、2。
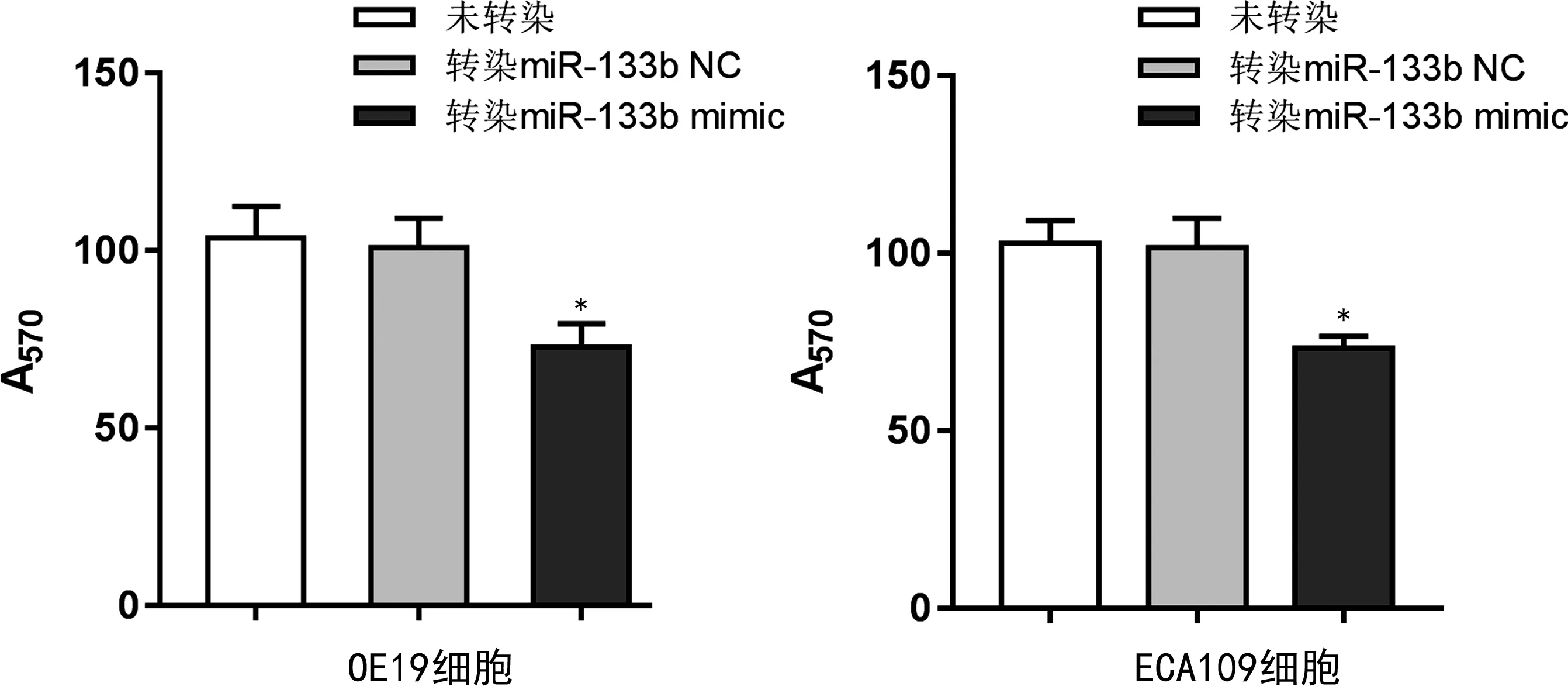
注:与未转染和转染miR-133b NC的比较,*P<0.01。
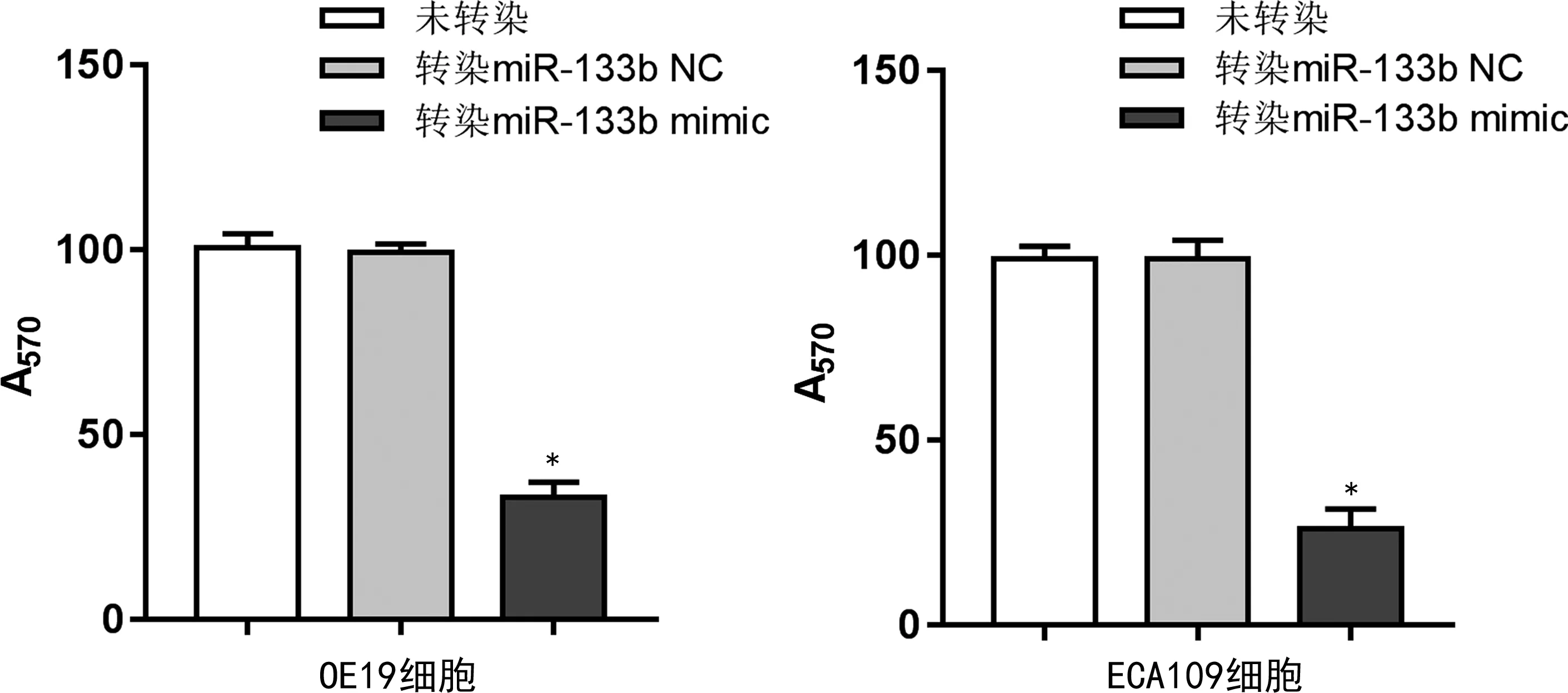
注:与未转染和转染miR-133b NC比较,*P<0.01。
2.4miR-133b对人食管癌OE19、ECA109细胞中TGF-βR1/SMAD3信号通路蛋白表达水平的影响 结果显示,与未转染和转染miR-133b NC的人食管癌OE19、ECA109细胞比较,转染miR-133b mimic的人食管癌OE19、ECA109细胞中的TGF-βR1、p-SMAD3、N-cadherin的蛋白水平下降,E-cadherin的蛋白水平升高,差异均有统计学意义(P<0.01),见图3。
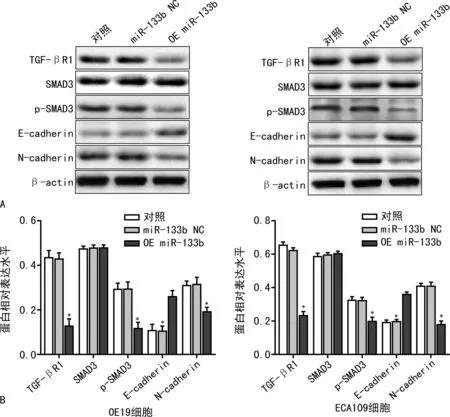
注:A为Western blot检测各蛋白水平;B为各蛋白相对表达水平。与对照比较,*P<0.01。
2.5miR-133b靶向调控TGF-βR1的表达 通过双荧光素酶报告基因试验检测发现,转染WT-TGF-βR1基因表达载体后,与转染miR-133b NC比较,转染miR-133b mimic的WT-TGF-βR1食管癌细胞的相对荧光素酶活性降低(P<0.01);转染MUT-TGF-βR1基因表达载体后,与转染miR-133b NC比较,转染miR-133b mimic的MUT-TGF-βR1食管癌细胞的相对荧光素酶活性差异无统计学意义(P>0.05),见图4。
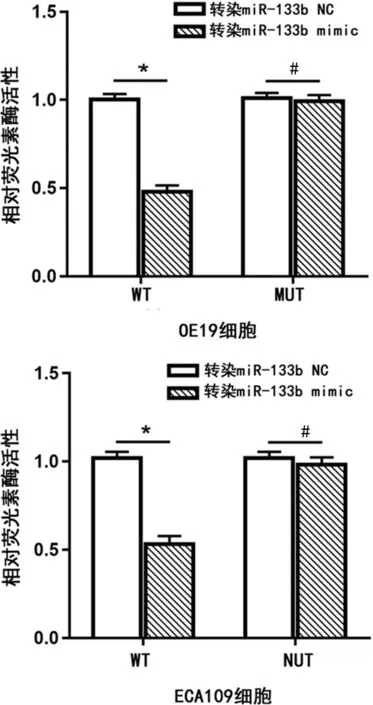
注:*P<0.01,#P>0.05。
3 讨 论
食管癌发生转移是其预后差、病死率高的主要原因[10],晚期食管癌转移患者临床治疗多采用化疗及放化疗结合的方法,但由于放疗的耐受性和药物选择性低等问题,其预后不佳,严重影响食管癌患者生活质量,因此迫切需要对调控食管癌发生转移的靶点进行研究[11-12]。
miR-133b在多种肿瘤中发挥重要作用[13],其在食管癌中的表达低于其癌旁组织,与食管癌的发生、发展密切相关,是治疗食管癌转移的潜在靶标[14]。TGF-βR1是miR-133b的靶基因,miR-133b通过靶向结合TGF-βR1的3′UTR端,负调控TGF-βR1的表达[8];有研究报道,miR-133b通过调控其靶基因TGF-βR1影响腺癌骨转移及乳腺癌EMT的发生[7-8]。TGF-βR1在诱导食管癌细胞发生EMT,促进食管癌细胞发生侵袭和迁移过程中发挥重要作用[15],TGF-βR1通过激活TGF-β/SMAD3信号通路,促进SMAD3发生磷酸化。磷酸化SMAD3入核后启动转录翻译,影响目的基因表达,介导肿瘤细胞EMT的发生[9-10]。而在EMT发生、发展过程中,E-cadherin、N-cadherin是标志物蛋白,E-cadherin表达减少,N-cadherin表达升高,减少细胞间黏附力,进而促进肿瘤细胞的侵袭和迁移[16-17]。
本研究通过qPCR检测HECC细胞和食管癌OE19和ECA109细胞中miR-133b的表达水平,结果发现,miR-133b在食管癌细胞中的表达水平明显低于HEEC细胞。通过miR-133b mimic转染食管癌OE19和ECA109细胞,成功构建过表达miR-133b的食管癌OE19和ECA109细胞,以miR-133b NC为对照组,采用Transwell小室实验观察过表达miR-133b的食管癌OE19和ECA109细胞,结果发现,与miR-133b NC比较,过表达miR-133b的食管癌OE19和ECA109细胞的侵袭和迁移能力明显下降(图1、2,P<0.01),表明miR-133b负调控食管癌细胞的转移能力。进一步机制研究表明,miR-133b靶蛋白TGF-βR1的水平在过表达miR-133b的食管癌OE19和ECA109细胞中明显下调,TGF-βR1/SMAD3信号通路中SMAD3的磷酸化水平明显下降,N-cadherin蛋白水平明显升高,E-cadherin蛋白水平明显降低(图3)。双荧光素酶活性检测结果显示,TGF-βR1的3′UTR区域可与miR-133b结合,miR-133b靶向调控TGF-βR1的表达。
综上所述,miR-133b在食管癌OE19和ECA109细胞中水平明显下调,可显著抑制食管癌细胞的侵袭和迁移能力,其作用机制是通过负调控其靶基因TGF-βR1的蛋白水平,抑制TGF-βR1/SMAD3信号通路活化,进而抑制食管癌细胞EMT的发生而降低其侵袭和迁移的能力。本实验结果将为miR-133b作为食管癌分子标志物的治疗应用提供一定的科学依据。

