牛磺酸对卵形鲳鲹肠道微生物及免疫功能的影响
马启伟 ,郭 梁, ,刘 波, ,刘宝锁, ,朱克诚, ,郭华阳, ,张 楠, ,杨静文, ,张殿昌,
(1. 上海海洋大学水产与生命学院,上海 201306; 2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300; 3. 广东省海洋生物种业工程技术研究中心,广东 广州 510300)
牛磺酸 (Taurine) 是一种β含硫氨基酸,化学名为2-氨基乙磺酸 (C2H7NO3S),以游离或者小肽的形式存在于组织中;牛磺酸在鱼体内具有多种生物学功能,在生长性能、神经调节、渗透调节、免疫应答、抗氧化状态、抗应激能力、解毒作用、配子质量、消化酶活性和肠道微生物菌群结构中发挥着重要作用[1-2]。有研究表明,植物性蛋白对鱼类的生长、免疫、肠道微生物菌群有显著性影响,植物性蛋白替代鱼粉不仅会导致鱼类免疫能力下降,还会造成肠道微生物菌群的改变;引起金鲷(Sparus aurata)[3]、大西洋鲑 (Salmo salar)[4]、大菱鲆 (Scophthalmus maximus)[5]、丝尾鳠 (Hemibagrus wyckioides)[6]、条石鲷 (Oplegnathus fasciatus)[7]、虹鳟 (Oncorhychus mykiss)[8]、日本鳗鲡 (Anguill japonica)[9]肠道菌群改变、形态异常并引发炎症反应。然而牛磺酸能够增加植物性蛋白代替鱼粉的使用量,缓解不良反应[10];一些研究证实饲粮中添加牛磺酸对不同大小和种类的鱼类肠道微生物菌群和肠道免疫产生有益影响;例如,饲粮中添加牛磺酸可有效缓解舌齿鲈 (Dicentrarchus labrax)[11]豆粕替代鱼粉产生的肠道异常并提高草鱼 (Ctenopharyngodon idella)[12]的肠道免疫功能。
鱼类肠道中的微生物菌群被称为宿主的第二基因组,是肠道黏膜屏障的重要组成部分,与机体免疫系统密切相关,肠道菌群的稳定保证了肠道健康,如果肠道菌群紊乱则极易引起宿主肠道疾病[13]。牛磺酸的多种生理功能已使其成为研究热点,然而,关于牛磺酸对水生动物肠道影响的资料有限,且多集中于消化酶代谢、肠道形态和屏障功能等方面,对肠道免疫的研究较少。Toll样受体 (TLRs)/NF-κB信号通路在先天免疫中发挥重要作用,TLRs将病原相关分子刺激信号转导入细胞内,导致NF-κB转录因子活化,能介导IL-1β以及TNF-α等炎症介质发挥其促炎作用[14]。牛磺酸和多种细胞因子之间存在潜在关系,牛磺酸能够抑制TLRs/NF-κB信号通路、改善炎症损伤,能够调节免疫基因在鱼肠道中表达[15];另外,当机体处于炎症时,牛磺酸产生的氯胺也具有抗炎和细胞保护作用[16]。
卵形鲳鲹 (Trachinotus ovatus) 为暖水性、中上层洄游鱼类,由于其生长迅速、肉质鲜美,已成为南海沿海地区重要的养殖鱼类[17]。研究表明以植物性蛋白替代鱼粉时,会对卵形鲳鲹生长、抗氧化和免疫,以及肠道微生物菌群产生显著性影响[18-20]。另外,本试验前期研究发现牛磺酸能够提高卵形鲳鲹生长性能和抗氧化能力[21];基于牛磺酸对植物性蛋白替代鱼粉产生的不利影响具有缓解作用,本试验旨在探讨牛磺酸对卵形鲳鲹肠道微生物菌群和免疫方面的影响,为明确植物蛋白替代饲料中添加牛磺酸是否影响鱼体内肠道菌群多样性及免疫功能提供有力证据,以期为卵形鲳鲹健康养殖提供理论基础。
1 材料与方法
1.1 试验饲料及饲养管理
试验以鱼粉、发酵豆粕和玉米蛋白粉作为蛋白源,鱼油作为脂肪源,共配制了5种不同牛磺酸添加量的等氮等脂饲料,所有饲料原料粉碎后过40目筛网,加入鱼油和水混匀,经过制粒机 (G-500,华南理工大学) 制成2.5 mm的沉性饲料颗粒,于4 ℃密封保存。基础试验日粮粗蛋白和粗脂肪质量分数分别为427和100 g·kg−1;灰分和水分质量分数分别为83和101 g·kg−1;各组牛磺酸质量分数分别为 1.3 g·kg−1(T0)、4.4 g·kg−1(T1)、7.4 g·kg−1(T2)、10.5 g·kg−1(T3)、12.7 g·kg−1(T4)[21]。
饲养试验在海南省新村港进行,所有试验用鱼均采于中国水产科学研究院南海水产研究所,将750尾大小均一、体质健康的卵形鲳鲹 (81.0±0.5) g随机分配到15个网箱 (1 m×1 m×1.5 m) 中,随机分成5组 (每组150尾,分为3个平行)。试验开始前使用T0组饲料喂养1周,使试验鱼适应人工饲料与饲养环境。试验开始时试验鱼已饥饿24 h,然后每组鱼用相对应的饲料每天饱食投喂2次 (8:00和16:00),持续8周。试验期间温度28~32 ℃,pH 7.4~8.3,盐度 34~36,溶解氧质量浓度>6.0 mg·L−1。
1.2 样品采集
喂养阶段结束后,将鱼饥饿24 h,从每个网箱中随机取9尾,用丁香酚 (上海医疗器械股份有限公司) 麻醉,使用2.5 mL不含肝素的注射器从尾静脉采血,离心后 (3 000×g, 4 ℃, 10 min) 取血清于−20 ℃保存;冰上解剖取其肠道,剔除肠道周边脂肪,每一样品单独放于对应的2 mL冻存管中,液氮速冻,−80 ℃保存,用于肠道微生物分析(n=9) 和免疫基因的表达 (n=9)。
1.3 血清免疫指标测定
根据酶活试剂盒 (北京华英生物技术研究所)说明书,测定补体C3/C4和免疫球蛋白 (IgA、IgG、IgM) 的含量和溶菌酶 (LZM) 活性。
1.4 肠道微生物多样性测定
1.4.1 DNA提取及PCR扩增 按照天根DNA试剂盒 [ 天根 (北京) 生化科技有限公司 ] 说明书提取卵形鲳鲹肠道细菌DNA,使用1%琼脂糖凝胶电泳检测完整性,Nanodrop 2000检测纯度和浓度。无菌水稀释DNA样本至1 ng·μL−1,使用特异性引物对细菌16S rDNAV3–V4可变区进行PCR扩增,PCR 反应体系 (30 μL) 为 15 μL 的 Phusion Master Mix (新英格兰生物实验室)、3 μL的正反引物、10 μL (5~10 ng) 的模板 DNA、2 μL 的 ddH2O。PCR反应条件为98 ℃预变性1 min;98 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环30次;72 ℃延伸5 min。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;对目的条带使用胶回收试剂盒(Qiagen,德国) 回收产物。引物序列见表1。
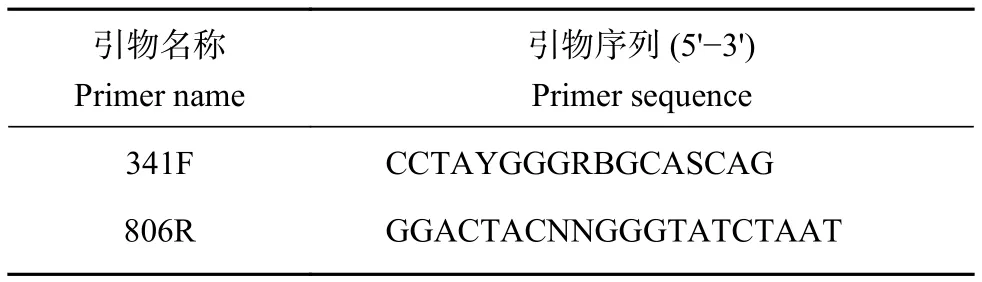
表1 细菌16S rDNA V3—V4可变区引物Table 1 Bacterial 16S rDNA V3–V4 corresponding primers
1.4.2 文库构建和上机测序 使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,经过Qubit和Q-PCR定量保证文库合格后,基于Ion S5 XL测序平台,利用单端测序的方法,完成16S V3–V4区域测序。
1.4.3 测序数据处理 从下机数据中拆分出各样本数据,截去Barcode和引物序列后,使用FLASH(V 1.2.7, http://ccb.jhu.edu/software/FLASH/) 对每个样本的reads进行拼接,得到的拼接序列为原始数据。对原始数据进行过滤去除干扰序列,得到有效的高质量数据。
利用Uparse软件 (Uparse V7.0.1001, http://www.drive5.com/uparse/)对有效数据进行OTUs聚类和物种分类分析;依据其算法原则,筛选出OTUs的代表序列 (OTUs中出现频数最高的序列),用Mothur方法与SILVA132 (http://www.arbsilva.de/) 对每个OTU的代表序列做物种注释,使用MUSCLE (V3.8.31, http://www.drive5.com/muscle/)软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。得到对应的物种信息和基于物种的丰度分布情况。同时对OTUs进行丰度、Alpha多样性 (ACE指数、Chao1指数、香农-威纳指数、辛普森指数) 计算、Beta多样性 (主坐标分析和NMDS分析) 分析,以得到样品内物种丰富度和均匀度信息。利用R软件 (V 2.15.3) 绘制稀释曲线。
1.5 肠道免疫基因表达分析
卵形鲳鲹肠道总RNA使用总RNA提取试剂盒 (广州美基生物科技有限公司) 提取,NanoDrop 2000 (Thermo Scientific, USA) 和1%琼脂糖凝胶电泳检测浓度和质量;使用PrimeScript™ with gDNA Erase逆转录试剂盒逆转录得到cDNA,−20 ℃保存备用。
使用Primer Premier 5设计ToTLR1、ToTLR2、ToNF-kB P65、ToTNF-α、ToIL-1β和ToIL-10 的特异性引物,以卵形鲳鲹EF-1α作为内参[22],引物序列见表2。使用Roche LightCycler 480 II进行基因表达测定,qPCR反应体系为12.5 μL,1 μL cDNA 模板 (60 ng·μL−1),1 μL 正反引物,4.25 μL ddH2O和6.25 μL SYBR Pre-mix ExTaq;反应条件为95 ℃ 预变性30 s,95 ℃ 变性5 s,60 ℃ 退火30 s,72 ℃延伸30 s,循环40次。每个样品设3个重复,试验数据使用2−△△CT进行计算[23]。

表2 卵形鲳鲹肠道免疫基因引物序列Table 2 Real-time quantitative PCR primers for immune related genes in T.ovatus
1.6 数据分析
以上数据采用SPSS 22.0 (IBM) 软件进行处理和单因素方差 (One-way ANOVA) 分析,结果用“平均数±标准误 (X±SE) ”表示,若差异达到显著水平 (P<0.05),则采用Tukey's进行多重比较。
2 结果
2.1 肠道微生物分析
2.1.1 序列分析 通过对Reads拼接,平均每样品测得87 707条tags,经过质控平均得到82 257条有效数据,以97%的一致性将序列聚类成为OTUs,共得到5 382个OTUs。通过与数据库Silva132比对,进行物种注释,并对不同分类层级统计发现:能够注释到数据库的OTUs数目为5 130 (95.32%),门水平的比例为89.61%。试验组的稀释曲线和Rank Abundance曲线见图1,各组稀释曲线逐渐趋于平坦,说明测序数据量渐进合理,测序覆盖范围已基本达到样品中所有的物种。
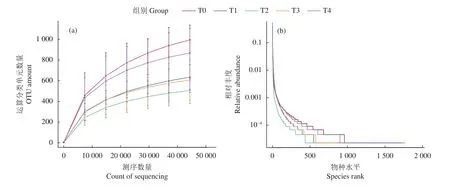
图1 卵形鲳鲹肠道微生物稀释曲线 (a) 和Rank abundance曲线 (b) (n=9)Figure 1 Rarefaction (a) and Rank abundance (b) curve of intestinal microbial diversity of T. ovatus
2.1.2 Alpha多样性分析 卵形鲳鲹肠道微生物Alpha多样性指数见图2,Alpha多样性可以反映样本内的微生物群落的丰富度和多样性变化,ACE指数和Chao1指数反映菌群丰富度,香农-威纳指数 (Shannon) 和辛普森指数 (Simpson) 反映菌群多样性,且两者间呈现正相关,数值越大,表示菌群的丰富度和多样性越高。Alpha多样性结果显示,随牛磺酸含量的增加,T1、T2和T3组的ACE指数和Chao1指数显著低于T0组 (对照组,P<0.05);T2组的香农-威纳指数和辛普森指数最低,香农-威纳指数显著低于T0和T4组,辛普森指数显著低于T0、T3和T4组 (P<0.05)。
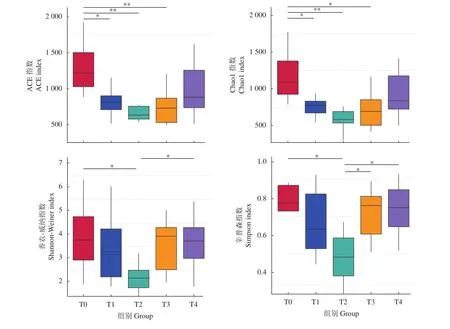
图2 牛磺酸对卵形鲳鲹肠道微生物Alpha多样性分析 (n=9)*. 差异显著 (P<0.05);**. 差异极显著 (P<0.01)Figure 2 Alpha diversity analysis of intestinal microbial diversity of T. ovatus*. Significant difference (P<0.05); **. Very significant difference (P<0.01)
2.1.3 Beta多样性分析 Beta多样性分析 (图3)可以评估肠道中物种复杂性方面的差异程度,距离越接近的样本,表示物种组成结构越相似,结构相似度高的样本倾向于聚集在一起;主成分 (PCoA)和无度量多维标定法 (NMDS) 分析显示,T1、T2和T3组倾向于聚集在一起,物种相似度较高;T1和T4组间样品距离较远,倾向于离散分布,物种组成结构相似度较低。
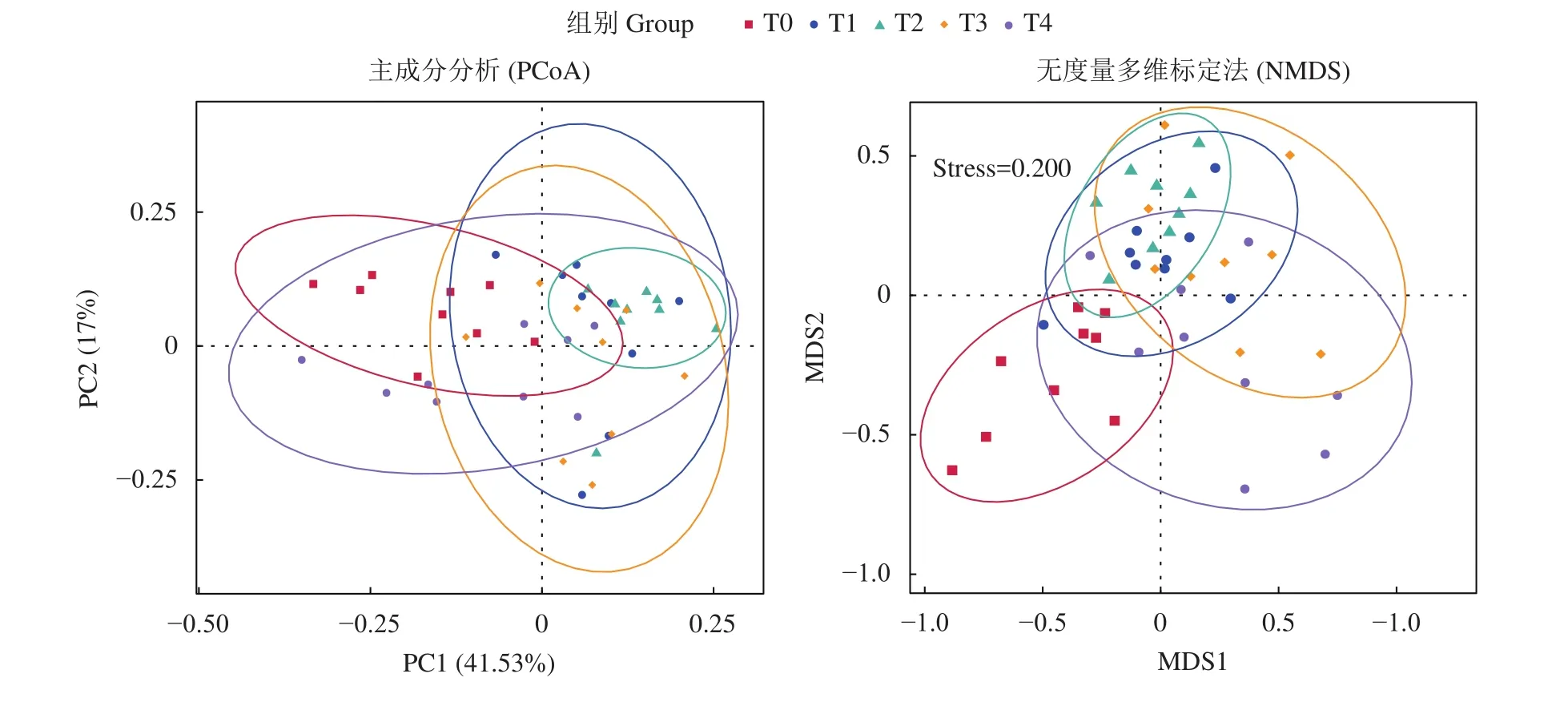
图3 卵形鲳鲹肠道微生物Beta多样性分析分析 (n=9)Figure 3 Beta diversity analysis of intestinal microbiota of T. ovatus
2.1.4 肠道菌群组成及其相对丰度分析 卵形鲳鲹在门水平肠道菌群组成及其相对丰度见图4,所有试验组肠道微生物菌群在门水平上主要注释到10个门和其他的未知微生物群体,占据主导地位的主要包括变形菌门、软壁菌门、螺旋体门。T0—T4组变形菌门相对丰度分别为19.6%、11.6%、10.8%、28.1%、41.1%。T0—T4组软壁菌门相对丰度分别为45.1%、60.4%、56.9%、33.2%、37.0%;T0—T4组螺旋体门相对丰度分别为23.0%、6.4%、12.8%、23.8%、4.1%。T0—T4组拟杆菌门相对丰度分别为1.5%、12.4%、8.7%、5.1%、4.2%。肠道菌群组成及相对丰度分析显示,随饲料外源牛磺酸含量的增加,试验组变形菌门、软壁菌门、螺旋体门和拟杆菌门的相对丰度出现显著性变化,TI和T2组变形菌门相对丰度较T0组分别减少了8.0%和8.8% (P<0.05);T1和T2组软壁菌门相对丰度较T0组分别增加了15.3%和11.8% (P<0.05);T1、T2和T4组螺旋体门相对丰度较T0组分别减少了16.6%、10.2%和18.9% (P<0.05);T1和T2组拟杆菌门相对丰度较T0组分别增加了10.9%和7.2% (P<0.05)。卵形鲳鲹在属水平肠道菌群组成及其相对丰度见图5,占据主导地位的主要包括支原体菌属、短螺旋体属和甲基杆菌属。T3和T4组支原体菌属相对丰度较T0组分别减少了17.4%和5.6% (P<0.05);T2和T3组短螺旋体属相对丰度较对照组分别增加了13.7%和12.2% (P<0.05);T2、T3和T4组甲基杆菌属相对丰度较T0组分别增加了3.3%、1.7%和1.4%。
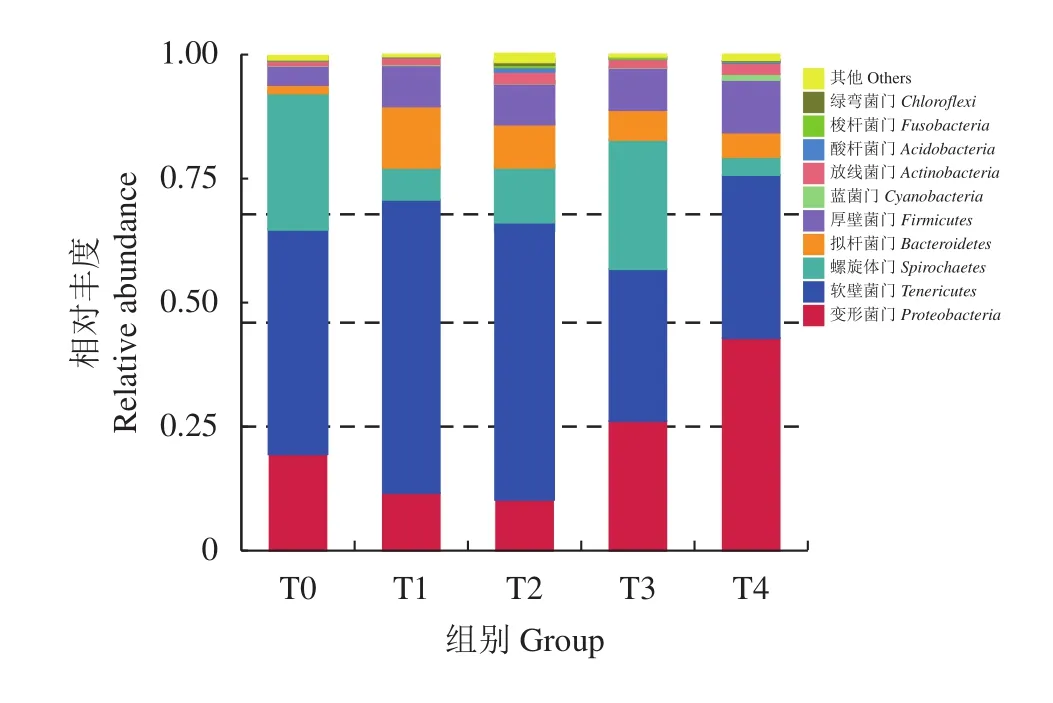
图4 基于门水平上的卵形鲳鲹肠道菌群物种相对丰度柱形图 (n=9)Figure 4 Bacterial relative abundance in intestine of T. ovatus at phylum level
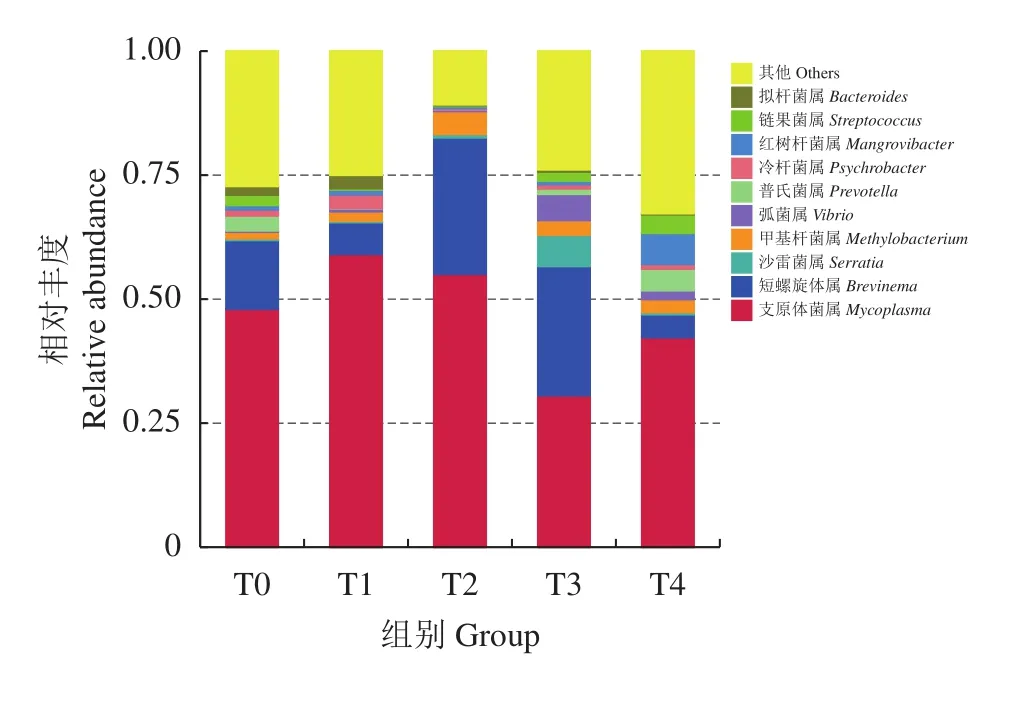
图5 基于属水平上的卵形鲳鲹肠道菌群物种相对丰度柱形图 (n=9)Figure 5 Bacterial relative abundance in intestine ofT. ovatus at genus level
2.2 血清免疫指标
牛磺酸对卵形鲳鲹血清免疫影响指标数据见表3。随外源性牛磺酸的摄入,T2、T3和T4组的溶菌酶活性显著提高 (P<0.05);T3组补体C4和免疫球蛋白 (A, G) 含量显著高于T0组 (P<0.05);各组间的补体C3和免疫球蛋白M含量无显著性差异 (P>0.05)。
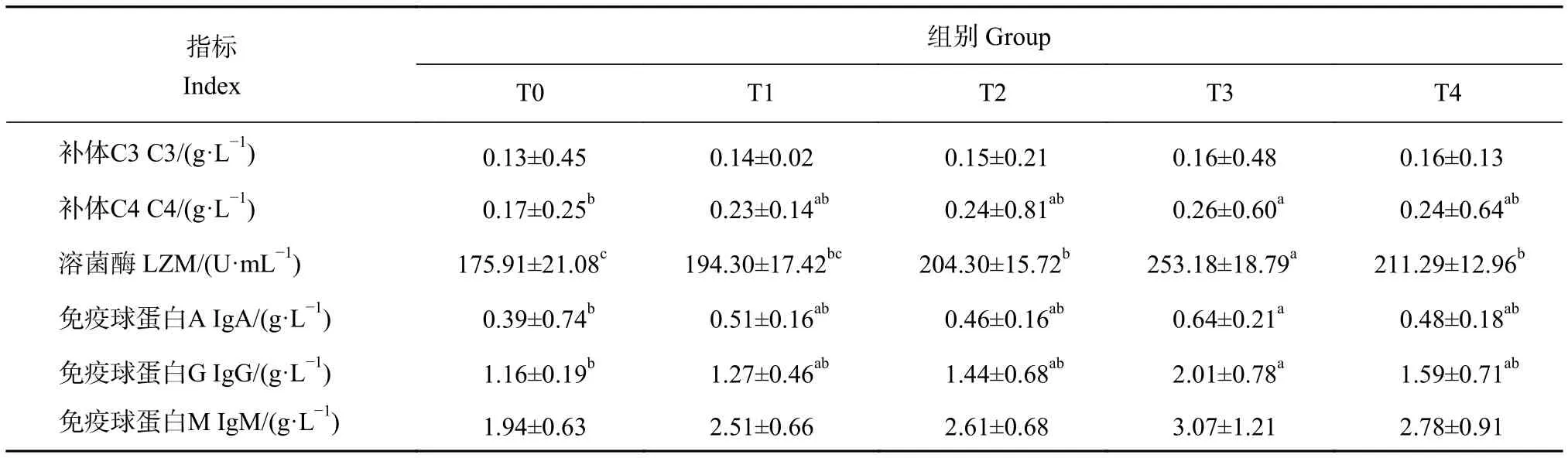
表3 牛磺酸对卵形鲳鲹血清免疫指标的影响Table 3 Effect of taurine on serum immune parameters of T. ovatus
2.3 肠道免疫基因表达
牛磺酸对卵形鲳鲹肠道免疫影响数据见图6。结果显示,牛磺酸对卵形鲳鲹肠道免疫基因的表达有显著性影响;随饲料牛磺酸含量的增加,ToTLR-1和ToTLR-2基因表达量呈现逐渐降低的趋势,试验组基因表达量显著低于对照组 (T0,P<0.05);T1、T2和T4组的ToNFkB P65表达量显著低于T0组 (P<0.05);T2、T3和 T4组的ToTNF-α和ToIL-1β的表达量显著低于T0组 (P<0.05);T3和T4组ToIL-10的表达量显著高于对照组 (P<0.05),T0、T1和T2组ToIL-10的表达量无显著性差异(P>0.05)。
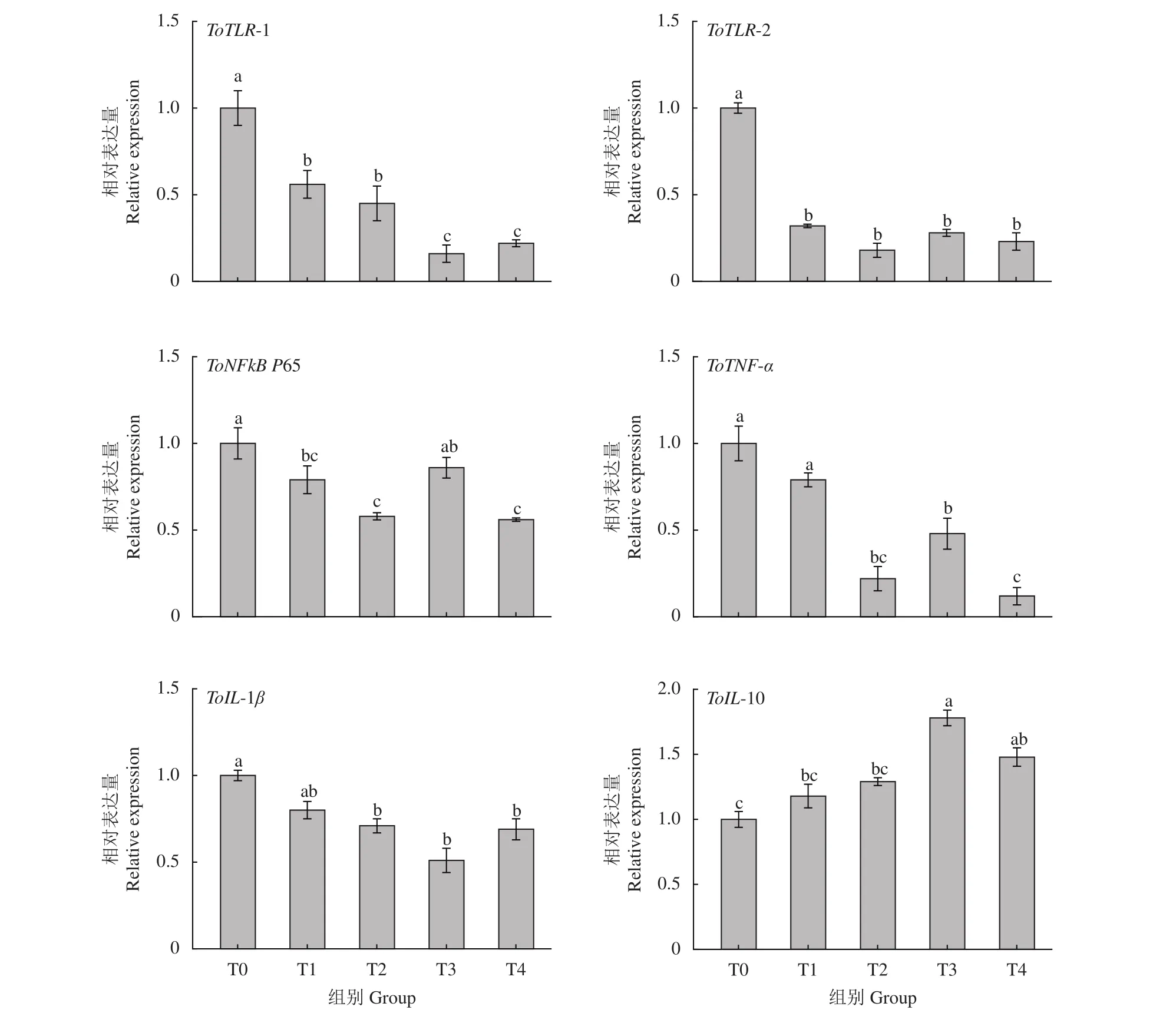
图6 免疫相关基因在卵形鲳鲹肠道中mRNA相对表达量Figure 6 Relative expression levels of immune-related genes in intestine of T. ovatus
3 讨论
肠道微生物与宿主的健康息息相关,在营养物质转化、吸收和免疫应答中起着重要作用;肠道微生物菌群提供了一个可操纵的肠道环境,为改善鱼体健康,预防和治疗疾病提供重要平台。鱼类肠道微生物菌群多样性和结构特征会受到多种因素的影响,包括遗传背景、栖息环境,饲料成分 (添加剂)、成长阶段、药物 (抗生素) 等[25]。牛磺酸是十二指肠和结肠上皮细胞中最丰富的游离氨基酸,有着多种生物学功能,广泛用于食品添加剂行业[26]。有研究显示,牛磺酸能导致肉鸡小肠长度、上皮细胞增殖和小肠结构相关的性能变化[27];能够调节大
鼠肠道微生态,抑制有害细菌的生长;能够改变猪肠道黏膜的形态并促进肠黏膜损伤的修复[28];在水生动物中,牛磺酸已经确定在多种鱼类体内扮演重要角色,对肠道微生物及肠道免疫应答具有显著性影响。本试验中,肠道菌群Alpha多样性和Beta多样性分析结果显示,饲料中牛磺酸含量能够调节肠道微生物菌群的丰富度和多样性,改变肠道菌群结构;在卵形鲳鲹肠道菌群组成中占据主导地位的主要包括变形菌门、软壁菌门、螺旋体门,这与已有研究一致[29]。在不同种类生物中,肠道菌群组成和丰度往往存在很大差异,这与环境因子和饲养条件有很大关系,另外,正常与炎症个体肠道菌群同样存在显著差异,在患有肠皱纹萎缩和固有层炎症的大西洋鲑肠道中,乳球菌属较正常个体显著增加[30]。在门水平上,卵形鲳鲹变形菌门和软壁菌门相对丰度随牛磺酸含量显著变化,适当的牛磺酸添加能降低变形菌门和螺旋体门的相对丰度,提高软壁菌门和拟杆菌门的相对丰度;Yu等[2]研究发现,牛磺酸能提高大鼠拟杆菌门和降低变形菌门丰度,这与本研究结果相似。牛磺酸在三大物质代谢中起着重要作用,而拟杆菌门是多糖、胆固醇代谢和碳水化合物发酵的重要参与菌群[31],改变拟杆菌门丰度有可能是牛磺酸调节三大营养物质代谢的另一原因;然而高浓度的牛磺酸含量会抑制其生长,原因可能是过量的牛磺酸导致肠道处于高酸度环境,其不适于在这种酸性条件下生长[32]。在属水平上,卵形鲳鲹支原体菌属、短螺旋体属和甲基杆菌属随牛磺酸含量发生显著变化,支原体菌属丰度显著降低,短螺旋体属丰度显著增加,甲基杆菌属也呈增加趋势;优势菌群往往会影响宿主自身微生物的组成和结构;肠道微生物结构的改变有可能会导致肠道疾病的产生,其在鱼类肠道中发挥的作用还需进一步研究验证。短链脂肪酸 (SCFAs) 具有多种生理学功能,能够提供能量,促进钠的吸收,改善肠道循环,抑制致病微生物的生长;研究表明牛磺酸能够提高肠道SCFAs含量,然而变形菌门中包含大多数的致病菌,牛磺酸有可能通过提高肠道SCFAs含量抑制致病微生物,降低致病菌丰度[2]。
牛磺酸是免疫反应的有效调节剂,能够通过调节淋巴细胞的增殖和抑制促炎介质的产生调节炎症反应。溶菌酶是一种碱性蛋白质,具有溶菌、杀菌、抗病毒的作用,是评价鱼类的非特异性防御能力的重要指标;血清补体系统是先天免疫的主要组成部分,补体C3和补体C4在补体的激活过程中发挥重要作用,能激活补体抵抗病原微生物侵入;免疫球蛋白是免疫活性分子中一种重要抗体,能特异性地结合抗原[33]。本试验中卵形鲳鲹血清溶菌酶的活性显著提高,补体C4和免疫球蛋白含量显著增加,说明适量牛磺酸能提高卵形鲳鲹免疫能力。饲料中添加牛磺酸同样能够显著增加黄鳍鲷(Acanthopagrus latus)[34]、黄颡鱼 (Pelteobagrus fulvidraco)[35]、虹鳟[36]、草鱼[12]的免疫能力。
动物肠道损伤导致肠道炎症或先天免疫过程的发生,Toll样受体 (TLRs) 是病毒、细菌、真菌的宿主传感器,Toll样受体 (TLRs)/NF-κB信号通路在多种脊椎动物先天免疫中发挥重要作用,注射了Poly (I∶C) 和LPS的点带石斑鱼 (Epinephelus coioides) 的TLR-1和TLR-2表达均显著上调[37]。本试验中饲料牛磺酸含量增加显著下调肠免疫基因 ToTLR-1、ToTLR-2、ToNFκB P65、ToTNF-α 和ToIL-1β的表达;显著上调肠免疫基因ToIL-10的表达。牛磺酸具有通过抑制NF-κB的活化从而调节促炎性细胞因子在体内调节炎症过程的能力,研究表明,牛磺酸可以调节感染链球菌炎症反应期间TLRs/NF-κb信号通路,降低TLR-2和NF-κb P65的表达[15]。IL-1β和TNF-α的表达与TLRs有关,TLR可以激活MyD88依赖性途径,通过NF-kB诱导IL-1β和TNF-α表达[38]。豆粕替代鱼粉提高了鲈鱼IL-1β和TNF-α的表达,而通过添加牛磺酸能够显著抑制两促炎性因子表达,缓解了植物性蛋白引起的炎症反应;牛磺酸能够降低大鼠血清TNF-α活性和肉鸡血浆TNF-α含量,这表明牛磺酸可以通过基因表达和酶活性两个层次对炎性因子产生影响[11]。有研究发现,IL-10可以下调TNF-α表达,补充牛磺酸也可以降低草鱼TNF-α基因的表达,这可能与IL-10有关[12]。IL-10是肠道中重要的抗炎细胞因子,IL-10上调有利于缓解由植物性蛋白替代引起的肠道炎症,在本试验中,有可能是牛磺酸引起IL-10基因表达的上调导致TNF-α表达受到抑制。内毒素是革兰阴性菌细胞壁的主要成分之一,与某些生物分子结合形成的化合物可引起毒性反应,有证据表明牛磺酸能够减少炎症细胞的浸润和内毒素的含量,缓解小鼠炎症引起的肠道黏膜损伤,这有可能是牛磺酸通过抑制内毒素转移来发挥作用;牛磺酸还能和多种物质结合形成在炎性反应中具有重要作用的牛磺酸代谢物 (TauCl等),能够抑制NF-κB的活化和NO、TNF-α、促炎白细胞介素等的生成,牛磺酸摄入有可能导致牛磺酸代谢物的增加,下调了促炎因子的表达[39]。
综上所述,牛磺酸在卵形鲳鲹肠道中发挥着重要的生理功能,对肠道菌群及免疫功能有着显著的影响。牛磺酸能引起肠道菌群相对丰度和结构的改变,导致优势菌相对丰度的变化。牛磺酸能够提高血清溶菌酶活性并增加免疫球蛋白数量,能够调节肠道TLRs/NF-κB信号通路,下调促炎因子ToNFkB P65、ToTNF-α、ToIL-1β 和上调抗炎因子ToIL-10的表达,提高肠道免疫能力。
——奇妙的蛋

