台盼蓝活体染色法观察瓦氏黄颡鱼血脾屏障研究
贺 扬 ,戴旭平,樊 威,王 均 ,覃川杰 ,陈 杰,曹心雨
(1. 内江师范学院/长江上游鱼类资源保护与利用四川省重点实验室,四川 内江 641000; 2. 内江师范学院生命科学学院,四川 内江 641000; 3. 四川省内江市农业科学院水产研究所,四川 内江 641000)
瓦式黄颡鱼 (Pelteobagrus vachelli) 属鲇形目、鲿科,是黄颡鱼属中体型最大的一个种[1]。相比同属的黄颡鱼 (P. fulvidraco),瓦氏黄颡鱼的生长速度和成活率均较高,加之其肉质细嫩、营养丰富、无肌间刺,深受养殖户和消费者喜爱,已在我国多个地区广泛养殖[2]。养殖过程中,疾病是威胁瓦式黄颡鱼产量和品质的主要因素。已报道多种细菌和寄生虫可感染瓦氏黄颡鱼,造成严重经济损失,如嗜水气单胞菌 (Aeromonas hydrophila)[3]、爱德华氏菌 (Edwardsiella ictaluri)[4]、小瓜虫 (Ichthyophthirius multifiliis)[5]等。研究瓦式黄颡鱼免疫系统的组成以及应对抗原的免疫反应将为疾病的免疫调节防治提供基础资料。
脾脏被认为是鱼类重要的淋巴细胞聚集器官,也是一个精致的过滤器,参与了衰老或受损红细胞、血源性抗原以及各类血源性异物的过滤和清除[6]。Weiss等[7]发现小鼠 (Mus musculus) 的脾脏中存在过滤床——血脾屏障,可过滤血液中的疟原虫,保护脾脏的造血组织。血脾屏障也被证实存在于哺乳动物脾脏的红髓及边缘区,环绕白髓[8]。然而,鱼类的脾脏与哺乳动物的脾脏在组织结构上存在较大差异,鱼类的脾脏红髓和白髓分界不清,无边缘区[9]。因此关于鱼类的血脾屏障部位有待进一步研究。
本研究以瓦氏黄颡鱼脾脏为研究对象,运用组织学方法对其显微镜结构进行了观察。同时,使用台盼蓝活体染色法动态监测台盼蓝在瓦氏黄颡鱼脾脏中的含量和位置,对血脾屏障在脾脏免疫中的作用进行了初探,以期为瓦氏黄颡鱼疾病的防治研究提供基础资料。
1 材料与方法
1.1 实验材料
实验鱼为健康瓦氏黄颡鱼,2019年9月购于四川内江某鱼市场,体质量约 (50±10) g。运至长江上游鱼类资源保护与利用四川省重点实验室暂养2周,每2 d换水一次,每次换1/3。参照《实用现代病理学技术》[10]配置Harris改良苏木素液、醇溶性伊红染色液以及石蜡包埋和染色过程中涉及的梯度乙醇等。参照林鸿翔和朱建善[11]配置改良James染色相关染液。1%台盼蓝注射液的配置方法为1 g台盼蓝加入100 mL生理盐水中,煮沸10 min,普通滤纸过滤备用。所需试剂均购于市售,级别为分析纯。
1.2 脾形态观察
随机选取6尾健康的瓦氏黄颡鱼,解剖前使用1 ml·L−1乙二醇苯醚麻醉致死,置于解剖盘中。解剖前将实验鱼左侧平放;剪刀由肛门前端开剪,斜向上剪至侧线下方,然后平行侧线剪至胸鳍基部后端,最后斜向下剪至围心腔前端,暴露实验鱼腹腔,观察其脾脏位置、形态和颜色。去除内脏组织后,称量鱼体质量 (g);采集实验鱼脾脏,称量脾质量 (g),使用公式计算脾体指数:脾体指数=脾质量/鱼体质量×100%[12]。
1.3 脾组织结构观察
瓦式黄颡鱼脾脏经PBS洗涤去除多余的成分(表面血液和脂肪组织),用滤纸吸干表面水分,置于塑料包埋框中。立即浸入4%预冷的多聚甲醛中固定48~72 h,组织经梯度乙醇脱水、甲苯透明、浸蜡后进行石蜡包埋。石蜡包埋块,使用转轮式组织切片机 (Leica) 进行粗修,完全暴露组织后,以3 μm连续切片2张,铺展于2张载玻片上,分别用于HE染色[10]和改良James染色[11]。
1.4 台盼蓝活体染色
用1 ml·L−1乙二醇苯醚麻醉30尾健康瓦氏黄颡鱼后,腹腔注射1%台盼蓝注射液 (0.2 mL·尾−1)[13]。注射后立即放入水中继续饲养。分别于注射后第0、第4、第8、第24、第48和第72小时随机采集5尾鱼的脾脏,按1.3中方法进行固定、包埋和切片。捞取连续2张切片,一张用于HE染色,一张不染色直接脱蜡封片。
1.5 统计与分析
组织学观察使用Motic SMZ-16 8型数码显微镜,并用Moticam 2506数码成像系统采集图片。正常组织的HE染色和James染色观察放大倍数为200×或400×,低倍观察脾脏的组成要素、红髓和白髓的分界等,高倍观察各组成要素的形态。血脾屏障部位使用HE染色的台盼蓝进行观察和定位;血脾屏障的功能使用未染色的切片,对每个切片于400×放大倍数随机选取5个视野进行图像采集。采集的图片使用Image-Pro Plus 6.0图像分析软件的count/size,以台盼蓝颜色为目标,记录台盼蓝的分布面积,同时记录整个视野的有效面积,计算台盼蓝占有效面积的比值,公式为:台盼蓝面积比=台盼蓝面积/有效面积×100%,并应用软件SPSS 16.0进行统计学分析,软件Graph Pad Prism 5作图。
2 结果
2.1 脾脏的解剖位置与形态
沿瓦氏黄颡鱼左侧剖开,脾脏被肝和胃覆盖,位于鳔腹面。脾脏为独立的器官,呈暗红色、形状不规则且有的分叶,其背侧略微鼓起,与前肠和肝相接;腹侧平坦,贴于鳔壁。称量鱼体质量和脾脏质量,计算得脾体指数约0.120%~0.273%(表 1)。
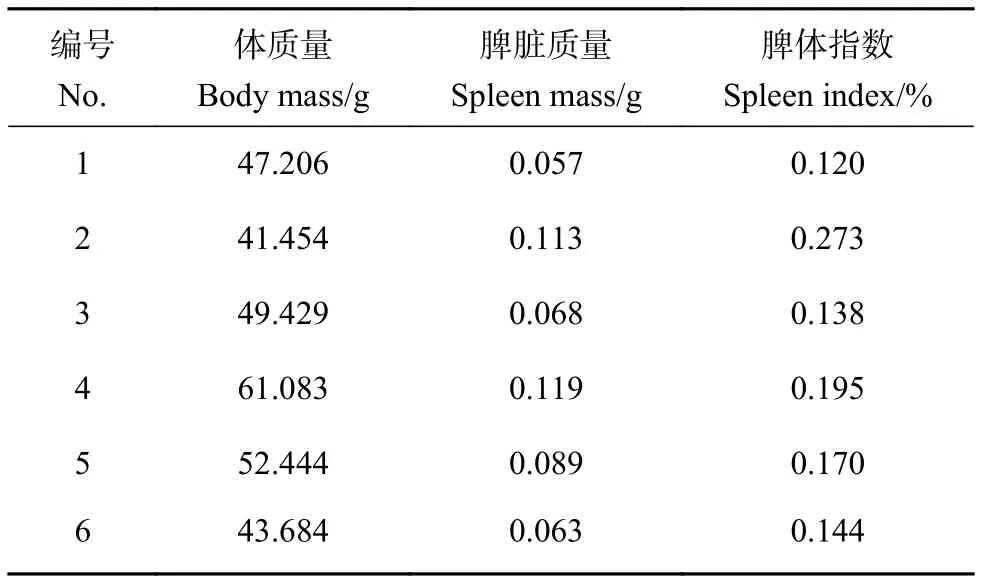
表1 瓦氏黄颡鱼脾体指数Table 1 Splenic somatic index of P. vachelli
2.2 脾脏的组织结构
HE染色观察瓦氏黄颡鱼脾脏的组织结构,结果显示其脾脏由被膜、不发达的脾小梁和脾实质组成。脾实质由红髓和白髓构成,之间无明显界限。被膜由薄层结缔组织和单层扁平上皮细胞组成。被膜向脾内延伸形成不发达的脾小梁,脾小梁细而少(图1-a)。红髓以伊红色为主,脾索呈不规则条索状,与其他脾索相互交织形成似网状的支架;脾窦为脾索交织形成的网眼,形状不规则,脾索含有红细胞、巨噬细胞、淋巴细胞等各类血细胞。白髓着色较浅,主要由淋巴组织、黑色素巨噬细胞中心和椭球体构成。淋巴细胞分布散在,部分聚集成群,散在于脾实质中或多位于椭球体周围 (图1-b);黑色素巨噬细胞中心大小不等,有单层扁平细胞包裹于外周 (图1-c),一般位于血管周围或者环绕血管边缘,呈棕黄色并间杂少量黑色团块;椭球体染色浅,中央有椭球毛细血管 (又称微动脉血管),管腔中偶尔看见单个红细胞 (图1-d)。
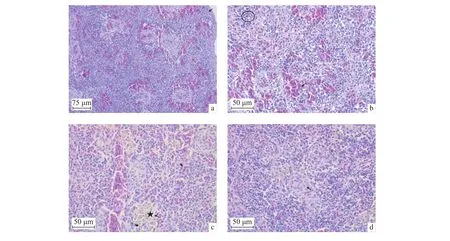
图1 脾脏切片HE染色观察a. 脾被膜 (→) 和脾小梁 (→);b. 聚集成团的淋巴细胞 (○) 和散在淋巴细胞 (→);c. 黑色素巨噬细胞中心 (★)由单层扁平细胞包裹(→);d. 白髓中椭球体 (→)Figure 1 Pathological of spleen stained by HEa. Splenic capsule (→) and trabeculae (→); b. Clustered (○) and scattered (→) lymphocytes; c. MMCs surrounded (★) by flat cells (→); d. Ellipsoids in white pulps (→)
2.3 脾脏的纤维组成
改良James染色观察瓦氏黄颡鱼脾脏的纤维分布情况发现,其脾脏被膜由网状纤维与胶原纤维相互缠绕形成 (图2-a);网状纤维在脾实质中分布广泛,在红髓中沿脾窦呈树根状分布,分支多 (图2-b);在白髓中沿椭球体呈单层或双层环状分布,分支少(图2-c);在血管周围呈放射状分布 (图2-d)。胶原纤维多存在于红髓中,在血管周围呈层状聚集 (图2-e),在白髓中含量少 (图2-f)。
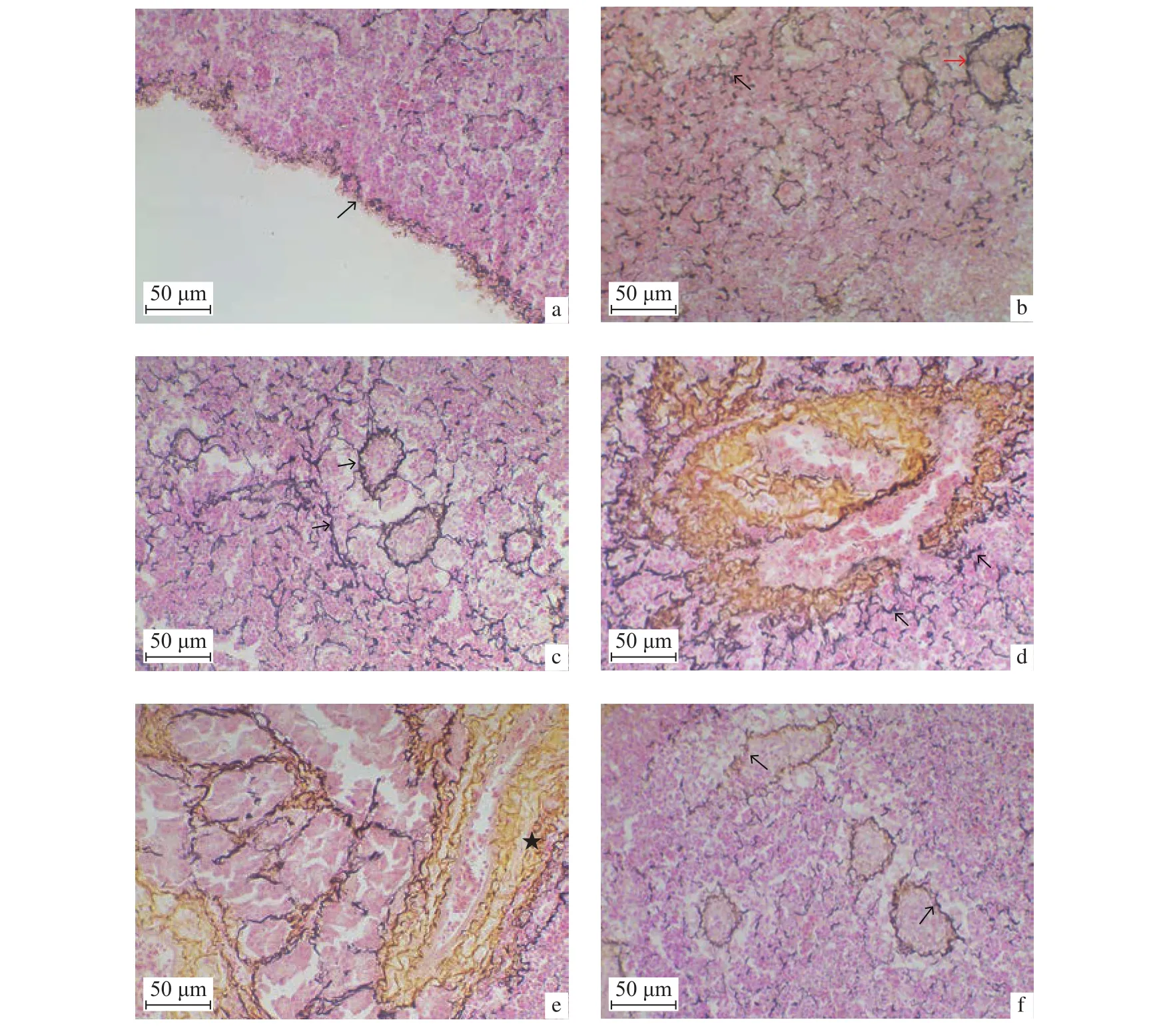
图2 正常脾脏组织切片改良James染色观察a. 网状纤维与胶原纤维相互缠绕形成被膜 (→);b. 红髓内网状纤维 (→),白髓内网状纤维 (→);c. 椭球体周围网状纤维 (→);d. 血管周围放射状网状纤维 (→);e. 血管周围胶原纤维 (★);f. 白髓中胶原纤维Figure 2 Normal spleen stained by Jamesa. Reticular fibers and collagen fibers twine to surround capsule (→); b. Reticular fibers satiated in red pulps (→) and white pulps (→);c. Reticular fibers in ellipsoids (→); d. Reticular fibers satiated in white pulps (→); e. Collagen fibers surrounding the vascular (★); f. Collagen fibers satiated in white pulps
2.4 血脾屏障
使用台盼蓝腹腔注射瓦式黄颡鱼,HE染色观察台盼蓝在其脾组织中的分布部位,进行血脾屏障位置观察。结果显示,台盼蓝主要分布于脾脏的血管内皮细胞,包括脾血管内皮细胞、血窦内皮细胞和椭球体内皮细胞 (图3-a)。未染色的脾脏,使用IPP 6.0测定台盼蓝分布面积,计算台盼蓝面积比(图3-b)。结果显示,第0小时脾组织中无台盼蓝颗粒存在 (图3-c);第4小时台盼蓝开始在脾脏的血管内皮细胞出现,平均面积比为0.13% (图3-d);第8小时台盼蓝数量增多 (图3-e),平均面积比为0.25%,但与第4小时无显著差异 (P>0.05);第24小时台盼蓝面积显著增大至整个视野的1.27%,呈团块状 (图 3-f,0.01<P<0.05);第 48 小时进一步明显增大至整个视野的3.70% (图3-g);至第72小时台盼蓝在椭球体内皮细胞中达到峰值(图3-h),平均面积比为5.58%,极显著高于其他时间点(P<0.01)。
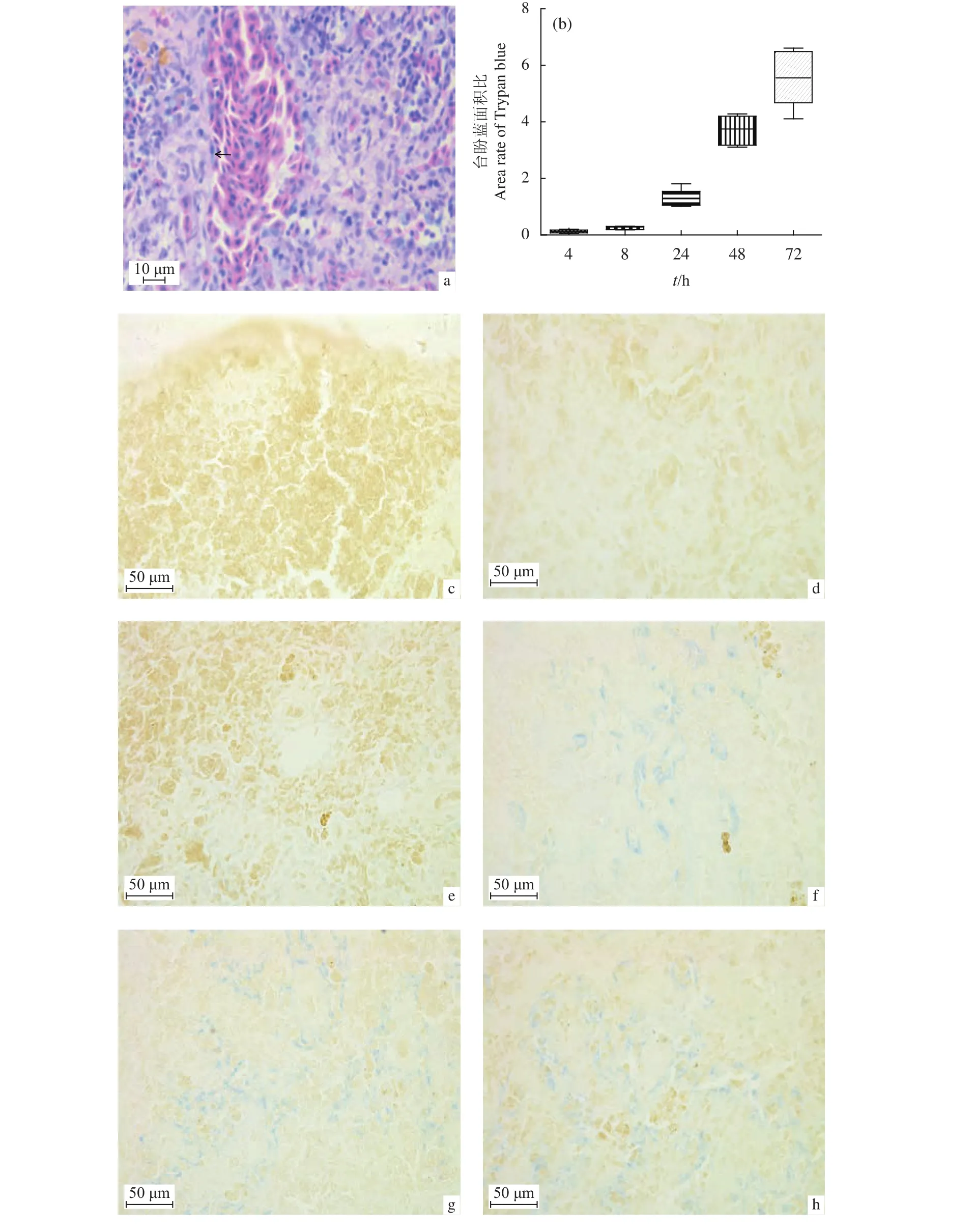
图3 瓦氏黄颡鱼脾脏中不同时间点台盼蓝面积比的变化趋势a. 台盼蓝分布于内皮细胞中(→),HE;b. 台盼蓝定量分析;*. 0.01<P<0.05; **. P<0.01;c. 注射前脾脏组织切片,未染色;d. 注射第4小时,脾脏组织切片,未染色;e. 注射第8小时,脾脏组织切片,未染色;f. 注射第24小时,脾脏组织切片,未染色;g. 注射第48小时,脾脏组织切片,未染色;h. 注射第72小时,脾脏组织切片,未染色Figure 3 Dynamic changes of area rate of Trypan blue in spleen of P. vachellia. Trpan blue satiated in endotheliocytes (→), HE staining; b. Quantity analysis of Trypan blue; c. Pathology of spleen before injection, unstained;d. Pathology of spleen at 4th hour post injection, unstained; e. Pathology of spleen at 8th hour post injection, unstained; f. Pathology of spleen at 24th hour post injection, unstained; g. Pathology of spleen at 48th hour post injection, unstained; h. Pathology of spleen at 72nd hour post injection, unstained
3 讨论
3.1 瓦氏黄颡鱼脾脏的形态
低等鱼类盲鳗 (Myxine glutinosa) 没有脾脏,软骨鱼类和硬骨鱼类具有独立的脾脏[14]。受腹腔空间的限制、肝脏的挤压以及鱼体形状的影响,硬骨鱼的脾脏在形态学上存在很大差异。如兴国红鲤( Xingguo Cyprinus flammans) 的脾脏呈长条形,前宽后窄[15];驼背鲈 (Cromileptes altivelis) 的脾脏呈扁平长条状,其腹面平,背面略凸[16];草鱼 (Ctenopharyngodon idellus) 的脾脏为扁平椭圆形,呈长条状[17];南方鲇 (Silurus meridionalis) 脾的外表形状大多呈蝴蝶状、中部愈合、前后部分叶,也有的呈桃状、分左右两叶、一般右叶大于左叶[18]。本实验中瓦氏黄颡鱼脾脏为独立的脏器,形状不规则,且有的分叶,有的不分叶。软骨鱼银鲛的脾脏指数大于1%,人类的脾脏指数约0.27%,而硬骨鱼类的脾体指数差异较大[19]。尼罗罗非鱼 (Oreochromis niloticus) 的脾体指数为0.03%~0.14%[13]。本实验中健康瓦氏黄颡鱼的脾脏质量为0.025~0.034 g,脾体指数为0.120%~0.273%。作为鱼类重要的免疫器官,脾脏肿大,脾体指数升高,常预示着鱼体感染。Haididi等[20]研究发现虹鳟 (Oncorhynchus mykiss)对嗜冷黄杆菌 (Flavobacterium psychrophilum) 的抵抗强弱与脾体指数大小呈正相关;Harun等[21]研究发现虹鳟感染鲁氏耶尔森氏菌 (Yersinia ruckeri)后,脾体指数明显增大。Wiens等[22]通过脾脏切除方法研究虹鳟对嗜冷黄杆菌的抵抗力发现,脾大并不意味着对嗜冷黄杆菌抵抗力强,但可间接反映免疫状态。可见,脾脏的大小与免疫具有一定联系,明确两者之间的相关性可有利于品种选育和感染的判定。
3.2 脾脏的组织结构
和哺乳动物的红髓、白髓分界明显不同,硬骨鱼的脾脏红髓和白髓无明显界限,无脾小结,也无淋巴鞘结构。但部分鱼类淋巴细胞可聚集成团,出现淋巴细胞小泡,如鳗鲡 (Anguilla japonica)[23]、罗非鱼[13]。本研究中淋巴细胞多散在分布于白髓中,少见聚集成团的现象。被膜-小梁、网状纤维和胶原纤维共同组成了脾脏的支架。依靠发达的脾脏支架,哺乳动物的脾脏具有较强的储血和释血能力,但硬骨鱼类的脾脏支架差异较大。如岩原鲤(Procypris rabaudi) 的脾脏被膜薄,脾小梁发达,伸入脾实质中,将其分隔成一个个明显的小叶[24]。鲤 (C. carpio) 和鲫 (Carassius auratus) 脾脏中没有小梁[25]。本实验中瓦氏黄颡鱼脾脏的被膜为薄层被膜,小梁不发达,不同于黄颡鱼的脾脏小梁明显、可深入脾脏实质将其分割成许多小叶[26]。这可能是由于种属差异,也可能与养殖环境条件中的各因素有关。鱼类脾脏的组织结构研究不仅可以丰富鱼类免疫学研究的基础资料,也可用于鱼类免疫指标的评价。
3.3 血脾屏障
血脾屏障是脾脏的重要先天性免疫部位,具有机械屏障、生物屏障、传递抗原信息、维持白髓内微环境稳定、调控特异性免疫应答反应等功能[27]。血脾屏障的位置通常可采用注射荧光物质、台盼蓝和碳粒等进行标记,利用组织学方法分析注射物质在脾脏中的分布情况。通过上述方法标记发现,血脾屏障在大鼠位于脾脏的边缘区[28],在鸭[29]、鸡[30]、中华鳖[31]、罗非鱼[13]等位于脾脏的椭球体周围。血脾屏障同血脑屏障一样,均具有阻止病原入侵、过滤大分子物质和吞噬功能。但血脾屏障相对松散,可过滤抗原物质,但允许其他物质正常通过。研究昆明种小鼠的血脾屏障发现,巨噬细胞和边缘窦内皮细胞均参与了碳粒的吞噬和清除[32]。使用台盼蓝腹腔注射罗非鱼观察血脾屏障组成显示,椭球体内皮细胞是血脾屏障的重要组成细胞,可摄取和清除台盼蓝[13]。与之相似,本实验中使用台盼蓝腹腔注射瓦氏黄颡鱼后,台盼蓝也主要分布在椭球体内皮细胞内,表明椭球体内皮细胞是瓦氏黄颡鱼血脾屏障的重要组成成分。血脾屏障对于不同抗原的吞噬作用出现时间略有差异:在小鼠尾静脉注射碳粒第3小时即可出现吞噬现象,但对于新型隐球虫(Cryptococcus neoformans) 需3 d才出现吞噬作用[32]。同样对尼罗罗非鱼腹腔注射台盼蓝第4小时即观察到台盼蓝,但对于无乳链球菌 (Group B Streptococcus) 则需要24 h或更长时间[13]。本研究中,瓦氏黄颡鱼腹腔注射台盼蓝后,也能在第4小时观察到少量内皮细胞吞噬台盼蓝现象,但对于细菌性抗原的屏障作用还有待进一步研究。不同物种间血脾屏障的抗原清除作用也存在差异。尼罗罗非鱼腹腔注射台盼蓝后,第24小时即出现了明显的台盼蓝减少,但本研究的瓦氏黄颡鱼至第72小时台盼蓝的数量仍未减少。此外,除内皮细胞和巨噬细胞外,有研究表明网状纤维也是构成屏障的组成成分,但本研究尚未观察到该现象,可能是腹腔注射的缘故。在尼罗罗非鱼血脾屏障研究中,使用腹腔注射未发现网状纤维是血脾屏障的组成成分,但使用尾静脉注射即可观察到网状纤维的作用[13]。因此,后续研究有必要对瓦氏黄颡鱼进行尾静脉注射,观察网状纤维是否具有屏障作用。

