CYP2C19基因多态性检测的临床实验室性能验证*
李婧,李林静,刘转,杨文娟,马青梅,张安安,杨海棠,刘泽菁,刘欣跃(兰州大学第二医院检验医学中心,兰州 730030)
人细胞色素P450酶等位基因(CYP2C19)编码的S-美芬妥英羟化酶参与了一系列临床常用药物代谢,其中最常见的就是氯吡格雷抵抗[1]。阿司匹林联合一种P2Y12受体抑制剂(氯吡格雷、替格瑞洛和普拉格雷)的双联抗血小板治疗,是预防直接经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)术后支架内血栓等再次发生血栓事件的基石[2]。荷兰一项历时8年的POPular Genetics研究——氯吡格雷基因检测相关临床随机对照试验(RCT)证实,在PCI术后的ST段抬高性心肌梗死(STEMI)患者中,以CYP2C19基因型指导P2Y12受体抑制剂的个体化抗血小板降阶治疗策略,对于预防1年内血栓事件的疗效不劣于替格瑞洛或普拉格雷的强效标准治疗,而且出血发生率更低[3]。因此,本研究拟根据临床需求及ISO15189实验室质量管理体系的要求[4],进行人类CYP2C19基因多态性检测试剂盒(荧光PCR法)性能验证。
1 资料与方法
1.1研究对象 纳入2018年1月至10月兰州大学第二医院计划进行PCI手术且尚未应用任何抗血小板治疗药物的急性心肌梗死患者20例,其中男17例、女3例,年龄(59.6±8.6)岁,所有患者均无家族遗传史,无血缘关系。本研究通过兰州大学第二医院伦理委员会审核批准(No.2018A-065)。
1.2仪器与试剂 7500实时荧光定量PCR仪(美国ABI公司),Qubit3.0核酸定量仪(美国Life Technologies公司)。人CYP2C19基因多态性检测试剂盒(荧光PCR法)及核酸提取试剂盒(苏州旷远生物分子技术公司),氯化血红素、胆红素及胆固醇(北京索莱宝科技公司)。
1.3方法
1.3.1外周血DNA提取 采集急性心肌梗死患者的静脉血2~3 mL,EDTA-K2抗凝,置于4 ℃保存。采用配套核酸提取试剂盒提取并纯化DNA。采用Qubit3.0核酸定量仪定量DNA浓度,取DNA浓度高于50 ng/μL、吸光度(A260/280 nm)值为1.7~2.0的样本,置于-20 ℃保存。
1.3.2实时荧光PCR扩增 按照人CYP2C19基因多态性检测试剂盒(荧光PCR法)说明书检测CYP2C19基因*2(c.681 G/A)位点与*3(c.636 G/A)位点单核苷酸多态性。PCR反应体系为每个样本各准备4支PCR反应管,分别加入2G、2A、3G、3A的PCR反应液23 μL(含PCR 缓冲液、特异性引物和探针、内参引物和探针),5 U/μL Taq DNA聚合酶1 μL,样本DNA 1 μL。使用试剂盒自带的质控品进行阴、阳性对照。采用ABI 7500实时荧光定量PCR仪进行扩增。循环参数:95 ℃预变性3 min;95 ℃ 30 s,56 ℃ 30 s,65 ℃ 45 s,10个循环;95 ℃ 30 s,56 ℃ 30 s,65 ℃ 45 s,30个循环;25 ℃ 1 min。设置FAM和ROX双通道采集荧光信号。对于DNA样本检测反应体系,其内参扩增曲线的Ct(ROX)值应≤20,在内参Ct(ROX)值正常的情况下,计算样本检测信号Ct(FAM)值与内参信号Ct(ROX)值的差值,即△Ct=|Ct(FAM)-Ct(ROX)|。根据△Ct值判断基因型,2G和2A反应体系:当△Ct≤5时提示等位基因G或A阳性,当△Ct>5 或Ct(FAM)显示“Undetermined”时提示G或A阴性;3G和3A反应体系:当△Ct≤7时提示等位基因G或A阳性,当△Ct>7 或Ct(FAM)显示“Undetermined”时提示G或A阴性。最后根据等位基因G和A的结果组合成相应的基因型。
1.3.3Sanger测序 取上述20例患者的DNA标本,送六合华大基因科技公司上海分公司进行Sanger测序。测序仪器为ABI 3730XL高通量分析仪,测序片段分别为CYP2C19*2(exon5):atatacaatatattttatttatatttatagttttaaattacaaccagagcttggcatattgtatctatacctttattaaatgcttttaatttaataaattattgttttctcttagatatgcaataattttcccactatcattgattatttcccgggaacccataacaaattacttaaaaaccttgcttttatggaaagtgatattttggagaaagtaaaagaacaccaagaatcgatggacatcaacaaccctcgggactttattgattgcttcctgatcaaaatggagaaggtaaaatg;CYP2C19*3(exon4):ctgtgatcccactttcatcctgggctgtgctccctgcaatgtgatctgctccattattttccagaaacgtttcgattataaagatcagcaatttcttaacttgatggaaaaattgaatgaaaacatcaggattgtaagcaccccctggatccaggtaaggccaagttttttgcttcctgagaaaccacttacagtctttttttctgggaaatccaaaattctatattgaccaagccctgaagtacatttttgaatactacagtcttgcctagacagccatggggtgaatatctggaaaag。符合率≥95%为验证通过。将测序结果的2个位点基因型(加粗斜体标注)与荧光PCR检测的基因型进行对比分析,以确定荧光PCR检测结果是否为目的片段及相应的等位基因。
2 实验与结果
2.1符合率 采用人CYP2C19基因多态性检测试剂盒对上述已知的20例患者基因型样本进行实时荧光PCR方法检测,另取患者的DNA标本进行Sanger测序。结果表明,20例样本经过实时荧光定量PCR和Sanger测序后,共检测出5种基因型组合,包含*1/*3(c.681 GG,c.636GA)基因型3例;*1/*2(c.681 GA,c.636GG)基因型5例; *2/*2(c.681 AA,c.636GG)基因型3例;*2/*3(c.681 GA,c.636GA)基因型3例;*1/*1(c.681 GG,c.636GG)基因型6例;实时荧光PCR及Sanger测序结果完全一致,符合率为100%。见图1。

注:实时荧光PCR法中,FAM通道为检测通道,ROX为内参通道。Sanger测序图中红圈标识位置为CYP2C19 c.681和c.636位点的突变基因。A,*1/*3(c.681 GG,c.636GA)基因型;B,*1/*2(c.681 GA,c.636GG)基因型;C,*2/*2(c.681 AA,c.636GG)基因型;D,*2/*3(c.681 GA,c.636GA)基因型;E,*1/*1(c.681 GG,c.636GG)基因型。
2.2精密度

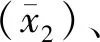

表1 CYP2C19实时荧光定量PCR精密度验证结果
2.3检出限 选择2例测序验证基因型为CYP2C19c.681GA、c.636GA的杂合型临床标本,原始DNA浓度分别为51.13 ng/μL和50.76 ng/μL。参考试剂盒说明书“参考品(杂合子)最低检测下限低至10 ng/μL”,将这2例标本的DNA溶液用DNA洗脱液进行等比稀释,稀释后的DNA浓度分别为30.15 ng/μL、17.33 ng/μL、9.95 ng/μL和29.42 ng/μL、17.55 ng/μL、9.90 ng/μL。将稀释后的最低浓度核酸样本设置5个复孔进行PCR基因型检测,5次检测的基因型结果与未稀释原浓度水平的基因型结果符合率达100%时为验证通过。结果表明,按照说明书提示的最低浓度重复检测5次后的基因型与未稀释原浓度水平的基因型符合率为100%,验证通过。
2.4抗干扰能力 选择1例测序验证基因型为CYP2C19c.681GA、c.636GA的临床血液标本,分装成10份样本,每份200 μL,其中1份不添加任何干扰物质,作为对照组,其余9份平均分为3组,每组分别加入3种干扰物质——氯化血红素、胆红素和胆固醇,配制成血红蛋白终浓度为20 g/L,总胆红素终浓度为60 μml/L,总胆固醇终浓度为10.2 mmol/L的溶血、黄疸及脂血标本。提取这10份样本的DNA进行PCR基因型检测,实验组和对照组检测结果的符合率≥90%为抗该干扰能力验证通过。结果发现:加入氯化血红素、胆红素和胆固醇之后的标本的基因型与对照组基因型符合率为100%,即这3种干扰物质在试剂盒标注的浓度下,对基因型判断没有影响,验证通过。见表2。
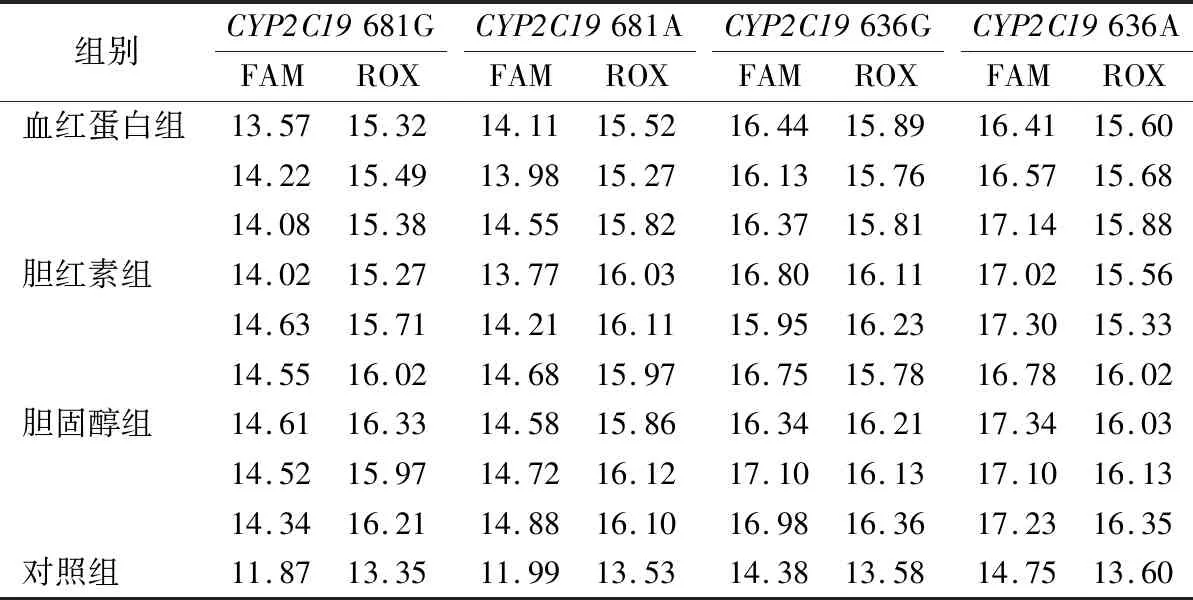
表2 CYP2C19实时荧光定量PCR抗干扰能力验证结果
3 讨论
为了保证日常检验项目的质量控制工作及检验结果的准确、可靠。本研究从符合率、精密度、检出限和抗干扰能力4个方面对苏州旷远生物分子技术公司的人CYP2C19基因多态性检测试剂盒(荧光PCR法)进行了性能验证。
符合率验证为本试剂盒基因型检验结果与参考方法Sanger测序方法的结果一致性检验,反映了检验结果的准确性,是确保检验结果准确发出的前提和重要环节。本研究中纳入了甘肃地区汉族人群中检出的5种基因型组合,涵盖了CYP2C19所能检出的全部基因型。对5种类型的基因型组合进行验证后发现,两种方法的结果完全一致。
精密度验证分为期间精密度和重复性的验证,反映了检测结果的再现性,是保证良好准确度的先决条件,也是反应实验室室内质控稳定性的重要指标,本研究重复性和期间精密度的CV值均小于5%,表明基因型判断结果稳定、可靠。
检出限验证反映了能检测出基因型的最低的样本核酸浓度,本试剂盒的说明书中最低检出限为10 ng/μL,本次验证将核酸浓度稀释到略低于10 ng/μL,经过连续5次重复扩增之后,依然可以保证基因型的准确判断。抗干扰能力验证反映了临床样本发生溶血、黄疸或脂血时能否正确判定基因型的能力,因临床标本中既要符合溶血、黄疸或脂血又要符合杂合突变基因型的样本数量极少,故而本实验根据试剂盒说明书中的浓度将临床样本进行了处理,配制成了不同浓度的溶血、黄疸或脂血样本,并未影响基因型的准确判断。
本次验证的不足之处在于考虑到实际检测的时效性,加之本实验已完成验证过程,未对更低的核酸浓度进行基因型检测的尝试;若条件允许,应适当增加精密度验证的天数,使期间精密度检测数据更加完善。

