羧肽酶A4活化STAT3促进肝癌细胞增殖、迁移和侵袭*
禹卓玥,张蕙雯,杨婷,牛亚楠,孙立新,刘军,遇珑,冉宇靓,孙力超(国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室,北京 100021)
肝细胞癌(HCC)属于临床上常见的恶性肿瘤。羧肽酶A4(carboxypeptidase A4,CPA4)属于金属蛋白酶家族,可在锌离子的参与下切割肽或蛋白质的C端残基[1]。CPA4基因位于染色体7q32区域,在细胞增殖和分化中具有潜在作用[2]。研究表明,CPA4的突变或印记异常可能会影响前列腺癌的侵袭性[3]。据报道,CPA4在胰腺癌、胃癌、食管癌等多种肿瘤组织中呈异常高表达,且与肿瘤分期、转移和预后不良有关[4]。然而,CPA4在肝癌中的功能及分子机制尚不清楚。本研究探讨了CPA4在体外对2种肝癌细胞系的增殖、迁移、侵袭能力的影响,并初步研究其分子机制,旨在为寻找肝癌诊断和治疗靶点提供依据。
1 材料与方法
1.1细胞系、试剂及仪器 肝癌细胞系MHCC97H、MHCC97L均由中国医学科学院肿瘤研究所细胞生物学实验室保存。DMEM F12培养基和胰蛋白酶(美国Hyclone公司),胎牛血清(天津康源生物公司),RIPA裂解液、脱脂奶粉、ECL发光液(北京普利莱公司),兔抗CPA4多克隆抗体(美国Sigma公司),兔抗GAPDH多克隆抗体(美国Bioworld公司),兔抗STAT3单克隆抗体、兔抗p-STAT3(Tyr705)单克隆抗体和兔抗c-myc单克隆抗体(美国Cell Signaling Technology公司),辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(美国Jackson公司),CPA4过表达和干扰慢病毒载体(上海和元生物公司),CCK8试剂(日本同仁化学研究所),10 g/L的结晶紫溶液(北京索莱宝公司), 逆转录试剂盒(北京全式金公司),SYBR Green Premix Ex Taq(上海翊圣生物公司),qRT-PCR引物(北京擎科新业生物技术公司),PVDF膜和Transwell小室(美国Millipore公司),Matrigel基质胶(美国BD公司),BCA蛋白质定量试剂盒、细胞培养箱(美国Thermo公司),450型酶联仪、电泳仪(美国Bio-Rad公司),光学显微镜(日本Nikon公司),超微量分光光度计(德国FoodALYT公司)。
1.2方法
1.2.1细胞培养及稳转细胞系的构建 取冻存的肝癌细胞系MHCC97L和MHCC97H,复苏后,重悬于含10%胎牛血清的DMEM F12培养基中,置于37 ℃、5%CO2、饱和湿度培养箱中培养。
CPA4过表达载体和干扰载体的病毒包装、滴度测定均由上海和元生物技术公司完成。shRNA的靶标序列:shCPA4:5′-GTATGACAACGGCATCAAA-3′。按慢病毒操作手册进行感染,将对数生长期的肝癌MHCC97L和MHCC97H细胞分别以5×104个/孔的密度接种至24孔细胞培养板,保证第2天感染病毒时融合率达30%~40%。更换为950 μL新鲜培养基,分别用50 μL包装过表达CPA4及其对照(vector组)的病毒感染肝癌MHCC97L细胞,另用50 μL包装shCPA4及其对照(shNC组)的病毒感染肝癌MHCC97H细胞,4组细胞均加入5 μL聚凝胺(1 mg/mL)。病毒感染12 h后更换新鲜培养基,37 ℃、5%CO2条件下继续培养,用于后续试验。最终得到MHCC97L-vector、MHCC97L-CPA4、MHCC97H-shNC和MHCC97H-shCPA4共4组稳转细胞系。
1.2.2实时荧光定量PCR(qRT-PCR) 收集各组数量约为5×106个且处于对数生长期的MHCC97L和MHCC97H细胞,通过Trizol法提取总RNA,使用超微量分光光度计测定RNA的浓度和纯度,选取浓度大于125 ng/μL,吸光度比值(A260/280 nm)为1.9~2.0的样本用于后续实验,置于-80 ℃保存。各组均取1 μg RNA用于后续实验,使用逆转录试剂盒将RNA逆转录为cDNA,置于-20 ℃保存。引物序列参考文献[4],由北京擎科新业生物技术公司合成。GAPDH上游引物序列:5′-CCAGGTGGTCTCCTCTGACTT-3′,下游引物序列:5′-GTTGCTGTAGCCAAATTCGTTGT-3′;CPA4上游引物序列:5′-CCAGATGCCGAGGAAC-3′,下游引物序列:5′-TACGCCCAGTCGATGC-3′。以cDNA为模板进行qRT-PCR,反应体系为20 μL,包括10 μmol/L上、下游引物各0.4 μL,2×Power SYBR Green PCR Mastre Mix 10 μL,模板DNA 2 μL,无RNA酶水补足体积至20 μL。扩增程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环。于60 ℃时用Step One Plus软件采集荧光信号并进行熔解曲线分析,采用相对表达量2-ΔΔCt法计算。以GAPDH作为内参照,用CPA4与相应GAPDH的Ct差值表示样品中目的基因的mRNA相对表达水平。
1.2.3总蛋白质提取及western blot 收集各组处于对数生长期的MHCC97L和MHCC97H细胞(约5×106个),加入250 μL含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,冰上静置30 min,每隔10 min颠倒混匀1次,12 000 r/min离心15 min,小心吸取上清,采用BCA试剂盒进行定量。分别取35 μg总蛋白质样品,进行含10%SDS聚丙烯酰胺凝胶电泳(SDS-PAGE,积层胶采用90 V电压,分离胶采用120 V电压),并转移至PVDF膜上(80 V电压2 h)。转膜结束后,将膜置于50 g/L脱脂奶粉室温封闭2 h后,PVDF膜置于目的一抗中[稀释比例分别为兔抗CPA4多克隆抗体1∶200;兔抗GAPDH多克隆抗体1∶5 000;兔抗STAT3单克隆抗体1∶1 000;兔抗p-STAT3(Tyr705)单克隆抗体1∶500;兔抗c-myc单克隆抗体 1∶1 000],4 ℃温育过夜。TBST洗涤4次,每次8 min,用HRP标记的羊抗兔IgG(1∶5 000稀释)室温温育1 h,TBST洗涤4次,每次8 min,加入ECL发光液进行显影。蛋白质条带灰度值用ImageJ软件测定,目的蛋白条带相对灰度值=目的蛋白条带的灰度值/内参蛋白条带的灰度值。实验重复3次并进行统计分析。
1.2.4CCK8试验和克隆形成试验 取各组呈对数生长期的肝癌MHCC97L和MHCC97H细胞制成单细胞悬液,以2 500个/孔的细胞密度接种于96孔细胞培养板中,每组设置5个复孔。37 ℃、5%CO2孵箱中分别于培养0、24、48、72和96 h时加入100 μL 10% CCK8试剂,温育2 h后,使用酶联仪测定450 nm波长处各孔的吸光度(A值),取其均值,绘制生长曲线。
取各组呈对数生长期的肝癌MHCC97L和MHCC97H细胞制成单细胞悬液,计数,将细胞悬液稀释为1×106/mL,10倍梯度稀释至浓度为1×103/mL,每组分别接种500 μL于培养皿中,每组设3个复孔,轻轻转动使细胞分散均匀。37 ℃、5%CO2条件下培养10~12 d,培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,PBS洗涤2次,无水乙醇固定30 min,弃去固定液,10 g/L结晶紫染液染色30 min,PBS洗涤2次,空气干燥,拍照,肉眼直接计数克隆(大小约0.3~1.0 mm)。实验重复3次。
1.2.5Transwell迁移试验 将Transwell小室置于24孔细胞培养板中,用无血清培养基将细胞稀释为2.5×105/mL浓度的悬液,取200 μL加入至小室的上室,下室加入650 μL 10%完全培养基,每组设置3个复孔。37 ℃、5%CO2条件下培养24 h,PBS洗涤2次,无水乙醇室温固定30 min,PBS洗涤2次,用棉签擦去上室细胞,10 g/L结晶紫染液染色30 min,PBS洗涤2次,晾干,切下小室并用中性树脂封片。显微镜下观察及拍照,随机选取3个高倍镜视野,计数穿膜细胞数。实验重复3次。
1.2.6Transwell侵袭试验 将Transwell小室置于24孔细胞培养板中,提前在每个小室中加入100 μL稀释好的基质胶(基质胶∶双无培养基=1∶9),37 ℃、5%CO2条件下温育1~2 h,弃去多余基质胶。用无血清培养基将细胞稀释为2.5×105/mL浓度的悬液,取200 μL加入至小室的上室,下室加入650 μL 10%完全培养基,每组设置3个复孔。37 ℃、5%CO2条件下培养24 h,PBS洗涤2次,无水乙醇室温固定30 min,PBS洗涤2次,用棉签擦去上室细胞,10 g/L结晶紫染液染色30 min,PBS洗涤2次,晾干,切下小室并用中性树脂封片。显微镜下观察及拍照,随机选取3个高倍镜视野,计数穿膜细胞数。实验重复3次。
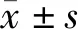
2 结果
2.1western blot和qRT-PCR检测CPA4mRNA及蛋白质在肝癌细胞系中的表达 western blot和qRT-PCR分析证实肝癌细胞系MHCC97H和MHCC97L均表达CPA4mRNA及蛋白质,且CPA4mRNA及蛋白质在MHCC97H细胞中的表达高于MHCC97L细胞。见图1、表1。
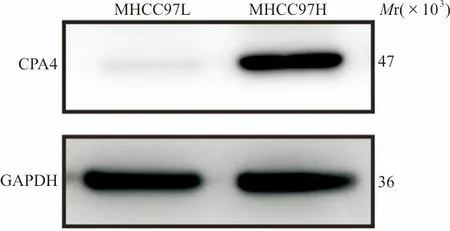
图1 western blot检测CPA4蛋白在肝癌细胞系中的表达
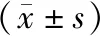
表1 western blot和qRT-PCR检测CPA4 mRNA及蛋白质在肝癌稳转细胞系中的表达
2.2western blot和qRT-PCR检测CPA4mRNA及蛋白质在肝癌稳转细胞系中的表达 western blot和qRT-PCR检测结果表明,CPA4mRNA及蛋白质在MHCC97L-CPA4组细胞的表达水平明显高于MHCC97L-vector组,而在MHCC97H-shCPA4组细胞的表达水平明显低于MHCC97H-shNC组。见图2、表2。

图2 western blot检测CPA4蛋白在肝癌稳转细胞系中的表达
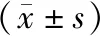
表2 western blot和qRT-PCR检测CPA4 mRNA及蛋白质在肝癌稳转细胞系中的表达
2.3CCK8试验和克隆形成试验检测肝癌细胞体外增殖能力 CCK8试验结果显示,在肝癌MHCC97L细胞中,与vector组相比,CPA4组细胞增殖能力显著提高。见图3A、表3。在MHCC97H细胞中,与shNC组相比,shCPA4组细胞增殖能力显著降低。见图3B、表3。克隆形成试验结果显示,在肝癌MHCC97L细胞中,vector组和CPA4组的克隆形成数分别为(183.3±34.74)个和(407.0±18.45)个,差异有统计学意义(t=5.686,P=0.005)。见图3C。在肝癌MHCC97H细胞中,shNC组和shCPA4组的克隆形成数分别为(371.3±39.57)个和(137.7±30.28)个,差异亦有统计学意义(t=4.690,P=0.009)。见图3D。
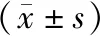
表3 CCK8试验中不同时间点不同组别肝癌细胞的A值
注:A,CCK8试验检测过表达CPA4对肝癌细胞增殖的影响;B,CCK8试验检测敲减CPA4对肝癌细胞增殖的影响;C,克隆形成试验检测过表达CPA4对肝癌细胞增殖的影响;D,克隆形成试验检测敲减CPA4对肝癌细胞增殖的影响;*,P<0.01。
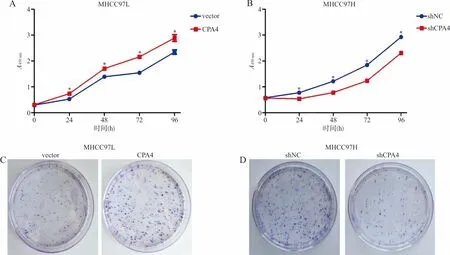
2.4Transwell试验检测肝癌细胞的体外迁移能力 结果显示,在肝癌MHCC97L细胞中,vector组和CPA4组的迁移细胞数分别为(23.00±2.34)个和(123.50±2.18)个,差异有统计学意义(t=11.81,P<0.000 1)。见图4A。在肝癌MHCC97H细胞中,shNC组和shCPA4的迁移细胞数分别为(135.30±6.42)个和(30.00±4.39)个,差异亦有统计学意义(t=13.52,P<0.000 1)。见图4B。

注:A,Transwell试验检测过表达CPA4对细胞迁移能力的影响;B,Transwell试验检测敲减CPA4对细胞迁移能力的影响。
2.5Transwell试验检测肝癌细胞的体外侵袭能力 结果显示,在肝癌MHCC97L细胞中,vector组和CPA4组的侵袭细胞数分别为(26.75±2.39)个和(112.30±9.43)个, 差异有统计学意义(t=8.782,P=0.000 1)。见图5A。在肝癌MHCC97H细胞中,shNC组和shCPA4组的侵袭细胞数分别为(184.00±4.22)个和(32.57±2.49)个,差异亦有统计学意义(t=30.83,P<0.000 1)。见图5B。
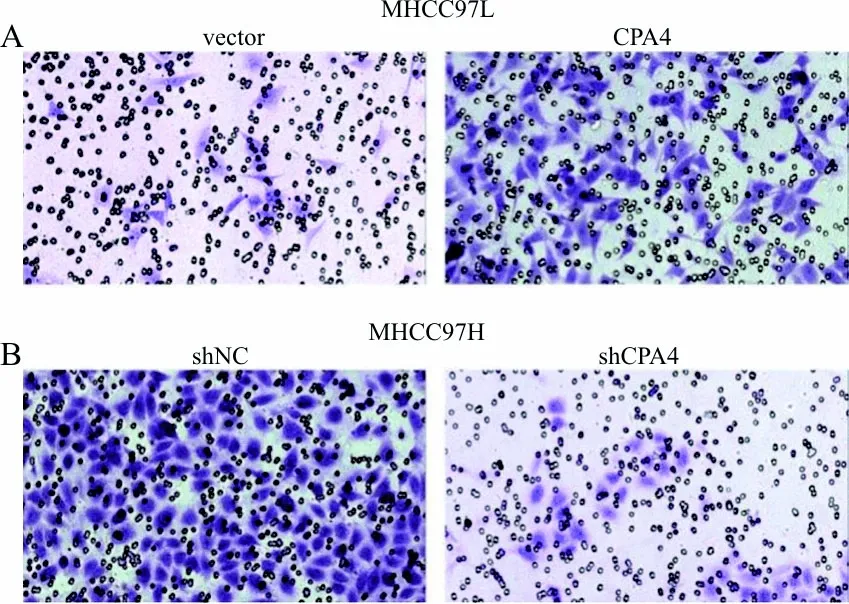
注:A,Transwell试验检测过表达CPA4对细胞侵袭能力的影响;B,Transwell试验检测敲减CPA4对细胞侵袭能力的影响。
2.6western blot检测肝癌细胞中STAT3通路相关蛋白的表达 结果显示,在肝癌MHCC97L细胞中,与vector组比较,CPA4组的STAT3总蛋白的表达水平差异无统计学意义,而p-STAT3和c-myc蛋白表达水平显著升高;在肝癌MHCC97H细胞中,与shNC组比较,shCPA4组的STAT3总蛋白的表达水平差异无统计学意义,而p-STAT3和c-myc蛋白的表达水平显著降低。见图6、表4。
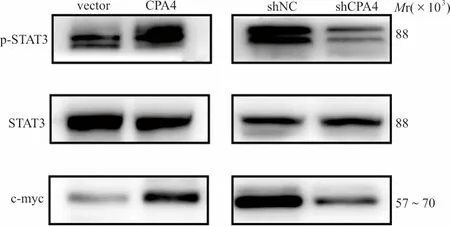
图6 western blot检测CPA4基因对肝癌细胞中STAT3通路相关蛋白质表达的影响
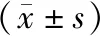
表4 western blot检测CPA4基因对肝癌细胞中STAT3通路相关蛋白质表达水平的影响
3 讨论
CPA4是羧肽酶A/B亚家族的成员,最早在由丁酸钠诱导前列腺癌细胞分化过程上调的mRNA中被筛选鉴定出[5]。在本研究中,通过慢病毒载体感染分别建立CPA4过表达和敲减肝癌细胞系,CCK8试验和克隆形成试验结果显示,过表达CPA4可以显著促进肝癌细胞的增殖,而敲减CPA4后则显著抑制肝癌细胞的增殖,与Pan等[6]在结直肠癌研究中以及Fu等[7]在非小细胞肺癌研究中的结果具有一致性,提示CPA4可能具有作为抑制肿瘤生长的治疗靶点的潜力。同时,本研究通过Transwell试验证实CPA4过表达后可以显著促进肝癌细胞的迁移、侵袭,而敲减CPA4则能显著抑制肝癌细胞迁移、侵袭。表明CPA4可能促进肝癌细胞的转移。CPA4通过激活PI3K-AKT-mTOR通路促进上皮间质转化(EMT),促使胰腺癌细胞的增殖和迁移、侵袭[8];CPA4还能通过激活STAT3和Erk,促进结肠癌细胞的增殖和迁移、侵袭[6];同时,血清中CPA4含量可以预示临床结肠癌患者的肝转移[9],提示CPA4具有作为肝癌生物标志物的潜力。
目前,尚未明确CPA4发挥其促进肿瘤细胞增殖、转移的具体机制。作为一种可溶性外泌蛋白酶,CPA4在细胞外环境发挥重要作用,其神经肽底物已经被证实与细胞增殖和分化的调节相关[1],而CPA4使得这些肽失活,可能会刺激肿瘤细胞的增殖或增强肿瘤的细胞移动性,这为CPA4与某些癌症的侵袭性之间的联系研究提供了实验依据。一些新的研究报道为CPA4的分子机制研究提供了多项新的线索;如Shao等[8]报道在胰腺癌中CPA4通过激活PI3K-AKT-mTOR通路发挥重要作用;Pan等[6]发现在结肠癌中CPA4的功能与STAT3和Erk的激活相关。
STAT3是信号转导及转录激活蛋白(signal transducer and activator of transcription,STATs)家族的成员,是该家族中与促进肿瘤生长和免疫抑制最密切相关的成员,通常在肿瘤浸润性免疫细胞中过度激活[10]。STAT3的过度激活在多种致癌过程中具有重要作用,包括调节细胞周期、防止细胞凋亡、诱导生存因子和建立不受控制的生长[11]。本研究结果显示,过表达CPA4使肝癌细胞中磷酸化STAT3和c-myc的表达水平升高;而敲减CPA4使肝癌细胞中磷酸化STAT3和c-myc的表达水平也降低。研究表明,STAT3蛋白的持续激活能够提高c-myc、周期蛋白D1的表达而促进肝癌细胞的增殖、恶化;同时,STAT3的活化可以上调基质金属蛋白酶(MMP)的表达,促进肝癌细胞的侵袭、转移[12]。因此,本研究认为CPA4可能是通过激活STAT3信号通路促进细胞的增殖、迁移和侵袭,从而在肝癌生长、转移中发挥重要作用。然而,本实验仅检测了STAT3信号通路的改变,而PI3K-AKT-mTOR通路和Erk通路对于CPA4功能的影响尚未进行研究,CPA4的下游直接相互作用靶点也尚未确定,还需要进一步深入的研究来阐明其在肿瘤发生、发展过程中的分子机制,以确认CPA4和STAT3作为肝癌治疗和诊断靶点的潜能。

