腹膜后巨大成熟性囊性畸胎瘤1例报告并文献复习
吴莹,郭瑞霞,袁文静,刘媛媛,李丽鑫
(郑州大学第一附属医院 妇产科,河南 郑州 450000)
畸胎瘤是源于生殖细胞的肿瘤,临床上好发于性腺,原发于性腺外的畸胎瘤较为少见,其主要好发部位依次为前纵隔、骶尾部、腹膜后等[1]。原发性腹膜后畸胎瘤仅占腹膜后肿瘤的5%~10%,在出生后6个月和青少年期出现双峰,只有10%~20%发生在30岁以上,患腹膜后畸胎瘤的女性是男性的两倍[2-3]。因腹膜后畸胎瘤临床症状不典型,易与附件肿瘤相混淆[4],恶变率较高,且手术操作困难,极易造成盆腹腔器官、血管、神经等的损伤,需引起妇科医生重视。本研究回顾性分析郑州大学第一附属医院诊治的1例原发腹膜后成熟囊性畸胎瘤,结合国内外相关文献,分析腹膜后成熟性畸胎瘤的临床特点、治疗及预后,为临床诊治提供依据。
1 临床资料
1.1 一般资料患者,女,29岁,因“体检发现盆腔肿物1 a”于2020年6月3日入院。1 a前至郑州大学第一附属医院进行孕前检查时发现:左侧附件区内可见大小约83 mm×66 mm×96 mm的囊性回声,壁厚,不光滑,内透声差,可见密集的弱回声光点充填(考虑巧克力囊肿可能性大),患者拒绝手术治疗,自行间断口服中药治疗后囊肿未见缩小,遂再次前来就诊。自发病以来,神志清,精神可,大小便正常,体质量无明显变化。患者2 a前曾于外院行“腹腔镜下双侧卵巢巧克力囊肿剥除术”(术后病理结果未见),术后未定期复查。无家族性遗传病及肿瘤史。
1.2 检查检验结果入院接受妇科检查:阴道及直肠后方偏左侧可触及大小约10 cm囊实性包块,表面光滑、活动度差、张力较大、无压痛,余无异常。阴式三维超声:子宫左侧、直肠后方、骶骨前方可及大小约92 mm×65 mm的囊性回声,壁厚、透声差、内充满密集光点漂浮,未见血流信号,提示:腹膜后骶前巨大囊性占位(考虑皮样囊肿或表皮样囊肿)。见图1A。盆腔CT平扫及增强扫描:盆腔内、子宫后方见囊状低密度影,大小约108 mm×83 mm×72 mm,内见分隔影,增强未见明确强化,其下方直肠后方另见一囊状低密度影,大小约23 mm×14 mm,增强未见明显强化,提示:盆腔内子宫后方、直肠后方囊性病变,考虑良性。见图1B。余检查检验均未见异常。
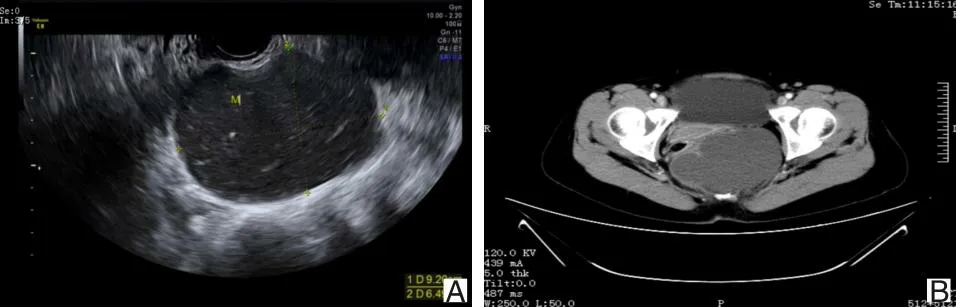
A为阴式三维超声图,显示囊肿大小;B为盆腔CT检查图,显示子宫及直肠后方囊状低密度影
1.3 诊治经过初步诊断:(1)盆腔包块性质待查(巧克力囊肿复发?畸胎瘤?);(2)双侧卵巢巧克力囊肿剥除术后。手术指征明确,查无明显手术禁忌,与患者及家属沟通后,于2020年6月5日全麻下行“机器人辅助腹腔镜下腹膜后肿物切除术+肠粘连松解术”术中探及子宫左后方腹膜后一约10 cm×10 cm囊肿(图2A),与周围组织粘连致密,因囊肿张力大、位置极深,且表面光滑不易钳夹,钝性完整剥除极为困难,遂于表面进针抽吸囊液,但囊液浓稠抽吸困难,吸出囊液呈白色浓稠脂样,未见毛发及牙齿等结构(图2B)。剥除该囊肿后,于直肠偏左侧后方另见一大小约3 cm×3 cm囊肿,与直肠左侧壁粘连极为紧密,术中一同剥除。手术历时376 min,术中出血约200 mL,手术顺利。大体标本:肉眼见(盆腔肿物1)灰白灰红组织一堆,大小共约9.0 cm×6.0 cm×4.0 cm,切面呈囊性,内可见乳白色油腻脂状物,囊内壁大部分尚光滑,质软,壁厚0.1~1.0 cm;(盆腔肿物2)灰红组织一块,大小约4.5 cm×3.0 cm×2.0 cm,切面灰白灰红可见多个囊腔,囊壁光滑,内含少量灰白胶冻样物。病理诊断:(盆腔肿物)成熟性囊性畸胎瘤(图2C、2D)。术后4 d患者恢复良好。无不适,办理出院。2个月后复查盆腔彩超未见异常,经电话或门诊随访,截止2020年10月未见复发或转移迹象。

A为腹腔镜下显示子宫后方腹膜后偏左侧囊肿;B为腹腔镜下显示白色浓稠脂样囊内容物;C、D为成熟性囊性畸胎瘤病理表现(HE染色,×200)。
2 讨论
临床上,畸胎瘤多发生于青少年,且年轻女性患者发病率较男性高。据文献报道,腹膜后成熟性畸胎瘤为良性肿瘤,但具有恶变潜能[5-6]。本文通过对该例患者的病例分析以及中外文献复习,深入学习并探讨腹膜后成熟性畸胎瘤的临床表现、影像学特征以及治疗方式和预后。腹膜后成熟性畸胎瘤为良性肿瘤,深大的腹膜后腔为其提供充足的生长空间,发病初期患者通常无特异临床表现,当肿瘤直径超过5~10 cm时才会出现相关临床症状。本文病例中的患者肿物较大,但并未引起任何不适感,遂初始发现病情时并未引起患者重视,未及时进行诊治。目前中外文献中该病涉及的主诉症状包括腹胀、腹痛、背痛、腹部包块、恶心和呕吐、尿潴留、便秘和由于肿瘤阻塞淋巴而导致的下肢、生殖器肿胀,部分囊肿合并感染破裂后可导致化学性腹膜炎[7-11]。
结合文中病例及中外参考文献,腹膜后成熟性畸胎瘤在超声图像上一般表现为圆形或类圆形混合性回声团块,内部可及高回声、密集光点漂浮、点状或短条状血流信号,通常具有囊壁且厚、边界清,肿块不随呼吸、体位而改变,部分肿瘤可推挤肠管致变形[12-13]。本文中患者的超声图像正如上诉所描述,壁厚且透声差的囊肿内充满密集光点漂浮。查阅各文献中所提到的腹膜后成熟性畸胎瘤的病例,大致总结其在CT图像的一般表现:腹膜后区可及圆形或类圆形软组织团块影,内可见分隔,多种不同密度成分混合存在,包含液体成分、脂肪组织和钙化物,增强后通常无明显强化,在囊肿内出现低衰减的脂肪组织被认为是高度暗示囊性畸胎瘤[14-15]。通过图B得知,该例患者的囊肿位于腹膜后区,且呈类圆形,其内可见低密度成分充填,术中图C及图D也证实该囊肿为壁厚囊性、内可见白色浓稠样液体。MRI图像一般呈现为:异常团块影内可见混杂信号,T1WI上脂肪呈高信号,实体部分等信号,钙化、牙齿、骨骼呈低信号;T2WI上脂肪呈高信号,抑脂呈低信号,合并出血时,其信号随出血吸收各个时期改变而变化[16]。辅助检查对于明确诊断是必不可少的,超声检查便捷、经济、无放射性损伤,但容易误诊,需要有经验的超声科医生才能准确地报出肿瘤的确切位置。高空间分辨率和钙化显像的优势使CT不可或缺。MRI具有较高的空间分辨率及软组织分辨率,能更好地评估肿瘤是否侵犯周围组织及血管,但CT及MRI价格昂贵、费时长、具有放射性、适用范围窄。影像学特征有助于鉴别诊断、肿瘤分期、指导手术及活检,另外,妇科检查(双合诊、三合诊)对发现腹膜后病灶并评估病灶范围、粘连情况也至关重要。
目前腹膜后成熟性畸胎瘤以手术治疗为主,手术方式包括腹式、普通腹腔镜、达芬奇机器人辅助腹腔镜、经骶入路等。腹膜后间隙从横膈膜延伸至骨盆,向前达后腹膜壁层,向后达腹横筋膜,形成腔室。腹膜后肿物位置极深,当肿物较大时,普通腹腔镜器械可能无法到达病灶部位[17],此时达芬奇机器人因其三维立体结构、灵活的机械臂而得以适用,但该术式花费较高[18]。本文病例中,该患者肿瘤体积大、多发、位置较深,经完善术前评估,结合患者经济情况,选择达芬奇机器人辅助手术切除,术后效果良好。另外,部分患者肿瘤长在骶骨前方、直肠后方、位置较低的部位等,经骶入路不失为一种好的选择,但应注意避免神经、血管、骶骨等的损伤[19]。肿瘤的完全切除加病理学诊断是评估良恶性的金标准,术后需要长期随访。根据肿瘤具体部位、患者经济状况、医方因素等合理选择术式。
有研究显示6%的腹膜后成熟性畸胎瘤中发现甲胎蛋白(alpha-fetal protein,AFP)水平升高,但血清标志物对畸胎瘤并不具有特异性,术前需评估各项肿瘤标物,如CEA、CA125、CA199、HCG、AFP等以排除其他生殖系统恶性肿瘤[20]。且有研究指出,AFP水平与腹膜后畸胎瘤的成熟度相关,定期随访AFP可评估疗效,监测疾病复发[21]。但该例患者术前检查并未发现有肿瘤标志物的升高,表明并非所有成熟性畸胎瘤患者血常规中的肿瘤标志物均有异常表现,其无特异性的血清学标志物。腹膜后成熟性畸胎瘤恶变率高达25%,明显高于源于卵巢的成熟性畸胎瘤恶变率,部分可恶变为脂肪肉瘤、鳞状细胞癌、黏液性腺癌、类癌等[22]。Scott等[23]曾报道1例合并有神经内分泌癌的腹膜后成熟性畸胎瘤,Kim等[24]曾报道1例由腹膜后畸胎瘤引起的黏液腺癌。文献中显示,腹膜后畸胎瘤恶变后通常选择以顺铂为基础的辅助化疗,但放化疗均不敏感,目前尚无标准化的化疗方案,长期生存的最佳治疗是完整的手术切除,影响预后的因素主要包括侵犯囊壁、囊壁破裂、肿瘤播散、腹水、粘连和腺癌等[25-26]。
综上,腹膜后成熟性畸胎瘤是一种罕见疾病,国内外相关报道较少,恶变率高,手术完整切除是主要治疗手段,一般预后良好,术后需严密随访。文中患者通过完整手术切除,严密术后随访,并未发现肿瘤复发、恶变、转移倾向,预后良好。

