雷帕霉素促进上颌窦黏膜细胞成骨分化
林彦君 王荣昌 许江汉 刘超玮 陈江 吴东
上颌后牙缺失导致的该区域牙种植手术中骨量不足或骨缺损在临床较为常见,目前对于此类患者的牙种植治疗方式一般是进行上颌窦提升手术并种植[1]。经牙槽嵴上颌窦底提升术是一项具有良好远期成功率的上颌窦提升术术式[2]。而且,很多临床医生在经牙槽嵴上颌窦底提升术过程中不植入骨替代材料。然而,临床上可观察到不植骨同样可获得较好的骨增量,满足了种植手术对骨量的要求[3]。目前的研究表明,不植骨下行上颌窦提升术获得的充足的骨量和上颌窦的成骨潜能有关。上颌窦具有成骨潜能的原因之一是上颌窦黏膜内含有间充质干细胞(mesenchymal stem cells,MSCs),即上颌窦黏膜细胞(maxillary sinus membrane cells,MSMCs)[4]。MSMCs已经被证实具有良好的成骨能力,是一种优秀的组织工程种子细胞[5]。MSMCs作为一种间充质干细胞,具有间充质干细胞的生物学特性。牙龈间充质干细胞作为口腔内常见的间充质干细胞类型,其成骨分化已被证实受自噬影响[6]。而雷帕霉素(rapamycin,RAPA)是经典的mTOR抑制剂,可激活细胞自噬[7]。因此,RAPA对MSMCs成骨分化是否存在影响以及是否通过自噬途径产生影响值得进行探讨研究。
本研究拟行体外分离培养SD大鼠MSMCs,RAPA诱导建立细胞自噬模型并使用透射电子显微镜(transmission electron microscopy,TEM)验证;检测RAPA处理后成骨诱导过程的3 个时间点的碱性磷酸酶(alkaline phosphatase,ALP)表达,钙沉积物数量,成骨相关基因Runx2、和Spp1以及自噬相关基因Anxa3和Becn1的变化,探究RAPA对MSMCs的成骨分化的影响。
1 材料与方法
1.1 主要仪器与试剂
透射电子显微镜(Tecnai G2 F20 S-TWIN,FEI,美国); 滤光片型酶标仪(BIO-RAD iMark,Bio-Rad,美国); 梯度PCR扩增仪[LifeECO TC-96/G/H(b)C,Bioer,杭州博日科技股份有限公司]; 紫外分光光度计(Q5000,Quawell,美国); 实时荧光定量PCR仪(LightCycler 480,Roche,美国);雷帕霉素(MCE,美国);地塞米松、维生素C、β-甘油磷酸钠(Sigma,美国);α-MEM(Hyclone,美国);ALP检测试剂盒(Beyotime,上海碧云天生物技术有限公司);茜素红S染色液(1%,pH4.2)(BioBomei,合肥博美生物科技有限责任公司);Trizol Reagent(Invitrogen,美国);PrimeScript®反转录试剂盒、SYBR®PCR试剂盒(TaKaRa,日本)。
1.2 MSMCs的分离培养
将SD大鼠上颌窦黏膜组织在培养液浸润下剪碎,3 g/L I型胶原酶和4 g/L dispase酶等比混合,37 ℃水浴消化1h,离心弃上清,沉淀用培养液充分混匀,反复吹打离散细胞团块,70 μm细胞筛网过滤获得单细胞悬液,加入含10%胎牛血清的α-MEM培养液,置入3.5 cm培养皿内37 ℃恒温培养箱标准条件下培养。细胞生长融合70%后传代,取第3 代细胞进行后续实验。
1.3 RAPA处理MSMCs后成骨诱导分化
不同浓度的RAPA预处理MSMCs,浓度为0、10、100、1 000 nmol/L,时间为4 h。之后换用成骨细胞诱导分化培养液(10%胎牛血清、0.1 μmol/L地塞米松、0.2 mmol/L维生素C、10 mmol/L β-甘油磷酸钠、100 U/mL青霉素和100 μg/mL链霉素),7、14、21 d后检测ALP活性、钙结节形成量以及自噬和成骨基因的表达量。
1.4 MSMCs自噬水平鉴定
MSMCs用细胞刮刮下,电镜固定液4 ℃固定2 h。锇酸0.1 mol/L磷酸缓冲液(pH7.4)室温固定2 h。酒精梯度脱水。丙酮和812包埋剂等比混合液渗透过夜,纯812包埋剂渗透过夜,60 ℃聚合48 h。 70 nmol/L超薄切片铀铅双染色,室温干燥过夜。TEM下观察拍照。
1.5 ALP活性检测
用RIPA裂解MSMCs,BCA试剂盒测定各组细胞总蛋白浓度,ALP试剂盒检测ALP活性(pNPP法),实验步骤参照厂家说明书。
1.6 茜素红染色
4%多聚甲醛固定MSMCs,20 min后去离子水洗净,加40 mmol/L茜素红(pH=4.2),37 ℃反应30 min。去离子水洗至不再脱色,镜下观察并拍照。
1.7 实时荧光定量PCR
Trizol提取MSMCs总RNA,紫外光谱法鉴定RNA纯度和浓度。使用Prime Script®RT试剂盒,gDNA Eraser去除基因组DNA,加反转录体系,反应条件为37 ℃孵育15 min,85 ℃孵育15 s,4 ℃孵育10 min,反转录合成cDNA。使用SYBR®PCR试剂盒,以反转录产物为模板,用上下游引物PCR扩增目的片段,在实时荧光定量PCR仪内扩增。反应条件为95 ℃预变性30 s,然后 95 ℃ 5 s,60 ℃ 30 s,扩增 40 个周期。Gapdh作为内参。用2-ΔΔCt法计算相关基因的相对表达量。铂尚生物技术(上海)有限公司合成引物序列(表1)。

表1 实时荧光定量PCR引物序列
1.8 统计分析
2 结 果
2.1 MSMCs自噬水平鉴定
MSMCs经不同浓度RAPA处理4 h后胞质内可见自噬溶酶体形成。 0 nmol/L处理水平的MSMCs自身具有一定水平的自噬。RAPA浓度增加,自噬溶酶体数量随之增加。自噬溶酶体呈双层膜结构,根据其内残余细胞器形态可判断内容物主要来自粗面内质网(图1)。RAPA处理后自噬囊泡数量有明显提高并呈剂量依赖性,说明RAPA可有效激动自噬。
2.2 ALP活性检测结果
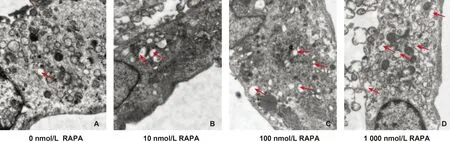
图1 RAPA处理MSMCs 后TEM镜下观(→: 自噬溶酶体)(×8 000)
成骨诱导后7、14、21 d,和对照组(0 nmol/L RAPA处理组)相比,10 nmol/L RAPA处理组、100 nmol/L RAPA处理组、1 000 nmol/L RAPA处理组的ALP表达均有明显差异性(P<0.05)(图2)。
2.3 茜素红染色结果
随着成骨诱导时间的推移,钙结节的数量逐渐增加。成骨诱导后7 d,不同浓度RAPA处理的MSMCs茜素红染色后未见明显着色物质。成骨诱导后14 d和21 d,100 nmol/L RAPA处理组的MSMCs的钙结节物高于其他组别(图3)。
2.4 自噬和成骨基因转录水平检测结果
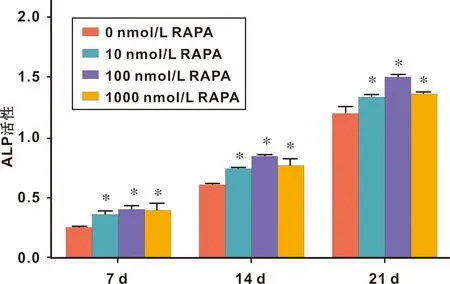
图2 RAPA处理MSMCs后ALP活性检测
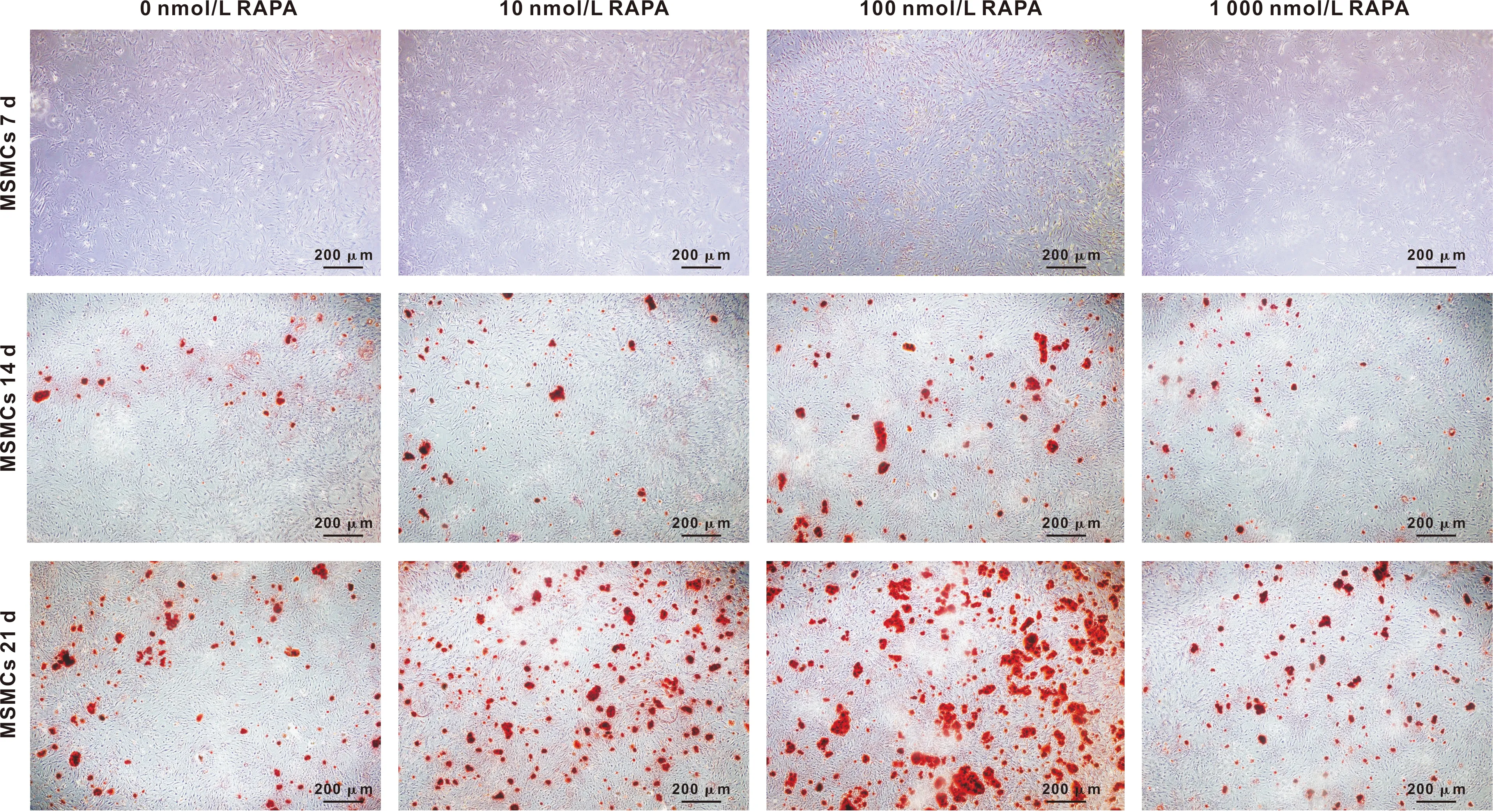
图3 RAPA处理MSMCs后茜素红染色
成骨诱导后7、14、21 d 三个时间点中,只有7 d时,100 nmol/L和1 000 nmol/L RAPA处理组的Anxa3基因表达与对照组(0 nmol/L RAPA处理组)相比,具有统计学差异(P<0.05); 7、14、21 d时,1 000 nmol/L RAPA处理组的Becn1基因表达与对照组相比,具有统计学差异; 7 d和14 d时,100 nmol/L RAPA处理组的Runx2和Spp1基因表达与对照组相比,具有统计学差异(P<0.05)。Anxa3、Becn1、Runx2和Spp1的相对表达量都随着成骨诱导周期延长而减少(图4)。
3 讨 论
上颌窦提升术后的成骨细胞来源历来颇有争议。一部分研究认为,上颌窦提升术后的成骨细胞来源为骨组织来源,比如从牙槽骨和上颌窦骨壁迁移至骨面的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)[8]。而上颌窦黏膜在愈合的早期阶段对种植体顶端骨形成不起作用[9]。但上颌窦黏膜作为上颌窦内不可缺少的解剖结构[10],新生骨在血凝块机化区域经常与上颌窦黏膜接触,提示该膜在愈合中后期具有骨诱导潜能。从上颌窦黏膜中分离获得的MSMCs的生物学特性也进一步明确了上颌窦黏膜是上颌窦提升术后的成骨细胞来源之一[4]。虽然上颌窦黏膜的成骨作用弱于周围的上颌窦骨壁[11],但MSMCs具有不弱于BMMSCs的增殖和成骨能力[12]。MSMCs在成骨分化过程中可有效表达成骨标志基因ALP、BSP、OCN和ON[13]。
MSMCs的成骨分化调节因素十分复杂。RAPA作为外源性药物分子,结合分子靶位点mTOR,激活下游自噬相关分子信号[14]。自噬是MSCs分化过程中与细胞结构重塑相关的重要途径[15]。在细胞分化过程中,自噬途径的改变可影响与形态功能变化相关的需求[16]。例如,自噬可调节白藜芦醇和成骨诱导因子对MSCs成骨细胞分化的协同诱导[6]。但较高的自噬活性会导致MSCs成骨分化潜能降低。将自噬激动剂RAPA或自噬抑制剂3-甲基腺嘌呤(3- methyladenine,3-MA)预处理的MSCs植入裸鼠皮下,结果显示,RAPA处理组异位骨样组织形成增多,而3-MA处理组成骨能力的恢复受抑制[17]。这提示合适水平的自噬促进了MSCs的成骨分化。本研究基本探明了RAPA对MSMCs成骨分化的影响,主要体现在合适浓度的RAPA促进了ALP蛋白、Runx2基因和Spp1基因的表达。而过高浓度的RAPA本身容易引起细胞毒性反应以及自噬内稳态失衡致使细胞凋亡。Anxa3和Becn1作为自噬发生的关键标志物,参与了经典的AMPK通路和MAPK通路。本研究发现MSMCs的Anxa3和Becn1的改变和成骨标志基因具有同步性,提示RAPA对MSMCs成骨分化的调节可能是通过AMPK通路和MAPK通路发挥作用。
综上,本研究结果表明适当浓度的RAPA可促进MSMCs成骨分化,这一过程可能与自噬相关。但RAPA促进MSMCs成骨分化的具体机制尚未阐明,需进一步研究。同时,以上结果也提示骨替代材料或钛表面加载RAPA对上颌窦提升术预后的原位骨量再生可能有促进作用。

