山茱萸多糖对脑微血管内皮细胞氧化损伤的保护作用研究
郭耀东, 张晓文,马应卓,梁旭华
(1.商洛学院 健康管理学院,陕西 商洛 726000;2.商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
山茱萸为山茱萸科落叶小乔木植物,其干燥成熟的果肉为我国传统中药材[1]。山茱萸性微温,味酸、涩,归肝、肾经,具有调节免疫、抗氧化、降血糖、抗炎、抑菌等作用,具有较高的药用价值,在药品和保健品行业中有着广泛的应用[1~3]。2020年,国家卫健委将山茱萸列入“药食同源”管理物质试点,进一步扩展了山茱萸在食品中的应用范围。陕西是我国三大山茱萸主产区之一,山茱萸种植加工产业已成为我省商洛、汉中等地为发展区域经济、实现脱贫攻坚目标而大力的特色产业[4]。
山茱萸中主要生物活性物质为挥发性成分、有机酸及酯类、多糖和鞣质[5~6]。其中,山茱萸多糖(PFC)生物活性已成为近年来的热点研究领域,相关研究已对其体外抗氧化、抑菌、调节免疫及抗衰老作用及机制进行了较为系统的研究[7~10]。血管内皮细胞是人体血脑屏障重要组成部分,对维持正常脑内环境具有重要作用。氧化性低密度脂蛋白(ox-LDL)是血管内皮细胞损伤的重要因素,通过引发动脉血管壁炎性环境形成和脂质沉积,导致动脉粥样硬化的发生[11]。中药多糖能够通过增加ECs活性、促进内皮细胞增殖、抑制内皮细胞凋亡,对血管内皮细胞具有较强的保护作用[12]。笔者研究通过建立内皮细胞氧化损伤模型,系统评价了山茱萸多糖对ox-LDL刺激小鼠脑微血管内皮细胞(bEnd.3)的保护作用,以期为下一步山茱萸多糖的深度利用提供一定理论参考。
1 材料与方法
1.1 主要试验材料和试剂
山茱萸多糖,在商洛学院健康食品实验室按照研究团队前期优化的工艺进行制备[13];胎牛血清,购自上海中乔新舟生物科技有限公司;DMEM高糖培养液,购自美国HyClone公司;胰蛋白酶-EDTA消化液、青链霉素混合液,购自北京索莱宝生物科技有限公司;ox-LDL,购自广州奕源生物科技有限公司;Bax、Bcl-2、caspase3、GAPDH抗体,购于武汉三鹰生物技术有限公司;HRP标记羊抗鼠、羊抗兔二抗,购自北京康为世纪生物科技有限公司;Western blot发光液,购自北京四正柏生物科技有限公司;细胞裂解液、SDS-PAGE凝胶配制试剂盒、蛋白marker、CCK8,购自美国Thermo生物公司;上样缓冲液、瑞氏-姬姆萨染液、BCA蛋白定量试剂盒、丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、一氧化氮(NO)检测试剂盒、内皮素-1(ET-1)检测试剂盒,购自南京建成生物工程研究所;脱脂奶粉,由内蒙古伊利集团股份有限公司生产;其他常规分析纯试剂,由天津科密欧化学试剂有限公司生产。
1.2 主要仪器设备
DH-160I型CO2培养箱,上海三腾仪器有限公司;单人双面洁净工作台,苏州惠丰净化设备有限公司;9140A型电热恒温干燥箱,上海精宏实验设备有限公司;4℃冰箱,苏州三星电子有限公司;-20℃冰箱,北京福意电气有限公司;-80℃冰箱,北京德力莱技发展有限公司;高压灭菌锅,北京博劢行仪器有限公司;电泳仪,美国伯乐公司;摇床,美国Rosi公司;JY96-IIN型超声破碎仪,宁波新芝生物科技有限公司;全自动化学发光仪,美国伯乐公司;显微镜,日本奥林巴斯公司。
1.3 试验方法
1.3.1 CCK8法检测细胞活性 将小鼠脑微血管内皮细胞bEnd.3置于含10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素的DMEM高糖培养基中,每孔按1×105个细胞密度接种于96孔板中,37℃、5% CO2培养中箱静置培养至细胞贴壁后更换无血清培养基,培养液中加入浓度分别为0、30、50、80、100、150、200、300 mg·L-1山茱萸多糖孵育24 h,加入10 μL CCK-8溶液,孵育1~4 h,用酶标仪在450 nm下测定吸光度值。
1.3.2 瑞氏-姬姆萨染色法观察细胞形态 将直径为8 mm的灭菌后的圆形盖玻片平铺于24孔板中,每孔接种5×105个细胞,37℃、5% CO2培养箱内孵化贴壁后,更换无血清培养基孵育24 h。CT组和ox-LDL组加入无血清培养基,ox-LDL+PFC组分别给予含200 mg·L-1的山茱萸多糖无血清培养基,孵育2 h后,除CT组,各孔再加入100 μg·mL-1ox-LDL刺激24 h。结束后用PBS缓冲液清洗各孔3遍后,每孔滴加瑞氏-姬姆萨染液3滴,使整个细胞爬片完全被染液覆盖,2 min后滴加等量PBS缓冲液,混匀,染色5 min;吸掉染液再用水清洗,最后用镊子夹取细胞爬片,轻轻倒扣于滴有水性封片液的载玻片上,干燥后镜检,拍照。
1.3.3 细胞培养液中NO、MDA、SOD、ET-1活性检测 按照1×107个细胞密度,接种至含10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素的DMEM高糖培养基的10 cm培养皿中,分组和培养条件与1.3.2相同。24 h后收集各组细胞上清液,按照NO、MDA、SOD和ET-1检测试剂盒说明书操作。
1.3.4 Western blot检测细胞凋亡相关蛋白水平的表达变化 弃去上述各组细胞培养皿内剩余培养液,加入冰PBS缓冲液冲洗细胞3次,弃掉多余的PBS,每个培养皿加入100~150 μL细胞裂解液,用细胞刮刀刮取细胞,将各组细胞与细胞裂解液的混悬液分别收集在3个EP管内,冰浴条件下进行超声细胞破碎,继续放于冰上裂解30 min,4 ℃下12 000 rpm、离心15 min[14]。 收集各组细胞上清液到新的EP管。按照BCA蛋白定量试剂盒说明书步骤,测定每组上清液的蛋白含量。然后加入上样缓冲液(上清液与上样缓冲液比例为4∶1),混匀[15]。样品在100 ℃下煮沸10 min,4℃保存。取出样品,混匀,置冰上备用,80 V条件下开始电泳,25~30 min后,将电压调至120 V,继续电泳至条带跑至胶板底端。电泳结束后,采用三明治夹心法进行湿法转膜。100 min后取出膜,置于5%脱脂奶粉-PBST液中,摇床上封闭2 h。再将膜置于稀释成一定比例的一抗内,4℃孵育过夜。再用PBST将条带漂洗3次,每次10 min。继续与二抗常温孵育1 h,PBST缓冲液漂洗3次,每次10 min。将膜从PBST缓冲液中取出,放在全自动化学发光仪中,将发光剂按照1∶1的比例配制好充分混匀后,均匀涂抹于膜上,并成像,拍照,利用Image J 1.47图像处理系统对目标条带的灰度值进行分析[16]。
1.4 统计学分析
试验结果均以 X±SEM表示,采用SPSS19.0对相关试验结果进行方差分析。
2 结果及分析
2.1 不同山茱萸多糖处理浓度下的bEnd.3细胞活性试验结果分析
CCK8法检测内皮细胞活性试验结果如图1所示。由图1可知,与CT组比较,山茱萸多糖浓度为300 mg·L-1时,小鼠脑微血管内皮细胞bEnd.3活性显著降低(P<0.05)。说明该山茱萸多糖浓度过高会对细胞产生一定毒性作用,而山茱萸多糖浓度在30、50、80、100、150、200 mg·L-1时,bEnd.3细胞活性影响不显著。最终选择200 mg·L-1为山茱萸多糖的处理浓度。

图1 山茱萸多糖对bEnd.3细胞增殖活性的作用
2.2 山茱萸多糖对ox-LDL刺激的bEnd.3细胞形态影响分析
不同处理条件下的小鼠脑微血管内皮细胞bEnd.3瑞氏-姬姆萨染色结果如图2所示。从图2可见,bEnd.3细胞形态在ox-LDL作用下发生明显变化。与正常细胞相比,ox-LDL组细胞形态不规则,出现核聚头现象,体积明显变小,细胞核明显碎裂,聚集于细胞膜周围。胞浆内出现空泡,内皮细胞受损,甚至发生凋亡改变。ox-LDL+PFC组细胞形态规则,细胞核明显,分布均匀,说明经过山茱萸多糖处理后,受到ox-LDL刺激的bEnd.3细胞状态逐渐恢复。
2.3 山茱萸多糖对ox-LDL刺激bEnd.3细胞中NO、MDA、SOD和ET-1含量影响分析
ox-LDL使内皮细胞减少NO释放,增加收缩因子ET-1释放,SOD活性降低、MDA水平升高。MDA、SOD、ET-1和NO含量是反映内皮细胞损伤的关键指标[17~18]。不同处理条件下的bEnd.3细胞的NO、MDA、SOD和ET-1检测结果如表1和图3~图6所示。ox-LDL刺激能够引起bEnd.3内皮细胞上清液中NO和SOD含量显著下降(P<0.01),MDA和ET-1含量显著上升(P<0.01)。经过山茱萸多糖处理后,上述指标变化发生了显著改变。与ox-LDL组相比,ox-LDL+PFC组细胞中的NO和SOD含量显著升高(P<0.01),MDA和ET-1含量显著下降(P<0.01)。

表1 不同处理条件下bEnd.3细胞中NO、MDA、SOD和ET-1水平比较
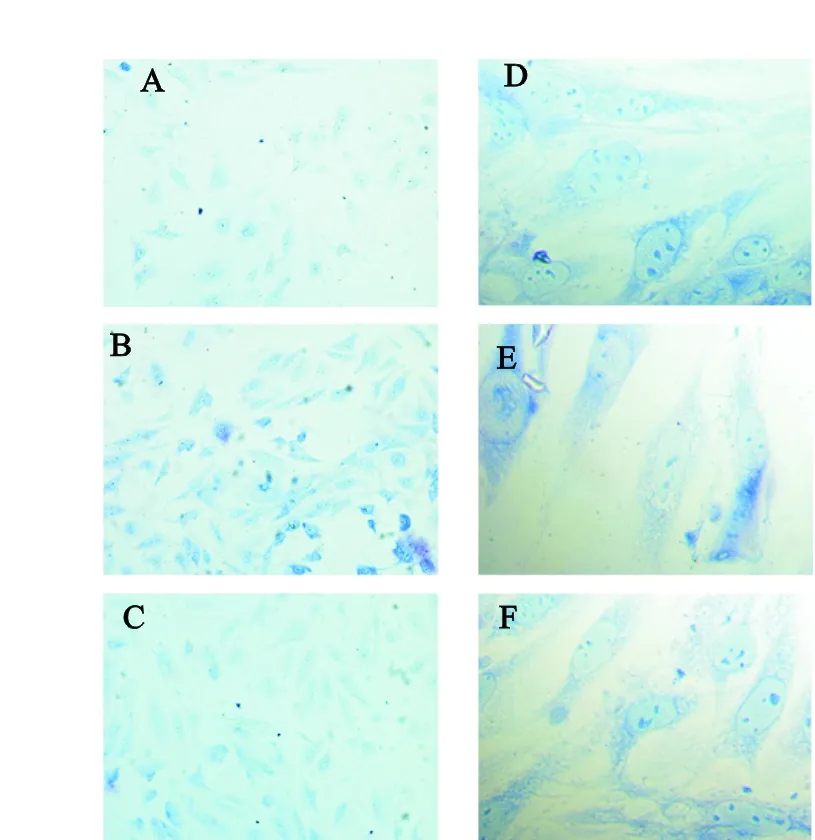
注:①A、D组:CT组,B、E组:ox-LDL组,C、F组:ox-LDL+PFC组;②A、B、C组(200×),D、E、F组(1000×)

图3 山茱萸多糖对ox-LDL诱导的bEnd.3内皮细胞培养上清液中NO含量的影响
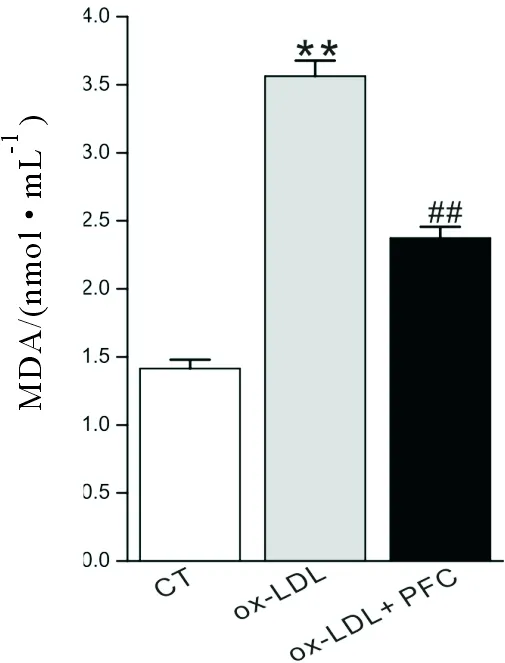
图4 山茱萸多糖对ox-LDL诱导的bEnd.3细胞培养上清液中MDA含量的影响

图5 山茱萸多糖对ox-LDL诱导的bEnd.3细胞培养上清液中SOD含量的影响

图6 山茱萸多糖对ox-LDL诱导的bEnd.3细胞培养上清液中ET-1含量的影响
2.4 山茱萸多糖对ox-LDL刺激引起的bEnd.3细胞凋亡相关蛋白表达影响分析
不同条件处理下的bEnd.3细胞凋亡相关蛋白表达结果如图7所示。由图7可知,经过ox-LDL刺激后,bEnd.3细胞中促凋亡蛋白BAX(P<0.01)和caspase3(P<0.05)表达显著升高,凋亡抑制蛋白Bcl-2表达显著降低(P<0.01),说明ox-LDL刺激能够促进bEnd.3细胞凋亡。而经过山茱萸多糖处理后的bEnd.3细胞中BAX(P<0.01)和caspase3(P<0.05)蛋白表达显著下降,Bcl-2蛋白表达显著升高(P<0.01),说明山茱萸多糖可抑制ox-LDL刺激引起的bEnd.3细胞凋亡。
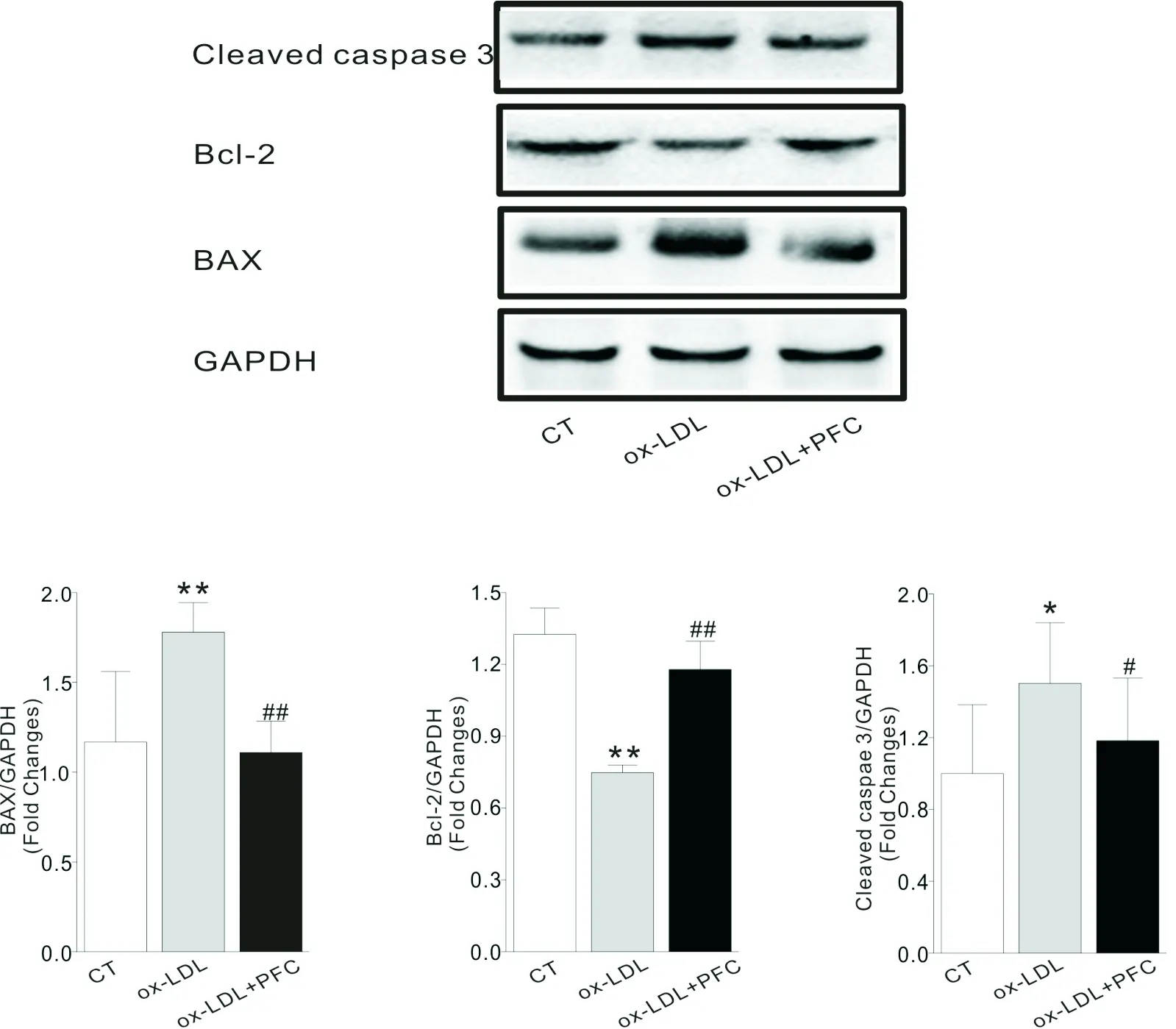
(注:*,#表示P<0.05,**,##表示P<0.01)
3 结论与展望
动脉粥样硬化是慢性心血管疾病中最常见的一种病理过程,可形成动脉内膜下脂质沉积,伴有平滑肌细胞和纤维基质成分的增殖以及动脉粥样硬化斑块,进而发展为冠心病、脑梗塞等慢性心血管疾病[19],严重威胁人类健康。血管内皮细胞损伤是动脉粥样硬化发生的常见因素之一[20]。特别是细胞内低密度脂蛋白经过氧化修饰生成ox-LDL,造成内皮细胞变性、凋亡、坏死、脱落等损伤[21],使血管内皮通透性增加,导致内皮细胞减少舒血管因子NO,并增加收缩因子ET-1的释放,使SOD活性下降、MDA水平升高,引发炎症反应、脂质沉积、粥样斑块形成,促使动脉粥样硬化发生。
笔者研究发现bEnd.3内皮细胞在ox-LDL刺激下细胞形态发生变化,出现细胞增殖分裂能力下降等凋亡改变,细胞上清液中NO、SOD含量显著下降,ET-1和MDA含量显著上升。经过山茱萸多糖处理后bEnd.3内皮细胞细胞状态逐渐恢复,细胞上清液中NO、SOD含量显著增加,ET-1及MDA含量显著降低。说明山茱萸多糖能够在一定程度上保护ox-LDL引发的内皮细胞氧化损伤,抑制细胞凋亡,具有潜在的动脉粥样硬化作用。下一步,笔者研究团队将聚焦于山茱萸多糖在动物整体水平上的抗动脉粥样硬化作用,开展相关研究,为山茱萸多糖的利用提供进一步的理论依据。

