超高效液相色谱-串联质谱法测定血浆中伏立康唑的浓度及其在深部真菌感染患者伏立康唑血药浓度监测中的应用
葛 欣 刘妍妍 刘 平
山东省滕州市中心人民医院药学部,山东滕州 277500
伏立康唑(Voriconazole)是新型第2代三唑类广谱抗真菌药,为氟康唑的衍生物,是治疗侵袭性真菌感染(invasive fungal infection,IFI)的一线药物[1]。由于伏立康唑的体内药代动力学呈非线性,并且受药物代谢酶肝脏细胞色素P450(CYP)2C19 基因多态性和潜在的药物相互作用影响,因此其体内药代动力学参数和血药浓度具有较大的个体差异[2-3]。研究表明,伏立康唑的药物浓度与其治疗效果及用药不良反应高度相关,因此有必要对其进行治疗药物浓度监测,以提高该药物的应用安全性和有效性,实现临床个体化用药[4]。目前已有文献报道的伏立康唑药物浓度监测方法主要为高效液相色谱(HPLC)法和液相色谱-串联质谱(LC-MS/MS)法[5-20]。本试验旨在建立一种简便、快速、准确、高专属性、高灵敏度的测定伏立康唑血药浓度的超高效液相色谱-串联质谱(UPLC-MS/MS)方法,并应用于临床,从而保障用药安全有效,现报道如下。
1 仪器与试药
1.1 仪器
Acquity I-Class 超高效液相色谱仪、Sample Manager FTN自动进样器、Binary Solvent Manager 二 元泵、Xevo TQD 三重四级杆质谱仪、电喷雾离子源(electrospray ionization,ESI)及Masslynx 4.1 数据处理系统(美国Waters 公司);Milli-Q 超纯水机(美国Millipore公司);Eppendorf5804R 低温高速离心机(德国Eppendorf 公司);BSA224S 电子天平(北京赛多利斯科学仪器有限公司);MD 200-2 氮吹仪(杭州奥盛仪器有限公司);IKA-MS3 涡旋混合器(德国IKA 公司)。
1.2 药品及试剂
甲醇、乙腈、甲酸、甲酸铵(色谱纯,美国Fisher Scientific 公司);乙酸乙酯(色谱纯,天津科密欧化学试剂有限公司);氢氧化钠(分析纯,北京百灵威科技有限公司,纯度:97.0%);水为超纯水,由实验室超纯水机自制;对照品:伏立康唑(北京百灵威科技有限公司,纯度:98.0%;批号:942087)、内标氟康唑(中国食品药品检定研究院,纯度:99.7%;批号:100314-201605);空白血浆由山东省滕州市中心人民医院检验科提供,为无菌采制;抗凝剂为EDTA K2,符合各项质量标准。
2 方法与结果
2.1 色谱条件
Acquity UPLCRBEH-C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相:水(含0.1%甲酸及2 mmol/L 甲酸铵,A)-乙腈(B);梯度洗脱(0~3 min,50%A;3~4 min,50%→2%A;4~4.5 min,2%A;4.5~5 min,2%→50%A);流速:0.1 mL/min;柱温:40℃;进样量:1 μL。
2.2 质谱条件
离子源为ESI;正离子电离模式(ESI+);毛细管电压:2.88 kV;锥孔电压:28 V;锥孔温度:110℃;离子源温度:450℃;脱溶剂气氮气(N2)流速:500 L/h;锥孔反吹气流速:50 L/h;采用多反应监测模式(multi reaction monitoring,MRM)扫描;用于定量分析的离子对分别为m/z 350.0→126.9(伏立康唑)和m/z 307.0→219.9(内标)。
2.3 溶液的配制
分别精密称取伏立康唑10 mg 和氟康唑1 mg,分别置于10 mL 量瓶和100 mL 量瓶中,用甲醇溶解并定容,分别获得质量浓度为1 mg/mL的伏立康唑储备液和质量浓度为10 μg/mL的氟康唑储备液。
精密取伏立康唑储备液适量,用甲醇依次稀释,得到伏立康唑质量浓度分别为20、100、500、1000、2000、4000、6000、8000、20 000 ng/mL的对照品系列溶液,置于-20℃冰箱中保存备用。
精密取氟康唑储备液适量,用甲醇稀释成2.0 μg/mL的氟康唑内标溶液,置于-20℃冰箱中保存备用。
2.4 血浆样品的处理
精密吸取血浆样品100 μL,置于1.5 mL 离心管中,加入“2.3”项下的氟康唑内标溶液(质量浓度为2.0 μg/mL)50 μL,加入0.1 mmol/L 氢氧化钠溶液(pH=10)50 μL,涡旋1 min,加入乙酸乙酯1 mL,涡旋5 min,于13 000 r/min(离心半径r=6 cm)低温离心5 min,取上清液转移至另一离心管中,以N2吹干,残渣以乙腈-甲醇(75:25)100 μL 复溶,再以13 000 r/min(离心半径r=6 cm)离心5 min,取上清液1 μL 进样分析。
2.5 血样的采集
12例深部真菌感染患者连续给药3 d后,于第4天给药前1 h 采集患者外周静脉血2~4 mL 至EDTA 抗凝管中,于3000 r/min(离心半径r=6 cm)低温离心5 min,取上层血浆,按“2.4”项下方法处理后,进样分析。
2.6 方法学考察
2.6.1 专属性分别取6份来自不同患者的空白血浆样本、空白血浆+伏立康唑+内标、患者给药后的血浆样本+内标,按“2.4”项下方法处理后,进样分析,记录色谱图,结果见图1。结果表明,伏立康唑和内标的色谱峰峰形良好,分离完全,其保留时间分别为1.56、1.08 min,空白血浆在伏立康唑和内标出峰处均无杂质峰干扰,表明该方法专属性良好。
2.6.2 标准曲线与定量下限分别精密吸取空白血浆50 μL 至1.5 mL 离心管中,加入“2.3”项下的伏立康唑对照品系列溶液50 μL,混匀,配制质量浓度为10、50、250、500、1000、2000、3000、4000、10 000 ng/mL 系列伏立康唑血浆标准曲线样品,按“2.4”项下方法处理,每一份质量浓度样本平行测定2份,记录色谱图。
以伏立康唑峰面积与内标峰面积的比值Y 为纵坐标,伏立康唑质量浓度X(ng/mL)为横坐标,用加权最小二乘法(权重系数W=1/X2)进行线性回归,得回归方程为Y=1.303 93×10-3X+1.002 17,r=0.9992。结果表明,该检测方法在10~10 000 ng/mL 范围内线性关系良好,最低定量下限为10 ng/mL(S/N>5),连续测定5份样本,RSD 为4.96%。
2.6.3 精密度和准确度分别配置伏立康唑的定量限、低、中、高(10、25、1500、8000 ng/mL)4个浓度的血浆样本。按“2.4”项下方法处理样本,于同日内每一质量浓度质控样本平行测定5份,连续测定3 d。根据当日标准曲线计算各样本的浓度,考察方法的准确度和日内、日间精密度,准确度通过计算测定浓度与理论浓度的百分比获得,精密度通过计算RSD 获得,结果见表1。结果表明,日内、日间RSD 均<7%,准确度在95.2%~104.8%。精密度和准确度考察结果均合格。
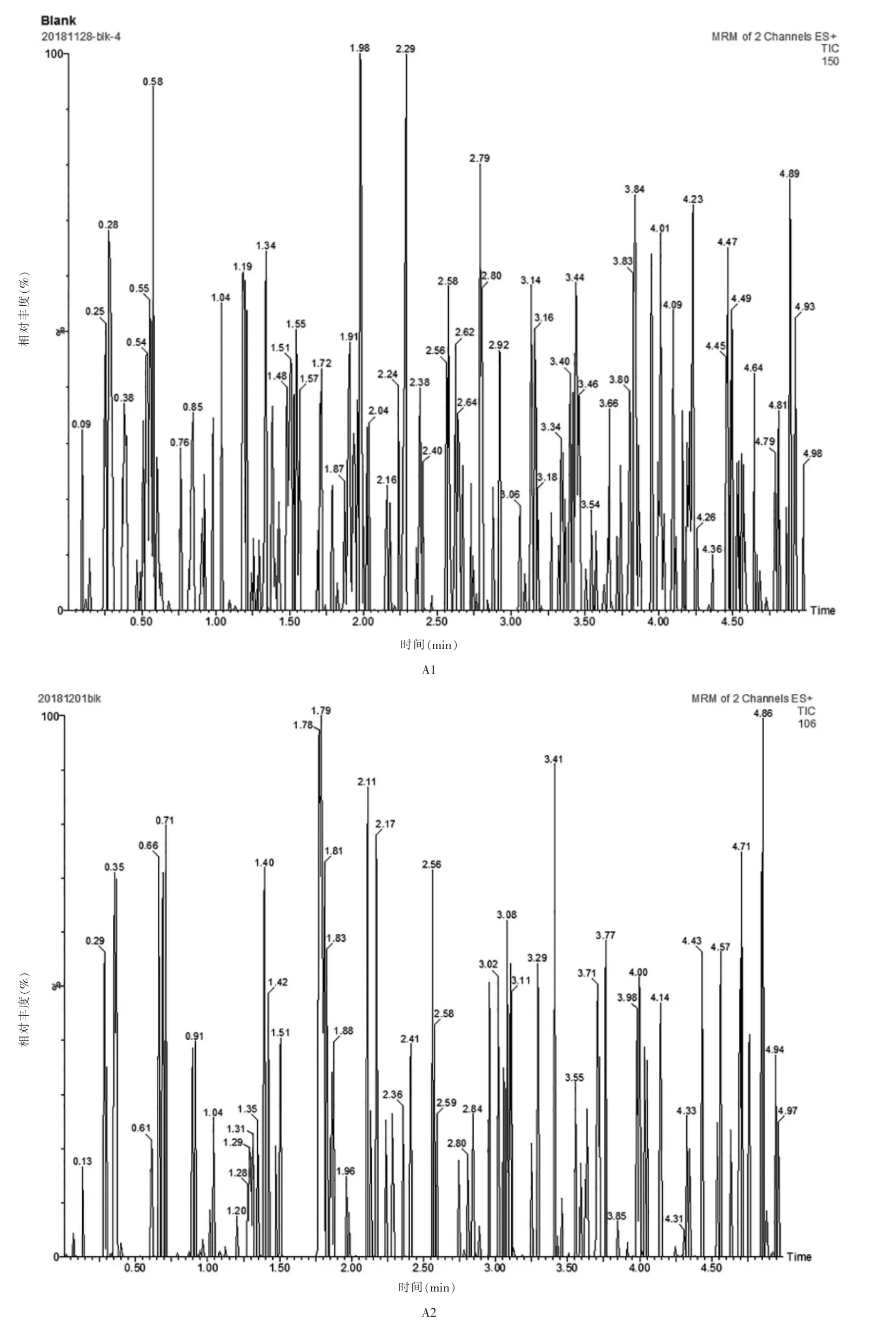

图1 血浆样品的典型LC-MS/MS 色谱图
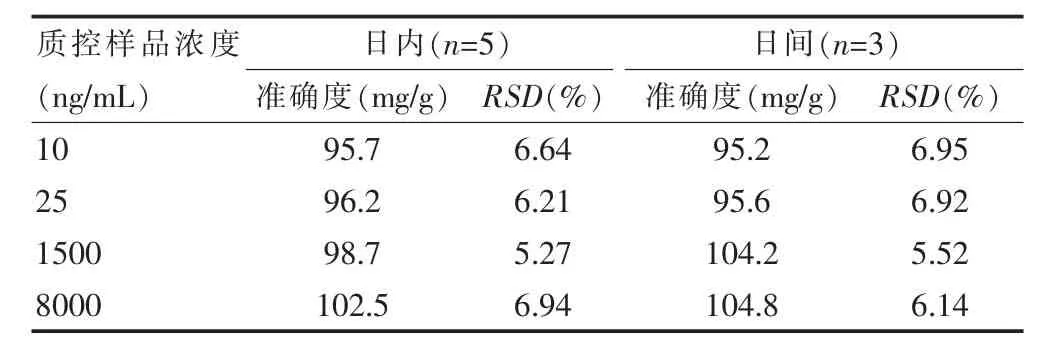
表1 方法精密度和准确度的考察结果
2.6.4 提取回收率和基质效应 取“2.6.3”项下的低、中、高(25、1500、8000 ng/mL)3个浓度的质控样品,按“2.4”项下方法操作,每一份质量浓度样本平行测定6份,获得相应峰面积(A)。同时另取空白血浆100 μL,按“2.4”项下方法处理至取上清液后,加入“2.3”项下的伏立康唑对照品溶液和内标溶液配制成浓度为25、1500、8000 ng/mL的样品,进样获得相应峰面积(B),每一质量浓度样本平行测定6份。同时另取100 μL 流动相代替空白血浆,按上述方法处理,获得相应峰面积(C),每一质量浓度样本平行测定6份。按上述3种方法得到内标峰面积分别为A、B 和C。计算公式为:伏立康唑的提取回收率=A/B×100%,基质效应=B/C×100%;内标提取回收率=A/B×100%,基质效应=B/C×100%。提取回收率和基质效应考察结果见表2。结果表明,伏立康唑的质控样品和内标的提取回收率最小为(75.3±3.25)%,最大为(89.2±5.02)%,基质效应最小为(86.2±8.32)%,最大为(115.3±7.29)%,RSD 均<5%,考察结果合格。
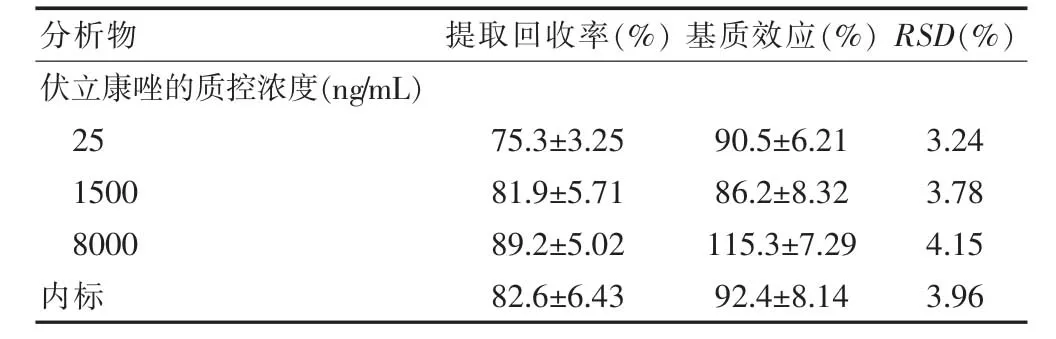
表2 提取回收率和基质效应考察结果(n=6)
2.6.5 稳定性考察 取“2.6.3”项下的低、中、高(25、1500、8000 ng/mL)质量浓度的伏立康唑血浆质控样本,在室温放置24 h,处理后自动进样器(4℃)放置24 h,反复冻融3次,于-80℃环境中冷冻保存60 d后,测定样品的稳定性,每个质量浓度质控样本平行测定5份。结果显示,在上述条件下,伏立康唑的质控样品回收率为92.7%~102.5%,RSD 为4.7%~6.5%。结果表明,在上述稳定性考察条件下,伏立康唑稳定性良好。
2.6.6 伏立康唑的血药浓度监测 收集12例山东省滕州市中心人民医院收治的重症真菌感染患者,其中,男10例,女2例;年龄49~83岁,平均(65±18)岁;肺部感染10例,腹腔感染2例。患者均经临床医师诊断需要伏立康唑片(商品名:威凡,辉瑞制药有限公司,规格:0.2 g/片,生产批号:C20190532)治疗,在3~4个维持剂量后,在下一次给药前1 h 于对侧抽取静脉血2~4 mL 置于EDTA 抗凝管中,3000 r/min(离心半径r=6 cm)离心10 min,取上层血浆,按照“2.4”项下方法处理,进样,测定结果见表3。其中患者的稳态谷浓度最大值为9054.24 ng/mL,最小值为817.29 ng/mL。有4例患者的血药浓度不在推荐治疗浓度范围内,患者出现恶心、发热、皮疹、肝功能异常等明显不良反应。结合患者发生的不良反应和用药情况,已及时反馈给临床医师,从而对治疗方案进行调整。
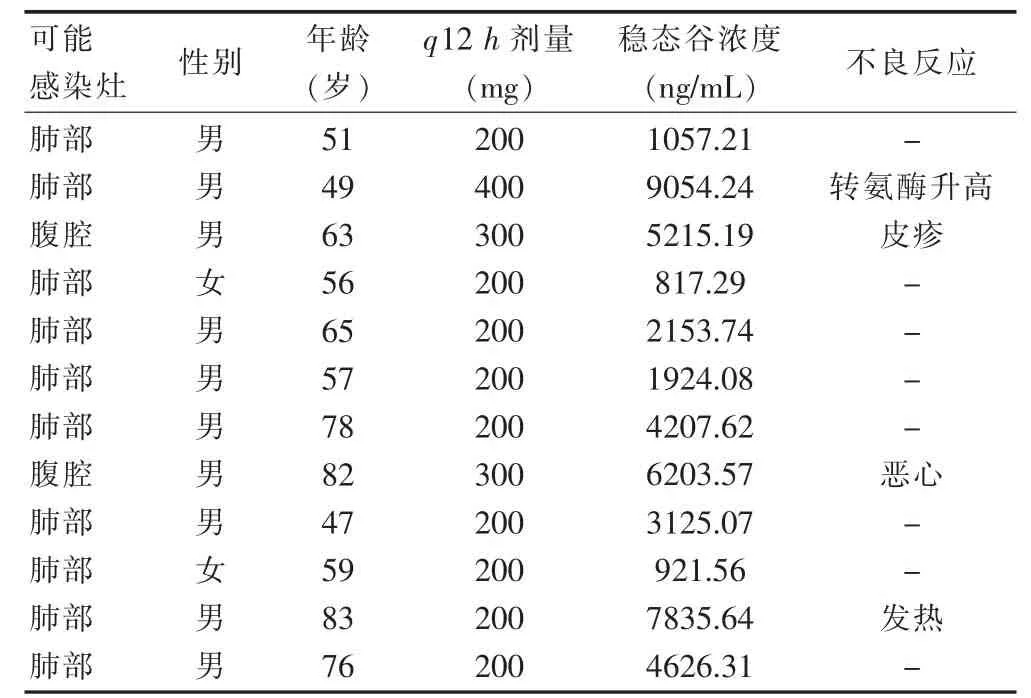
表3 12例患者的临床资料及谷浓度测定结果
3 讨论
目前国内外测定伏立康唑药物浓度的方法主要为HPLC 法和LC-MS/MS 法[5-20],由于LC-MS/MS 法在专属性、灵敏度、检测效率上的优势,已成为近年来治疗药物监测的首选方法。LC-MS/MS 法中,样品前处理方法包括固相萃取、液液萃取和蛋白质沉淀法[10]。由于蛋白质沉淀法通常产生较大的基质效应,而固相萃取成本较高且费时费力[11],本试验采用液液萃取法。已有文献报道的液液萃取的萃取剂包括二氯甲烷、叔丁基甲醚、乙醚-二氯甲烷、乙醚等[5-20],本方法采用毒性较小且安全性较好的乙酸乙酯,经验证提取回收率>75%,基质效应最小为(86.2±8.32)%,最大为(115.3±7.29)%,符合生物样本测定要求。由于伏立康唑为弱碱性药物,可加碱性试剂调节pH值以提高萃取率[5-10]。经本试验验证,调节溶液pH=10时,萃取率达到最高。LC-MS/MS 法中内标选取通常以稳定同位素内标为佳[13],但价格较为昂贵,本方法采用结构相似的氟康唑作为内标,其质谱、色谱条件与伏立康唑较为接近,且信号强、稳定性好。综上所述,本研究所建立的检测方法安全、经济、有效,可为伏立康唑临床合理用药提供支持。
根据《中国伏立康唑个体化用药指南推荐意见》,推荐中国人群目标血药谷浓度范围为0.5~5 μg/mL[22]。通过对12例患者的伏立康唑血药浓度进行监测,并结合临床分析,可认为伏立康唑谷浓度及治疗时间与其不良反应高度相关。若伏立康唑血药浓度超过5 μg/mL,其药物不良反应发生率大大增加。伏立康唑具有非线性药代动力学特点,并且由于15%~20%的亚洲人属于CYP2C19 肝药酶弱代谢者,且患者的年龄、体质量、肝功能都会影响伏立康唑的代谢,因此同一剂量会造成不同人群伏立康唑血药浓度的较大差异。由于本项研究大部分患者为老年患者,病情较为危重,且存在肝药酶、血浆白蛋白等水平上的差异,同时受基础疾病和联合用药的影响,在临床上应结合CYP2C19 基因多态性、患者个体资料、药物相互作用等因素对患者进行个体化给药设计。由于伏立康唑谷浓度个体差异大,临床上可按照体重给药[22],有助于提高其血药浓度达标率。未来研究还需要扩大样本量和进一步的分析加以确认和证实。

