HRT对A/O-BF处理低碳氮比农村生活污水脱氮的影响
凌 宇, 赵远哲, 王海燕*, 闫国凯, 常 洋, 董伟羊, 储昭升, 王 欢
1.中国环境科学研究院环境污染控制工程技术研究中心, 北京 100012 2.中国环境科学研究院, 湖泊水污染治理与生态修复技术国家工程实验室, 北京 100012
我国广大农村地区缺少完善的污水收集和处理系统,大量未经有效处理的生活污水直接排入河流湖泊中,成为水体氮污染的重要来源之一[1-2]. 由于污水收集系统不完善、雨污分流不彻底等原因,农村生活污水碳氮比(C/N)较低,不能满足生物脱氮的要求,而在异养反硝化过程中,碳源不足往往是限制其脱氮的主要因素[3].
缺氧/好氧生物滤池(Anoxic/oxic biofilter, A/O-BF)对污(废)水中氮污染物具有良好的去除效果,且具有较强的抗冲击性能,广泛应用于生活污水[4]、二级生化尾水[5]、高盐废水[6]和焦化废水[7]等的脱氮处理. 通过在A/O-BF缺氧段和好氧段分别添加芦竹和活性炭的方式,构建新型填料A/O-BF来处理低C/N农村生活污水,取得了较好的脱氮效果[8-9]. 空床水力停留时间(HRT)是A/O-BF运行过程中重要的工艺参数,直接影响微生物与基质底物的接触时间及传质过程[10]. HRT过短时,系统内微生物难以实现完全的氮转化过程,系统抗冲击性能较差,出水水质易超标;HRT过长时,系统处理能力过剩,浪费能源且增加处理成本. 因此,确定合理的HRT对保证A/O-BF良好的污染物去除效能和经济性具有十分重要的意义.
1 材料与方法
1.1 试验装置
试验装置为四组有机玻璃材质的A/O-BF小试装置,其中好氧段直径0.11 m,布水区高度0.1 m,石英砂承托层0.1 m;缺氧段直径0.07 m,布水区高度0.1 m,石英砂承托层0.1 m(见图1),实际运行中提高缺氧段高程,使出水重力流入好氧段;好氧段填料层用体积比为1∶1的活性炭与砾石混合填充,缺氧段填料层用体积比为3∶1的芦竹与砾石混合装填. 石英砂、芦竹、活性炭和砾石填料的制备参考文献[8].

注: 1—进水箱;2—提升泵;3—气体流量计;4—空气压缩机;5—回流泵;A—接反冲洗气泵;B—接自来水作反冲洗水.图1 A/O-BF试验装置Fig.1 A/O-BF experimental set-up
1.2 试验设计
试验装置采用连续流进水,进水流量为0.45 L/h,通过改变柱体侧面的出水口位置来调节有效填料层高度,从而改变反应柱的有效容积使其具有不同的HRT. 四组A/O-BF在试验前均已成功启动,因此该研究中未报道启动期数据. HRT的优化试验分为两个阶段:阶段Ⅰ(1~31 d)进行好氧段优化,此时保持缺氧段HRT为6 h,比较好氧段HRT为7、8、9和10 h 时A/O-BF的脱氮效果; 阶段Ⅱ(32~74 d)进行缺氧段优化,好氧段采用阶段Ⅰ优化出的最佳HRT,比较缺氧段HRT为4、5、6和7 h时A/O-BF的脱氮效果. 整个试验过程中,保持好氧段气水比为4∶1,硝化液回流比为200%. 反冲洗每月1次,具体操作步骤如下[11]:好氧段先气洗3 min,再气水联合冲洗4.5 min,最后水洗4 min;缺氧段水洗4 min. 气冲洗和水冲洗的气量和水量分别为0.4和22.89 mL/(m2·min).
试验中采用模拟的低C/N农村生活污水[12](C/N 为1.4~3.0),通过自来水投加葡萄糖、氯化铵和磷酸二氢钾来模拟目标水质(见表1),添加NaHCO3调节进水pH为7~8,保持进水水温为18~25 ℃.
1.3 分析方法
A/O-BF运行稳定阶段,每两天取一次水样,进行水质分析. 其中ρ(CODCr)采用哈希试剂检测法(Hach DRB200, DR1010,美国)测定;ρ(TN)采用TOC测定仪TN测定单元(岛津TOC-VCPH,日本)测定;ρ(NH4+-N)采用纳氏试剂分光光度法测定;ρ(NO2--N)和ρ(NO3--N)采用离子色谱仪(DIONEX ICS-1000,美国)测定;pH采用便携式pH计(Hach PHC10103,美国)测定.

表1 模拟低C/N农村生活污水水质Table 1 The characteristics of the synthetic rural domestic sewage with low carbon to nitrogen ratio mg/L
1.4 高通量分析
在不同HRT条件下系统运行稳定阶段,分别在反应器好氧段和缺氧段不同高度处取填料表面的微生物样本充分混合后进行高通量测序分析[8]. 高通量测序采用MiSeqPE300测序模式,选择细菌16S rRNA V3~V4区引物338F(引物序列为5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(引物序列为5′-GGACTACHVGGGTWTCTAAT-3′)对样品进行测试,再分析得到样品的菌群结构. 使用上海美吉生物医药科技有限公司(上海)的美吉生物云平台对样品中优质DNA序列进行筛选并对测序数据进行分析. 所测得DNA数据的NCBI序列编号为SUB7848620(好氧段)和SUB7862529(缺氧段).
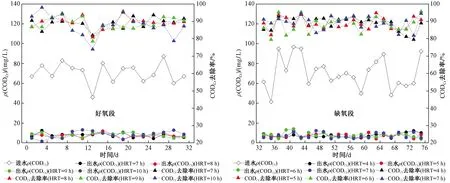
图2 不同HRT条件下A/O-BF对CODCr的去除Fig.2 CODCr removal in A/O-BFs at different HRT conditions
2 结果和讨论
2.1 HRT对CODCr去除的影响
不同HRT条件下A/O-BF对水中CODCr的去除影响见图2. 保持缺氧段HRT为6 h,进行好氧段HRT优化,当进水ρ(CODCr)为(70.44±10.19)mg/L时,4个HRT(7、8、9、10 h)条件下出水ρ(CODCr)分别为(7.82±2.08)(7.48±2.11)(7.85±2.10)和(8.14±3.45)mg/L,去除率分别为89%±3%、89%±3%、89%±4%和88%±6%;保持好氧段HRT为9 h,进行缺氧段HRT优化,当进水ρ(CODCr)为(70.63±15.60)mg/L时,4个HRT (4、5、6、7 h)条件下出水ρ(CODCr)分别为(7.46±1.99)(7.48±2.11)(7.76±2.57)和(7.42±2.63)mg/L,去除率分别为89%±4%、89%±3%、88%±4%和89%±4%. 这说明在好氧段和缺氧段不同的HRT条件下,A/O-BF对CODCr去除率的差别并不大.
A/O-BF对CODCr的去除过程依赖于多种微生物共同完成. 在好氧段,好氧菌利用水中有机物进行细胞增殖和代谢完成对有机物的去除;而在缺氧段,反硝化菌不仅可以利用有机物形成细胞物质,还可以通过反硝化过程将有机物转化为二氧化碳〔见式(1)〕[13]. A/O-BF中好氧、缺氧环境同时存在使得系统中有丰富的微生物种群,保证了对CODCr良好的去除效果,同时使系统具有较强的稳定性. 随着HRT的改变,CODCr去除率变化不大,因为无论是好氧段中的碳氧化菌还是缺氧段中的反硝化菌,对有机物的利用速率都很快,在短时间内即可完成对水中CODCr的去除,故当HRT能满足微生物对有机物的最短利用时间后,再增大HRT并不会显著增加CODCr的去除. 相反,当HRT过大时,会导致生物膜有机负荷的降低,微生物内源呼吸加重,造成生物膜的脱落和微生物数量的减少,不利于污染物的去除[14].
5CH3OH+6NO3-→3N2+5CO2+7H2O+6OH-
(1)
2.2 HRT对NH4+-N去除的影响
不同HRT条件下A/O-BF对水中NH4+-N的去除影响如图3所示. 保持缺氧段HRT为6 h,进行好氧段HRT优化,当进水ρ(NH4+-N)为(32.29±4.40)mg/L时,4个HRT(7、8、9、10 h)条件下出水ρ(NH4+-N)分别为(2.32±0.67)(1.36±0.30)(0.31±0.29)和(0.22±0.19)mg/L,去除率分别为93%±3%、96%±1%、99%±1%和99%±1%. 可见NH4+-N去除率随着好氧段HRT的增加而增加,HRT为9 h时,NH4+-N几乎被完全去除,故9 h是好氧段NH4+-N去除的最佳HRT. 保持好氧段HRT为9 h,进行缺氧段HRT优化,当进水ρ(NH4+-N)为(32.64±2.99)mg/L时,4个HRT(4、5、6、7 h)条件下出水ρ(NH4+-N)分别为(0.22±0.21)(0.37±0.31)(0.28±0.23)和(0.27±0.28)mg/L,去除率分别为99%±1%、99%±1%、99%±1%和99%±1%,表明缺氧段HRT的变化并不显著影响系统对NH4+-N的去除.
学习是一种教与学的交互式活动,单纯依赖模仿和记忆难以实现有效教学,自主探索、合作交流和动手实践是学生学习的重要方式。在学生自主探索过程中,教师要根据教学内容和学生心理特征,适时启发学生,引导学生向知识的深度和广度探索,使其实现知识的永久掌握,培养学习能力,从而主动愉快地学习。
在上流式A/O-BF中,NH4+-N的去除依赖于好氧段中硝化菌的硝化作用,反应速率相对较缓,当HRT较短时就会造成NH4+-N无法完全去除[15]. 同时,好氧段中曝气气流和水流沿着滤池自下而上透过滤料在顶部排出,生物膜外侧有机物和DO浓度较高,繁殖速率快的异养菌主要集中在生物膜外侧,而好氧自养型的硝化菌主要在生物膜内侧[16-17];DO在向生物膜内部扩散时的氧传递效率较低,当HRT不足时,内侧的硝化菌无法得到足够的DO,生长代谢会受到抑制[16],NH4+-N的去除也会受到影响. 因此当好氧段HRT由7 h增至8 h和9 h时,硝化菌获得足够的DO,此时NH4+-N基本完全去除. HRT继续增加会导致运行成本上升,且HRT为10 h时NH4+-N的去除率与9 h相比并无明显变化,所以好氧段运行的最佳HRT为9 h. 丁绍兰等[18]在优化核桃壳-沸石曝气生物滤池的最佳运行工艺参数时发现,当平均进水ρ(NH4+-N)为30 mg/L、气水比为6∶1、HRT为9 h时,系统对NH4+-N的去除率最高(83.16%),这与该研究结果一致.

图3 不同HRT条件下A/O-BF对NH4+-N的去除Fig.3 NH4+-N removal in A/O-BFs at different HRT conditions
2.3 HRT对TN去除的影响
不同HRT条件下A/O-BF对水中TN的去除影响见图4. 保持缺氧段HRT为6 h,进行好氧段HRT优化,4个HRT(7、8、9、10 h)条件下,当进水ρ(TN)为(32.50±5.31)mg/L时,A/O-BF出水ρ(TN)分别为(10.79±0.86)(9.69±0.91)(7.96±0.56)和(7.90±1.04)mg/L,去除率分别为66%±6%、70%±5%、75%±5%和75%±5%. 系统对TN的去除率在好氧段HRT为7~9 h时逐渐升高,当达到9 h后,再增加HRT并不能使TN的去除率进一步提高. 在这4个HRT条件下,A/O-BF出水中的ρ(NO2--N)均极低(<0.5 mg/L),ρ(NO3--N)分别为(7.12±1.24)(7.78±1.18)(7.77±0.87)和(7.56±0.94)mg/L,差别并不显著. 在A/O-BF中,好氧段不能单独完成对于TN的去除,水中NH4+-N必须先通过好氧段中的硝化菌将NH4+-N转化为NOx--N(NO2--N和NO3--N),然后通过硝化液回流至缺氧段,通过微生物反硝化作用将NOx--N转化为氮气排出,从而完成对于TN的去除. 因此,好氧段HRT主要影响硝化菌对NH4+-N的转化程度,使得进入反硝化段的NOx--N含量不同,NOx--N作为反硝化过程的电子受体,其含量多少直接影响缺氧段中微生物反硝化过程,最终使得TN的去除产生差异[15].
保持好氧段HRT为9 h,进行缺氧段HRT优化,由图4可知:当进水ρ(TN)为(33.79±2.98)mg/L时,4个HRT(4、5、6、7 h)条件下出水ρ(TN)分别为(13.77±2.16)(8.84±1.22)(7.32±1.15)和(8.51±0.98)mg/L,去除率分别为59%±7%、74%±5%、78%±4%和75%±4%. 在HRT为4、5、6 h时,TN去除率逐渐增加,这是因为增大HRT可延长反硝化菌与NOx--N的接触时间使反硝化过程进行的更为彻底. 但当HRT增至7 h时,TN去除率不仅没有增加反而稍微下降,这一方面可能是因为当HRT过长时,水中有机物负荷降低,反硝化菌缺乏足够的电子供体导致反硝化过程被抑制;另一方面也可能是因为有机物含量的降低使得生物膜的活性降低甚至导致部分生物膜脱落,减少了系统中的微生物量,最终影响了系统脱氮[14].
综上,好氧段和缺氧段HRT的变化对水中TN去除影响的机理不同,但二者又相互影响. 因此在实际操作中,只有两段都采用最合理的HRT才能取得最佳的脱氮效果. 综合2.1~2.3节的研究结果,确定A/O-BF脱氮过程中好氧段和缺氧段的最佳HRT分别为9和6 h. 此时,好氧段和缺氧段对TN的去除率分别为75%±5%和78%±4%,A/O-BF的TN去除率为0.033~0.054 kg/(m3·d).

图4 不同HRT条件下A/O-BF对TN的去除效果Fig.4 TN removal in A/O-BFs at different HRT conditions
2.4 HRT对填料表面微生物群落结构的影响
2.4.1好氧段中填料表面微生物群落结构
不同HRT条件下好氧段填料表面微生物群落多样性指数见表2,在HRT为7、8、9和10 h时,Good′s Coverage指数相近,均大于0.990,表明所鉴定序列对系统中微生物多样性具有显著代表性[19];在HRT为9 h时,Shannon-Wiener指数、ACE指数和Chao 1指数最大,Simpson指数最小,表明HRT为9 h时微生物群落多样性最为丰富[20].
不同HRT条件下好氧段中填料表面微生物群落分布如图5所示. 由图5(a)可知:在好氧段HRT为7 h时,微生物主要由变形菌门(Proteobacteria)(占比为49.36%)、绿弯菌门(Chloroflexi)(占比为15.37%)、放线菌门(Actinobacteria)(占比为10.37%)和厚壁菌门(Firmicutes)(占比为6.28%)组成;HRT为8 h时,变形菌门(占比为42.23%)、绿弯菌门(占比为19.68%)、放线菌门(占比为11.60%)和拟杆菌门(Bacteroidetes)(占比为6.45%)是优势菌门;HRT为9 h时,变形菌门(占比为54.06%)、绿弯菌门(占比为11.45%)、放线菌门(占比为8.85%)和硝化螺旋菌门(Nitrospirae)(占比为8.52%)为优势菌门;HRT为10时,变形菌门(占比为30.57%)、绿弯菌门(占比为15.84%)、拟杆菌门(占比为10.30%)和放线菌门(占比为9.47%)为优势菌门. 可见,好氧段不同HRT条件下细菌的种群分布有所差异,但总体而言,4种HRT条件下变形菌门、绿弯菌门和放线菌门都是优势种群,此三类细菌门类之和在总细菌门类中的占比分别为75.10%(HRT=7)、73.51%(HRT=8)、74.36%(HRT=9)和55.88%(HRT=10). 也有研究[21-22]发现污(废)水生物处理中的硝化细菌主要属于硝化螺旋菌门和变形菌门. 当HRT为9 h时,填料表面变形菌门和硝化螺旋菌门的占比均最大(分别为54.06%和8.52%);而当HRT为7和8 h时,变形菌门(分别为49.36%和42.23%)占比略小于HRT为9 h(54.06%)时;但当HRT为10 h时,变形菌门的占比有明显的降低(30.57%);硝化螺旋菌门的占比在HRT为7、8和9 h 时明显上升,分别为2.51%、4.31%和8.52%,但随着HRT继续增至10 h时,其占比反而有一些降低(6.99%). 这表明在一定范围内增大HRT有利于硝化细菌的生长,但当HRT过大时,将会对硝化细菌产生不利影响,可能是因为NH4+-N负荷随着HRT增大而降低,低的NH4+-N负荷不利于硝化菌生长,使得硝化菌数量减少[23].

表2 不同HRT条件下A/O-BF填料表面微生物群落多样性指数Table 2 Alpha diversity analysis for biofilm samples on the surface of filter media in A/O-BFs at different HRT conditions

图5 好氧段不同HRT条件下填料表面微生物组成和多样性分析Fig.5 Microbial community diversity and its composition on the surface of filter media in oxic columns at different HRT conditions
由图5(b)可知:当好氧段HRT为7 h时,生物膜中亚硝化单胞菌属(Nitrosomonas)和硝化螺旋菌属(Nitrospira)的占比分别为2.12%和2.49%;HRT为8 h 时,两种菌属的占比分别为3.11%和4.28%;HRT为9 h时,两种菌属占比分别为2.94%和8.48%;HRT为10 h时,两种菌属的占比分别为0.67%和6.97%. 亚硝化单胞菌属和硝化螺旋菌属是污(废)水处理中氨氧化细菌和亚硝酸盐氧化细菌的主要菌属,在硝化过程中起关键作用[24-26],这两种菌属的占比越大预示着系统的硝化能力越强. 在HRT为7、8和9 h时,亚硝化单胞菌属的占比均先增后减,但变幅不大,三者几乎处于同一水平;硝化螺旋菌属的占比随着HRT增大而增加,并呈倍数增长态势;这两种菌属占比之和分别为4.61%(HRT=7 h)、7.39%(HRT=8 h)和11.42%(HRT=9 h),随着HRT的增大有较大程度的增加. 然而,当HRT继续增至10 h时,两种菌属的占比与HRT为9 h时相比分别降低了2.27%(亚硝化单胞菌属)和1.51%(硝化螺旋菌属),两种菌属占比之和也降至7.64%. 此时,亚硝化单胞菌属的占比极低(0.67%),这很有可能影响NH4+-N转化为NO2--N的过程,进而影响整个硝化过程的进行. 上述结果表明,在HRT小于9 h时,增大HRT有助于硝化细菌的生长,但当HRT大于9 h后,继续增大HRT不仅不能促进硝化菌的生长还会减少硝化菌在生物膜中的分布,影响NH4+-N转化,故9 h是好氧段的最佳HRT. 亚硝化单胞菌属和硝化螺旋菌属的变化结果与2.2节中NH4+-N的去除率随HRT的变化结果相一致.
2.4.2缺氧段中填料表面微生物群落结构
不同HRT条件下缺氧段填料表面微生物群落多样性指数见表2. 由表2可见:缺氧段4种HRT (4、5、6、7 h)条件下的微生物种群 Good′s Coverage指数相近,均大于0.990;在HRT为6 h时,Shannon-Wiener指数、ACE指数和Chao 1指数最大,Simpson指数最小,表明HRT为6 h时微生物群落多样性最为丰富.

图6 缺氧段不同HRT条件下填料表面微生物组成和多样性分析Fig.6 Microbial community diversity and its composition on the surface of filter media in anoxic columns at different HRT conditions
不同HRT条件下缺氧段填料表面微生物群落分布如图6所示. 由图6(a)可知:HRT为4 h时,变形菌门(占比为43.78%)、拟杆菌门(占比为17.05%)、绿弯菌门(占比为12.27%)和厚壁菌门(占比为11.89%)为缺氧段微生物群落的主要细菌门类;HRT为5 h时,变形菌门(占比为34.30%)、绿弯菌门(占比为24.35%)、拟杆菌门(占比为14.13%)和放线菌门(占比为5.70%)为主要菌门;当HRT为6和7 h时,主要细菌门类均为变形菌门(占比分别为60.99%和32.34%)、绿弯菌门(占比分别为14.11%和28.83%)、拟杆菌门(占比分别为8.16%和10.84%)和放线菌门(占比分别为4.42%和8.36%). 整体来看,不同HRT使得细菌丰度发生了变化,但细菌种类均以变形菌门、拟杆菌门、放线菌门、绿弯菌门和厚壁菌门为主. 上述菌门是实际污(废)水微生物反硝化脱氮过程中主要涉及的细菌门类[27-31].2.3节中TN去除率在HRT为4、5、6 h时逐渐增大,但当HRT增至7 h时,TN去除率不仅没有增加反而稍微下降. 在HRT为6 h时,系统中变形菌门的占比远高于HRT为4、5、6时,且这3种HRT下变形菌门占比无明显差异,表明系统中参与脱氮的微生物可能主要属于变形菌门.
从图6(b)可知:缺氧段HRT为4 h时,不动杆菌属(Acinetobacter)(占比为18.12%)、绿菌属(Chlorobium)(占比为11.51%)和Trichococcus(占比为7.40%)的丰度最高;HRT为5 h时,JG30-KF-CM45(占比为9.86%)、Haliangium(占比为8.62%)和暖绳菌属(Caldilinea)(占比为5.59%)是缺氧段的优势菌属;HRT为6 h时,缺氧段的优势菌属为JG30-KF-CM45(占比为8.78%)、暖绳菌属(占比为5.87%)和Denitratisoma(占比为5.83%);HRT为7 h时,缺氧段的优势菌属为不动杆菌属(占比为35.84%)、肠杆菌属(Enterobacter)(占比为5.44%)和暖绳菌属(占比为3.92%). 其中不动杆菌属、绿菌属和暖绳菌属都被证实有一定的脱氮能力,但在生物脱氮过程中的贡献并不大[32-36].Denitratisoma为变形菌门的异养菌属,具有反硝化脱氮能力,被多数学者认为是生物反硝化脱氮过程中的主要参与者[37-38],因此,其丰度占比的大小最能反映整个系统的脱氮能力. 在HRT为4、5、6和7 h时,Denitratisoma的占比分别为0.81%、2.90%、5.83%、3.27%,说明HRT由4 h增至6 h的过程中,微生物系统的反硝化脱氮能力在逐渐增强,因此在一定范围内增大HRT有利于提高A/O-BF的脱氮效果. HRT继续增至7 h时,Denitratisoma的占比有了一些下降,表明该HRT条件不利于反硝化菌的生长,可能是因为过长的HRT会显著降低水中氮和有机物的负荷,破坏了反硝化菌最适的生存环境,使得内源呼吸作用加剧,致使其丰度下降. 综上,不能通过无限制地增加HRT来强化脱氮,6 h是缺氧段最佳的HRT,这与2.3节所得结果一致.
3 结论
a) A/O-BF对CODCr有较好的去除效果,在好氧段和缺氧段进水ρ(CODCr)分别为(70.44±10.19)和(70.63±15.60)mg/L,改变各工段HRT时,A/O-BF对CODCr的去除率仍在88%以上.
b) 在进水ρ(NH4+-N)和ρ(TN)分别为(32.50±5.31)和(32.29±4.40)mg/L、好氧段HRT为7、8、9和10 h时,A/O-BF对二者的平均去除率分别为93%、96%、99%、99%和66%、70%、75%、75%;在进水ρ(NH4+-N)和ρ(TN)分别为(32.64±2.99)和(33.79±2.98)mg/L、缺氧段HRT为4、5、6和7 h时,A/O-BF对二者的平均去除率分别为99%、99%、99%、99%和59%、74%、78%、75%. 这表明HRT会影响微生物与底物接触时间和传质过程,从而导致脱氮效果差异. 在A/O-BF运行过程中,好氧段和缺氧段最佳HRT分别为9和6 h.
c) 高通量测序结果表明:好氧段中硝化过程的关键菌属为亚硝化单胞菌属(Nitrosomonas)和硝化螺旋菌属(Nitrospira),在HRT为9 h时两种菌属的占比为11.42%,明显高于7 h(4.61%)、8 h(7.39%)和10 h(7.64%);缺氧段中反硝化过程的主要菌属为Denitratisoma,在HRT为6 h时其占比为5.83%,明显高于4 h(0.81%)、5 h(2.90%)和7 h(3.27%),这与A/O-BF运行结果一致.

