外源性典型N-酰化高丝氨酸内酯类化合物(AHLs)信号分子对污水处理过程N2O产生的影响
闫 旭, 霍兆曼, 石博文, 黄佳骏, 郭 丽, 陈 纯, 郑仕侃, 杨 洁, 马嘉晖, 苏现伐, 孙剑辉
1.河南师范大学环境学院, 黄淮水环境与污染防治教育部重点实验室, 河南省环境污染控制重点实验室, 河南 新乡 453007 2.河南省生态环境监测中心, 河南 郑州 450046
氧化亚氮(N2O)是一种强温室气体,化学性质稳定,平均寿命长达116年[1-2],其100年增温潜势为二氧化碳(CO2)的265倍,并且还能够破坏臭氧层、促进酸雨形成[3]. 城市污水处理厂由于在生物脱氮过程中能够大量产生N2O而备受关注,每年通过污水处理厂释放的N2O占全球人为释放量的3.2%[4-5],并且还以年均0.25%~0.31%的速率持续增长[6-7]. 如何在保证污水处理效率的同时减少N2O排放,已经成为污水处理行业面临的新挑战.
目前,污水处理工艺主要通过硝化和反硝化反应实现生物脱氮. 硝化反应主要发生在好氧单元,反硝化反应主要发生在厌氧或缺氧单元,理论上,硝化和反硝化过程均可能产生N2O[8-9]. 已有研究发现,低C/N、高pH、低污泥龄和低温等运行条件也能间接引起N2O产生[9-13],其根本原因都是微生物对水质和环境条件做出的响应.
长久以来,人们普遍认为细菌是以单细胞形式存在的生物个体,生长代谢过程主要受到外界环境条件影响,相互间不存在信息交流和协作分工[14]. 但近些年研究发现,各种微生物之间能够通过分泌自诱导物(Autoinducer),也称信号分子,实现细胞与细胞间的通讯,控制其群体行为,这种细胞间的信息交流方式被称为群体感应(Quorum sensing)[15-16]. 群体感应能够通过自诱导物激发菌体内相关基因的表达,协调菌群生理行为,表现出单个个体细菌无法实现的生理功能和调节机制,对微生物EPS的合成、群集运动、聚集生长、以及菌群增殖速度与世代长短等生理行为产生重要影响[17-18].
已有研究[19-22]发现,城市污水处理过程中的活性污泥中也有群体感应信号分子存在. LI等[23]在活性污泥系统中发现,投加N-酰化高丝氨酸内酯类化合物(AHLs)能够提高活性污泥的粘附性、硝化效果和微生物生长速率,同时显著影响EPS的含量和其中多糖、蛋白质、脂类等成分组成. Mellbye等[24]研究了群体感应对维氏硝酸杆菌(Nitrobacterwinogradskyi)的作用,发现群体感应能够显著增加硝化过程中氮氧化物(NO、NO2和N2O)的产生和消耗速率,并且大幅提高关键功能基因nirK含量. 可见,信号分子对生物脱氮过程及微生物关键功能基因表达都具有重要影响. N2O产生于生物脱氮过程,与群体感应现象具有潜在联系,但目前关于信号分子对N2O产生的影响还缺乏深入研究.
选取两种N-酰化高丝氨酸内酯类化合物(AHLs)信号分子C6-HSL(N-己酰L-高丝氨酸内酯)和C8-HSL(N-辛酰-L-高丝氨酸内酯),综合考察其外源性投加对AO工艺污水处理效果、N2O产生特征及微生物群落结构的影响,以期为污水处理厂高效脱氮和温室气体减排提供科学依据.
1 材料与方法
1.1 试验装置和运行条件
图1为模拟装置示意图. 装置的有效容积为2.4 L,上部密封仅保留气体取样口和废水进入口,下部留有曝气口和污水取样口. 一个反应周期包括15 min进水(1.2 L废水)、120 min厌氧处理、390 min好氧处理、30 min沉淀和15 min出水,厌氧和好氧处理期间每间隔30 min,同时采集气样和水样[25]. 该研究中厌氧段ρ(DO)控制在0.2 mg/L以下,好氧段ρ(DO)均控制在(2.0±0.2)mg/L.ρ(污泥)控制在 3 000 mg/L,为保持污泥处于悬浮状态,采用磁力搅拌器(85-2型,上海司乐仪器有限公司)搅拌,搅拌器转速为300 r/min;通过气泵送风曝气,曝气量根据ρ(DO)通过空气流量计控制.
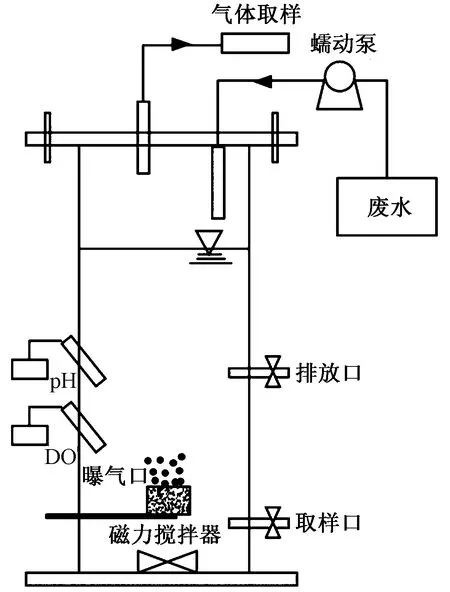
图1 试验装置示意Fig.1 Schematic diagram of experimental equipment
该文共运行3个相同反应器,接种污泥取自新乡市小尚庄污水处理厂好氧池,运行2个月反应器稳定后,其中两个在进水时分别投加信号分子C6-HSL和C8-HSL(Sigma-Aldrich),c(C6-HSL)和c(C8-HSL)均为2×10-6mol/L,另一个反应器为对照组.
1.2 试验材料
试验用水为某小区生活污水,ρ(CODCr)为(402.0±0.5)mg/L、ρ(NH4+-N)为(41.3±0.2)mg/L、ρ(NO3--N)为(0.85±0.20)mg/L、ρ(TN)为(44.2±0.4)mg/L.
1.3 N2O的气体采样
1.3.1厌氧段
厌氧段采样方法参照YAN等[10]研究,采样时通过密封的法兰将集气罩固定在反应器顶部,每隔3 min气样从集气罩顶部气阀通过聚四氟乙烯管采集到50 mL的聚丙烯注射器中,然后通过三通阀进入50 mL气袋(LB-301-0.05,大连德霖气体包装有限公司)保存. 厌氧段液体表面的N2O释放通量F1〔mg/(m2·min)〕通过式(1)(2)计算[10]:
(1)
(2)
式中:V为从液面到装置顶部的体积,m3;A为装置液面表面积,m2;ρ为试验装置内N2O密度,mg/m3;M为N2O的分子量,44.02 g/mol;P为大气压,1 atm(1 atm=101 325 Pa);R为气体常数,0.082 L·atm/(K·mol);T为温度,K;Δc/Δt为采样期间装置内ρ(N2O)随时间的变化,10-9min-1.
1.3.2好氧段
好氧段气体采样时,仍然通过集气罩密封连接装置,流出气体通过聚四氟乙烯管收集到50 mL的气体采样袋中,每次采样均采集3个平行样品,好氧段液体表面的N2O释放通量F2〔mg/(m2·min)〕通过式(3)计算[10]:
(3)
式中:c为采样气体的浓度,10-9;Qa为曝气速率,m3/min.
1.4 样品分析方法
该研究中ρ(CODCr)、ρ(NH4+-N)、ρ(NO3--N)、ρ(TN)和ρ(NO2--N)均按照标准方法测定[26],ρ(DO)和pH采用WTW340i型手持pH溶解氧测定仪(哈希水质分析仪器有限公司)测定,N2O浓度采用配有6rNi的电子捕获检测器(ECD)的气相色谱仪(Angilent-7890B, 美国安捷伦公司)进行测定.
1.5 微生物群落结构
采用DNA提取试剂盒(MO.BIO PowerSoilTM, USA)提取污泥样品中总的DNA,使用16S RNA基因V3~V4区通用引物进行扩增,引物序列为338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GG ACTACHVGGGTWTCTAAT-3′),使用Gene AmpR PCR系统(9700, AB, USA)进行PCR扩增. 试剂采用60 μL体系,包括10× Ex Taq Buffer 6 μL、dNTP 6 μL、BSA 0.6 μL、Ex Taq 0.3 μL、Primer F 1.2 μL、Primer R 1.2 μL、DNA 1 μL、补充dd H2O至43.7 μL. PCR反应条件:扩增程序为94 ℃预变性5 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,31个循环;72 ℃延伸10 min,降温至22 ℃结束. 最后将纯化产物在Illumina MiSeq平台(Illumina, San Diego, USA)进行高通量测序. 以上微生物的测定与分析均委托上海美吉生物医药科技有限公司完成.
2 结果与讨论
2.1 信号分子对处理效果的影响
图2显示了投加信号分子后污染物浓度在一个反应周期内的变化情况. 表1显示了3个反应器主要污染物的去除率. 3.反应器CODCr去除率差异不大,均在93.0%以上,但投加C6-HSL和C8-HSL的反应器中ρ(CODCr)在厌氧段下降明显较快,这可能是由于投加信号分子加强了系统的反硝化作用,增加了有机物消耗. 含氮污染物(NH4+-N、NO3--N、NO2--N)在投加信号分子后浓度变化差异明显.ρ(NH4+-N)在投加信号分子的反应器中下降更快,表明硝化速率提高,NH4+-N去除率也比对照组分别提高了1.7%(C6-HSL)和2.2%(C8-HSL). 而TN去除率在投加C6-HSL和C8-HSL后分别提高了7.6%和5.4%. 另外,3个反应器在厌氧和好氧处理阶段都发生了不同程度的NO2--N积累现象,但投加信号分子后处理系统中出现的最高ρ(NO2--N)都显著降低.
在污水生物处理过程中,信号分子与脱氮过程关系密切[13]. FENG等[22]研究外源性信号分子对硝化过程的影响时同样发现,信号分子C6-HSL能明显提高硝化污泥的氨氮降解速率. YU等[27]在对膜生物反应器的研究中发现,AHLs类信号分子能够显著影响AOB的活性,进而对水处理系统生物脱氮效率产生影响. 结合以上结果,表明C6-HSL和C8-HSL能够强化污水硝化过程,同时提高反硝化效果.

图2 信号分子对主要污染物浓度的影响Fig.2 Influence of signal molecules on removal of main pollutants

表1 信号分子对污水处理效果和N2O产生的影响
2.2 信号分子对N2O产生的影响
图3显示了一个反应周期内,投加信号分子对N2O逸散特征的影响. 由图3可以看出,反应器好氧段N2O释放速率明显高于厌氧段,投加信号分子的反应器的释放速率几乎在整个反应周期都高于对照组. 投加C6-HSL和C8-HSL后,反应器内N2O的释放速率显著升高,N2O总逸散量分别增加了39.0%和11.0%,N2O转化率也由对照组的0.32%分别提高至0.46%和0.41%(见表1). 该研究中,N2O主要释放于好氧段(见图3、表1),3个系统好氧段N2O释放量分别占总量的76.54%、88.36%和88.08%. 尽管投加信号分子后厌氧段的绝对释放量也有所增加,但好氧段增幅更加显著.
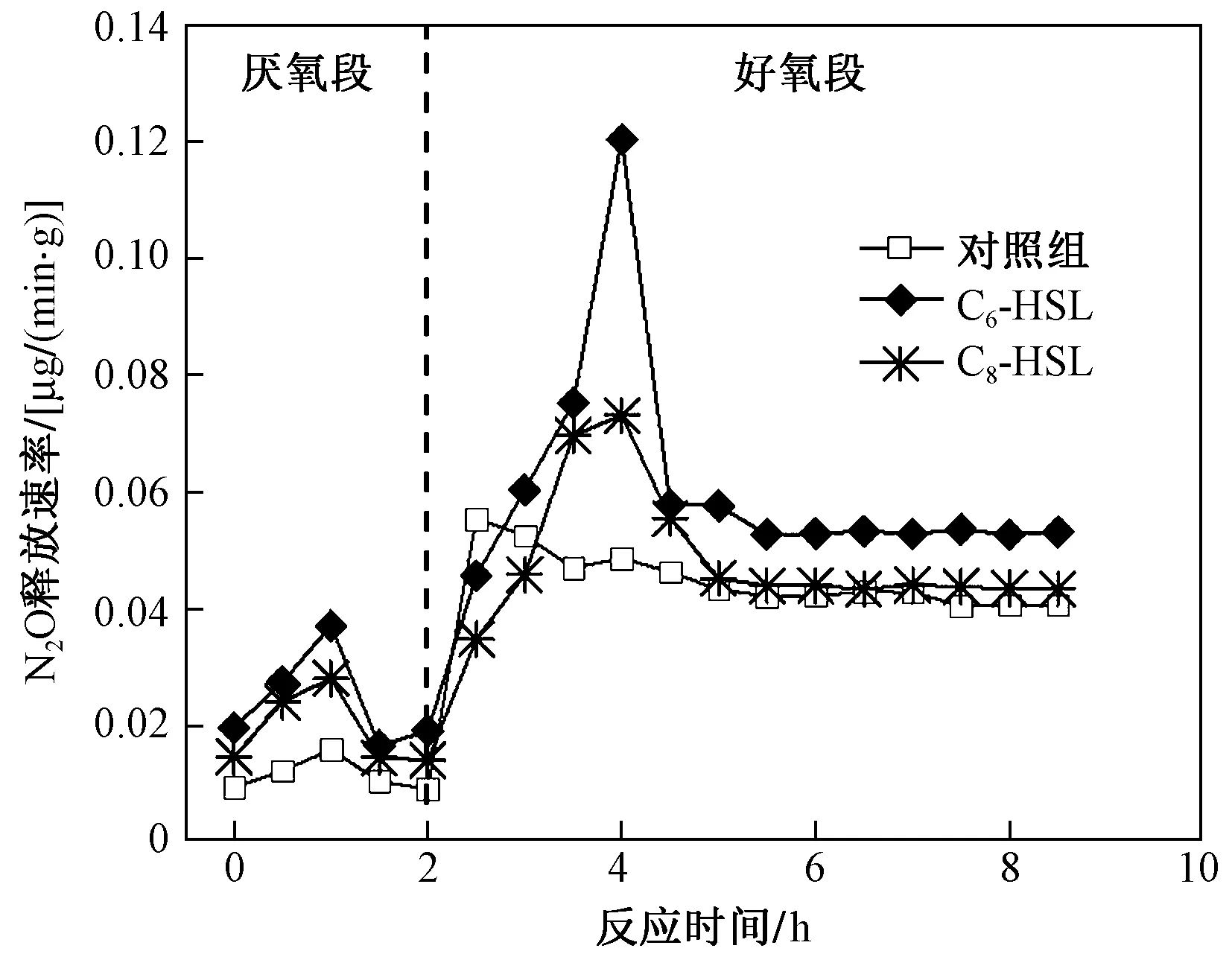
图3 信号分子对N2O产生特征的影响Fig.3 Effect of signal molecules on N2O production characteristics
3个反应器中N2O释放速率的变化规律均与ρ(NO2--N)一致,这是因为NO2--N在硝化和反硝化过程中都是重要的中间产物[9]. 硝化过程中,NO2--N积累会诱发AOB发生反硝化作用,将NO2--N还原产生N2O[28];反硝化过程中,N2O是一种必然出现的中间产物,由于反硝化过程中各种酶对电子的竞争能力不同,NO3--N还原酶竞争能力最强,而N2O还原酶对电子的竞争力较弱,因此NO2--N积累与N2O产生经常同时出现[2,29]. 结合N2O产生速率的变化特征可以看出,硝化细菌反硝化是该研究中N2O产生的主要途径.

图4 信号分子对微生物群落结构的影响Fig.4 Effects of signal molecules on microbial community structure
2.3 信号分子对系统微生物群落结构的影响
图4(a)显示了门分类水平上优势菌群(相对丰度大于0.5%)在3个反应器中的相对丰度. 投加信号分子后,WS6、Proteobacteria和Bacteroidetes的相对丰度显著下降,其中投加C6-HSL的反应器比对照组分别减少了12.4%、0.7%和0.5%,投加C8-HSL的反应器比对照组分别减少了13.7%、7.7%和2.3%. 而Chloroflexi、Acidobacteria的相对丰度则在投加C6-HSL和C8-HSL后分别增加了2.2%、5.8%和3.3%、18.5%.
图4(b)显示了属分类水平上优势菌群在投加信号分子后相对丰度的变化情况.norank-p-WS6、Shinella、Mesorhizobium、Defluviimonas、Rhodobacter、norank-p-Parcubacteria和norank-p-Gracilibacteria在投加信号分子C6-HSL和C8-HSL后,相对丰度都出现了不同程度的下降. 在投加C6-HSL的反应器中,norank_ f_Sandaracinaceae、norank_f_Saprospiraceae、Thauera、unclassified_f_Comamonadaceae、norank_o_Alphaproteobacteria_Incertae_Sedis、Dokdonella、norank_ f_Gemmatimonadaceae和Candidatus_Competibacter的相对丰度都发生了不同程度的上升;在投加C8-HSL的反应器中,norank_f_Blastocatellaceae_Subgroup_4、DS-100、unclassified_ f_Blastocatellaceae_Subgroup_4、norank_ f_Anaerolineaceae和Leucobacter的相对丰度明显增加. 这表明信号分子能够显著影响污水处理系统的微生物群落结构.
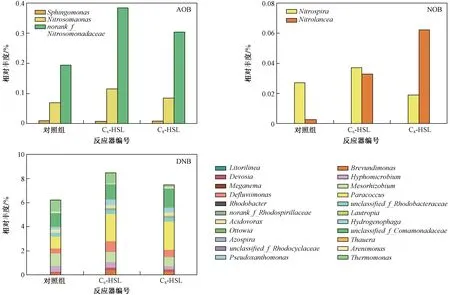
图5 信号分子对生物脱氮功能微生物相对丰度的影响Fig.5 Effect of signal molecules on the relative content of function microorganisms involved in biological nitrogen removal
图5显示了系统中与脱氮相关的3种功能微生物〔氨氧化细菌(AOB)、亚硝化细菌(NOB)和反硝化细菌(DNB)〕相对丰度的变化情况. 由图5可以看出,投加C6-HSL和C8-HSL后,3种功能微生物的相对丰度均有所上升,这也是系统硝化能力增强、TN去除率升高的原因. AOB的相对丰度在投加C6-HSL和C8-HSL后由0.3%分别增至0.5%和0.4%,其中,norank_f_Nitrosomonadaceae相对丰度的变化最为明显,由0.2%分别增至0.4%和0.3%,Nitrosomonas的相对丰度由0.07%分别增至0.10%和0.09%,但Sphingomonas几乎没有发生变化. NOB的相对丰度在投加C6-HSL和C8-HSL后由0.03%分别增至0.07%和0.08%,其中,Nitrolancea由0.002%分别增至0.03%和0.06%,Nitrospira在投加C6-HSL的反应器中由0.03%增至0.04%,在投加C8-HSL的反应器中由0.03%减至0.02%. DNB的相对丰度在投加C6-HSL和C8-HSL后由6.3%分别升至8.5%和7.5%,其中Paracoccus、unclassified_f_Comamonadaceae、Defluviimonas、Hydrogenophaga的相对丰度依次由1.0%、1.1%、0.4%、0.2%分别升至2.2%、1.2%、0.9%、0.48%和2.3%、1.5%、0.6%、0.4%.
功能微生物相对丰度的变化是影响反应器脱氮效果和N2O产生的根本原因. 投加信号分子后,AOB和NOB含量的上升使反应器硝化效果提升(见表1),但由于好氧反应初期,系统中污染物浓度较高,AOB和NOB会对DO产生竞争,AOB的竞争力较强,从而导致一定时期内硝化反应停留在亚硝化阶段,产生NO2--N积累现象[30-31];同时,AOB也是硝化细菌反硝化反应的作用微生物,在ρ(DO)较低时能够通过反硝化作用把NO2--N还原为N2O,其含量的增加导致了好氧段N2O产生量的增加[2,32]. 因此,投加信号分子促进AOB含量升高的同时,也增加了来自硝化细菌反硝化途径的N2O产生量,这是投加信号分子导致N2O产生量增加的主要原因. 反硝化阶段中,投加信号分子后,DNB的相对丰度上升,系统反硝化能力增强,TN去除率也随之升高.
3 结论
a) 在AO工艺中,外源性信号分子C6-HSL和C8-HSL能够显著提高系统的脱氮效果,NH4+-N和TN去除率均有所上升.
b) 信号分子C6-HSL和C8-HSL对系统N2O产生量影响显著,投加二者后N2O产生量分别增加了39.0%和11.0%,增量主要产生自AOB主导的硝化细菌反硝化反应.
c) 外源性信号分子能够显著影响污水处理系统的微生物群落结构,两种信号分子C6-HSL和C8-HSL均能够增加系统AOB、NOB和DNB的相对丰度,这也是系统脱氮效率和N2O产生量变化的主要原因.

