MN1在脑胶质瘤患者肿瘤分级及预后生存中的研究
侯 波,王振国,滕 川
(1.山东省淄博市第一医院 神经外科,山东 淄博 255200;2.山东省淄博市第一医院 肿瘤二科,山东 淄博 255200;3.武警特色医学中心 神经外科,天津 300162)
神经胶质瘤原发性中枢神经系统(CNS)肿瘤,在临床上是最难治愈的肿瘤之一[1]。除了其细胞起源多样,神经胶质瘤还显示出分子和遗传的异质性[2]。胰岛素样生长因子(IGF)系统就是其中一种与胶质瘤有关的途径,在神经胶质瘤中表达上调[3-4]。IGF1受自身调节和重组人胰岛素样生长因子结合蛋白(IGFBP)的调节[3]。IGFBP5的表达除受IGF1的调节,还受视黄酸(RA)、脑膜瘤蛋白1抗体(MN1)调节,与肿瘤恶性度和不良预后相关[5-6]。MN1作为一种转录共调节因子,与视黄酸受体/视黄酸x受体(RAR/RXR),激活RA介导的IGFBP5表达[7-8]。还已知MN1的缺失与患者神经发育异常有关[9]。上述研究证实了MN1和IGFBP5两个基因表达的水平相关,因此,本研究推测可以通过MN1预测人类神经胶质瘤患者的生存率。
1 材料与方法
1.1 标本来源 肿瘤标本来源于2015年7月至2018年7月淄博市第一医院神经外科行手术切除的87例神经胶质瘤患者。87例患者中,男42例(48.3%),女45例(51.7%);年龄为(38.5±6.8)岁(19~65岁);肿瘤最大径为(4.7±2.1)cm(2.3~6.5 cm)。随访时间为(43±14)个月(27~63个月)。根据2016年世界卫生组织对神经胶质瘤进行的进一步分级[5],将I级和II级肿瘤分类为低度恶性神经胶质瘤(LG)29例,将III级和IV级的肿瘤分类为高度恶性神经胶质瘤(HG)58例。商业购买正常非肿瘤性大脑MN1与IGF-1、IGFBP5 mRNA和蛋白用于正常对照。本研究获得淄博市第一医院伦理委员会批准(审批号:201506003),所有患者或家属均签署知情同意书。

表1 胶质瘤病例的临床资料
1.2 试剂和材料 RNA提取试剂盒购自碧云天生物科技(北京)有限公司,实时荧光定量试剂盒购自美国sigma公司。IGFBP5、IGF1、MN1和GAPDH抗体购自美国Abcam公司。
1.3 实时定量PCR 按照使用说明,使用TRIZOL试剂从小鼠脑组织中收获总mRNA,按照表1中列出了靶基因特异性引物的序列,使用ReverTra Ace qPCR RT试剂盒进行cDNA的合成,SYBR Green实时PCR预混试剂盒进行逆转录酶qPCR分析,StepOnePlus实时荧光定量PCR仪实时定量PCR,实时PCR数据分析以β-actin为内参,采用2-ΔΔCt法分析。

表2 实时PCR中使用的引物序列
1.4 Western blot 将肿瘤组织破碎后使用RIPA缓冲液从脑组织中收集蛋白质,BCA法测定蛋白总浓度,使用十二烷基硫酸钠聚丙烯酰胺凝胶,电泳后,半干转移至聚偏二氟乙烯膜上。使用5%脱脂牛奶在室温下封闭膜2 h,然后在4°C下分别与一抗(IGFBP5、IGF1、MN1和GAPDH)孵育过夜。用TBST洗涤后将膜与山羊抗兔二抗(1∶2 000)在室温下孵育1 h。使用增强的化学发光系统(ECL试剂盒)检测免疫反应性条带,并使用ImageJ 1.42q软件程序分析图像。
2 结果
2.1MN1在LG组表达水平高于HG组 如图1所示,LG组MN1 mRNA 与蛋白表达水平高于sham组,而HG组MN1 mRNA 与蛋白表达水平低于sham组,差异具有统计学意义(P<0.05);HG组与LG组相比,MN1 mRNA 与蛋白表达水平显著下降,差异具有统计学意义(P<0.05,见图1)。

A:MN1mRNA表达水平;B:MN1蛋白表达Western blot条带;C:MN1蛋白表达水平量化。*:与sham组相比,P <0.05,#:与LG组相比,P <0.05。
2.2MN1表达水平与神经胶质瘤分级相关性比较MN1mRNA表达水平与神经胶质瘤分级负相关(r=-0.763,P=0.000),按照WHO分级分组,4个分组间差异具有统计学意义(P<0.05,见图2,表1)。
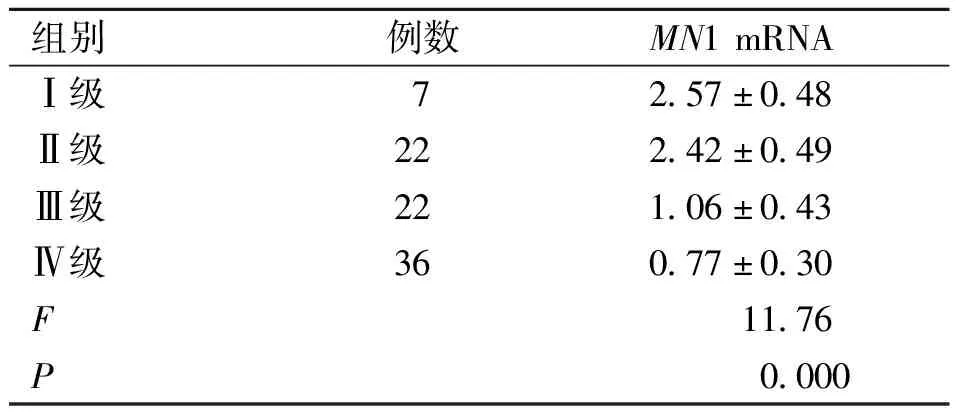
表1 神经胶质瘤各分组MN1mRNA表达比较
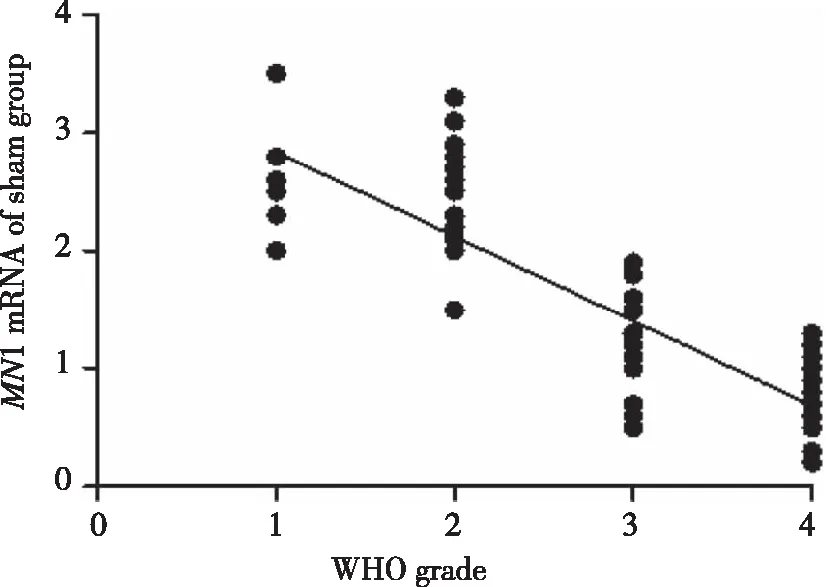
图2 MN1mRNA表达与神经胶质瘤相关性
2.3MN1表达水平与总生存期的影响 LG组分为低表达量MN1亚组(LGL组)和高表达量MN1亚组(LGH组),LGL组生存率低于LGH组,但差异不具有统计学意义(P=0.162,见图3A);HG组分为低表达量MN1亚组(HGL组)和高表达量MN1亚组(HGH组),HGL组生存率显著低于HGH组,差异具有统计学意义(P=0.022,见图3B)。
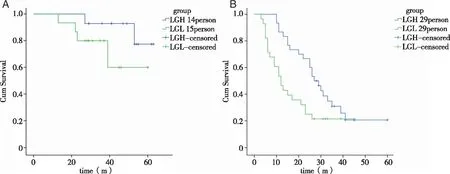
A:低度恶性神经胶质瘤组(LG组,29例)中低表达量MN1亚组(LGL组,14例)和高表达量MN1亚组(LGH组,15例)生存曲线比较;B:高度恶性神经胶质瘤组(HG组,58例)中低表达量MN1亚组(HGL组,29例)和高表达量MN1亚组(HGH组,29例)生存曲线比较。
2.4IGF1、IGFBP5 mRNA 与蛋白表达水平 与sham组相比,LG组和HG组IGF1mRNA与蛋白表达水平明显升高,差异具有统计学意义(P<0.05);HG组与LG组相比,IGF1 mRNA与蛋白表达水平显著下降,差异具有统计学意义(P<0.05),与sham组相比,LG组和HG组IGFBP5mRNA与蛋白表达水平明显升高,差异具有统计学意义(P<0.05);HG组与LG组相比,IGFBP5 mRNA 与蛋白表达水平显著下降,差异具有统计学意义(P<0.05,见图4)。

A:IGF1mRNA表达水平;B:IGFBP5mRNA表达水平;C:IGF1、IGFBP5蛋白表达Western blot条带;D:IGF1蛋白表达水平量化;E:IGFBP5蛋白表达水平量化;*:与sham组相比,P<0.05,#:与LG组相比,P<0.05。
2.5MN1与IGF1、IGFBP5相关性 在LG组、HG组和所有患者组中MN1mRNA值与IGF1和IGFBP5mRNA值均呈负相关,差异具有统计学意义(P<0.05,见表2)。
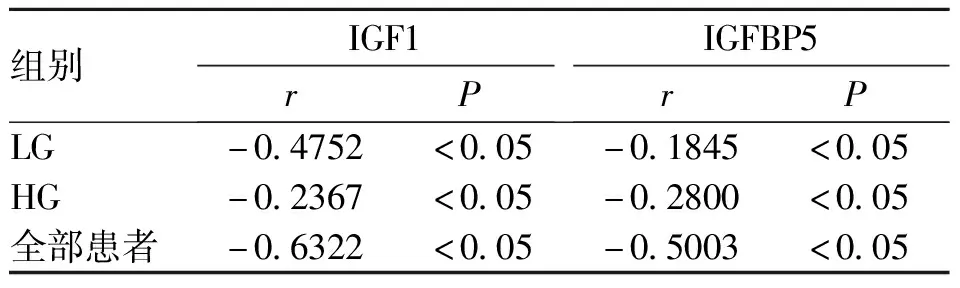
表2 MN1与IGF1、IGFBP5相关性
3 讨论
研究显示MN1的共调节基因位于22号染色体上,该基因在人脑肿瘤中突变[10]。然而,人脑胶质瘤中MN1的改变尚未得到系统的评估。本研究发现MN1表达量增加预示着神经胶质瘤患者更好的生存率。此外,MN1、IGF1和IGFBP5的共同分子作用可能是神经胶质瘤预后的重要因素,在预测患者预后方面具有临床意义。
本研究观察到MN1表达与肿瘤分级负相关,且在HG组MN1过表达预示着更好的临床预后。Chen等曾报道神经胶质瘤低度恶性组中的MN1表达增加。生存分析测试结果中,在LG组和HG组MN1表达上调的患者显示出生存优势。MN1具有转录调节子的特性,但缺少DNA结合结构域,因此起着协同调节子的作用[10-11]。研究表明,MN1与RAR/RXR之间的合作对于RA介导的IGFBP5转录调控至关重要[8],还已知IGF1调节IGFBP5[12]。在本研究中发现HG组IGF1、IGFBP5的表达较高,而MN1表达在LG组和HG组中与IGFBP5负相关,因此,在神经胶质瘤中,IGFBP5可能同时受到MN1和IGF1的调节。这也表明MN1倾向于抑制神经胶质瘤中IGFBP5的表达。但是,IGF1可能与MN1介导的阻遏作用相反,增强IGFBP5的表达。抑制和激活调节力之间的这种分子相互作用共同决定了IGFBP5表达。这些研究结果有助于对评估临床预后。
在HG组中,较低的MN1水平可能导致较小的抑制,由于IGF1介导的表达诱导而导致IGFBP5积累。类似于以前的报告,发现LGG和HGG中的IGFBP5过表达预示了不良的中位生存期[13]。因此,神经胶质瘤中IGBP5的水平似乎可以通过MN1和IGF1的相反作用以肿瘤分级特异性的方式进行微调,从而可以预测患者的生存率。
本研究首次得出,MN1表达量与胶质瘤预后生存相关,与IGFBP5表达成反比。基于前文分析,本研究提出MN1、IGF1和IGFBP5的相互调节作用,决定了不同神经胶质瘤等级及临床进程和特征。未来课题组研究将从神经胶质瘤的细胞和分子水平进一步验证其对神经胶质瘤病理学的意义。

