基于RNA-seq技术的何首乌对衰老小鼠脑组织转录组学影响的研究
李文谦,杨江权,邹佳益,吴德静,徐 林,范 芳,葛正龙
(遵义医科大学 基础医学院生物化学与分子生物学教研室,贵州 遵义 563099)
衰老,为多种因素造成的机体退行性过程。随着全球性人口老龄化问题的日益突出,预计到2025年,中国60岁以上人口将达到3亿,成为老龄化大国,给现代的农业生产、卫生医疗保障体系带来一定的冲击[1]。同时,衰老也是许多疾病的危险因素,如阿尔茨海默症、帕金森病、糖尿病、癌症等[2-3]。阿尔茨海默症是一种慢性神经退行性病变,也是老年痴呆症中较常见的类型,发病率在老年痴呆中占50%~60%。随着人口老龄化,预计到2050年,全球患者将达到1.5亿人[4]。帕金森病是第二大中枢神经系统退行性疾病,在我国65岁以上人群的患病率为1 700/10万,患病总人数已达260万例,约占世界PD患者一半,随着人口老龄化,预计每年新增PD患者20万例,至2030年将有500万例[5],严重威胁人类健康。因此,揭示衰老本质和寻求抗衰老方法、药物的研究已成为当今的世界性重大医学课题。
在抗衰老药物研究中,中药及其有效成分对表观遗传的作用正日益受到重视,中药可以作用于表观遗传的多个环节,参与调控基因转录及其表达,包括当归、人参、灵芝、何首乌、三七等,其中以何首乌和灵芝研究最为广泛[6]。何首乌,是贵州重要的地道药材之一,为蓼科植物。全株皆可用药,尤以根部为佳[7],其干燥块根味苦、甘、涩,性温,归肝、心、肾经,具有补肝肾、益精血、乌须发、强筋骨、抗衰老的作用[8-9],已有研究证实何首乌在阿尔茨海默病、高脂血症等疾病中有强大的药用价值[10],可消除衰老动物体内自由基[11-12],达到抗衰老、延年、保护心脏的作用[13],还可通过降低活性氧的产生来达到神经保护作用[14]。
为了探索何首乌对延缓脑衰老的作用机制,本实验将对何首乌提取液治疗D-半乳糖导致的衰老小鼠脑组织的转录组数据进行分析,筛选出差异表达基因(DEG),为探索何首乌提取液对延缓脑组织衰老的作用靶点提供实验依据。
1 材料与仪器
1.1 实验动物 SPF级6~8周龄雄性C 57 BL/6小鼠30只,购于陆军军医大学医学实验动物中心,许可证号SCXK(辽)015-0001。
1.2 试剂和仪器 D-半乳糖:美国Sigma药品公司;何首乌粉末:遵义医科大学第一附属医院中药房,中国;Trizol、氯仿、75%乙醇、异丙醇等试剂自备;冷冻离心机(MICRO173,美国);实时荧光定量PCR仪(EFX96,美国);微量核酸蛋白分析仪(Eppendorf,德国);PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(Takara,日本);TB GreenTM Premix Ex TaqTM Ⅱ试剂盒(Takara,日本)。
1.3 药物制备 将何首乌粉末与75%乙醇按1∶6进行回流煎煮1 h,共进行2次,将2次得到的提取液4 000 r/min进行离心,取上清液用旋转蒸发仪真空浓缩回收乙醇至无醇味,使何首乌提取液浓度以生药计为1 g/mL,-20 ℃保存备用。
2 方法
2.1 动物分组及建模 将30只6~8周龄雄性C 57 BL/6小鼠,适应性饲养1周,灯光12 h交替照明,自由饮食。而后随机分为空白组(CC),模型组(MC),何首乌提取液治疗组(MM),MC组和MM组每天腹腔注射D-半乳糖,连续60 d,构建亚急性衰老动物模型,CC组腹腔注射等量生理盐水。MM组灌胃何首乌提取液,CC组和MC组灌胃等量生理盐水,连续60 d,然后断头处死小鼠,取脑组织于-80 ℃保存备用[15]。
2.2 转录组测序(RNA-Seq) 用mRNA富集法或rRNA去除法对totalRNA进行处理,用打断buffer把获得的RNA片段化,而后进行反转录,再合成cDNA二链形成双链DNA,把合成的双链DNA末端补平并5′端磷酸化,3′端形成突出一个“A”的粘末端,再连接一个3'端有凸出“T”的鼓泡状的接头,而后把连接产物通过特异的引物进行PCR扩增,其产物热变性成单链后,再用一段桥式引物将单链DNA环化得到单链环状DNA文库,最后上机测序。mRNA文库构建由华大基因完成。
2.3 差异表达基因的GO和KEGG通路分析 Gene Ontology 为功能富集研究的常用分析方法,分为分子功能(Molecular function,MF)、细胞组分(Cellular component,CC)和生物过程(Biological process,BP)三大功能类。而KEGG是了解高级功能和生物系统的实用程序数据库。本研究使用DAVID:Functional Annotation Result Summary进行基因注释分析及KEGG通路分析。MC/CC组和MM/MC组选取P<0.05且Count≥10的GO类别被认为有统计学意义,P<0.05且Count≥5的KEGG 通路被认为有统计学意义。在两组均有变化的差异基因选取P<0.05且Count≥3的GO类别被认为有统计学意义,P<0.05且Count≥3的KEGG 通路被认为有统计学意义。
2.4 PPI网络构成与Hub基因的确定 将测序得到的数据库中差异倍数为1倍以上并且Q-value≤0.001的基因筛选为差异表达基因,通过STRING:functional protein association networks进行蛋白互作网络(PPI)数据分析,用最低要求的互动分数Inimum required interaction score(medium confidence=0.400)提取PPI对,而后用Cytoscape软件将PPI网络可视化,用Cytoscape中的插件CytoHubba来计算蛋白质节点,我们认为连接度较高的节点在维持整个网络的稳定性方面更为重要,而前10个基因被认为是Hub基因。
2.5 脑组织RNA提取 每个组别取适量脑组织,加入1 mL Trizol后在玻璃匀浆器内匀浆,室温静置5 min后12 000 g离心5 min,取上清液加入200 μL氯仿,震荡混匀,室温静置5 min后12 000 g 4℃离心15 min,取上清液加入1 mL异丙醇,上下颠倒离心管使其充分混匀,室温静置10 min后12 000 g 4℃离心10 min,去掉上清液,向沉淀中加入1 mL 75%乙醇,轻轻上下颠倒洗涤离心管管壁,7 500 g 4℃离心5 min,洗2次后弃去上清液,保留沉淀,打开离心管盖,置室温干燥几分钟,加适量DEPC水溶解,而后用微量核酸蛋白分析仪测定OD260/OD280。结果在1.8~2.0说明RNA的纯度和完整性较好,将完整性较好的RNA取1 μg用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒逆转录为cDNA后于-80℃冰箱保存备用。
2.6 实时荧光定量PCR验证 结合RNA-Seq数据和Hub基因选取表达量较高的基因用TB GreenTM Premix Ex TaqTM Ⅱ试剂盒进行荧光定量PCR验证,以β-Actin为内参,10 μL体系进行基因扩增,反应程序为95℃,30 s;GOTO(95℃,5 s;60℃,30 s);95℃,10 s;60℃,5 s;95℃,50 s;共进行40个循环,而后通过 2-ΔΔCT法计算基因的相对表达水平。基因引物见表1。

表1 差异表达基因的Q-PCR引物序列

3 结果
3.1 差异表达基因分析 采用DEGseq法对CC组和MC组,MC组和MM组的基因表达量的原始数据进行筛选,选取Q-value≤0.001的基因,其基因分布如图1。MC组和CC组相较,有5 571个基因产生差异表达,其中331个基因的表达有明显差异[|Log2(Fold change)|≥1],在这些明显差异基因中,有110个基因上调,221个基因下调。而MM组和MC组相较,有4 375个基因产生差异性表达,其中225个基因的表达有明显差异[|Log2(Fold change)|≥1],在这些明显差异基因中,有122个基因上调,103个基因下调。各组均有变化的基因有103个,其中41个明显差异基因在MC/CC组上调,在MM/MC组下调,62个明显差异基因在MC/CC组下调,在MM/MC组上调。各组差异基因的整体分布情况见火山图(Volcano-plot)见图2、图3。其中上调的差异基因用红色表示,下调的差异基因用蓝色表示,差异不明显基因用灰色表示。提示何首乌提取液对脑组织的转录水平有较大影响,可能通过影响脑的转录组来达到其抗衰老作用。

图1 3组样本共有的差异表达基因的分布

none:|Log2(Fold change)|<1 ,P>0.05;up:Log2(Fold change)≥1,P≤0.05;down:Log2(Fold change)≤-1,P≤0.05;横坐标代表基因在不同样本中表达倍数变化;纵坐标代表基因表达量变化差异的统计学显著性。
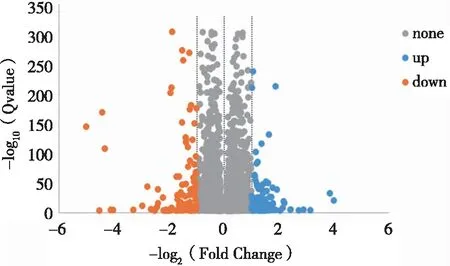
none:|Log2(Fold change)|<1 ,P>0.05;up:Log2(Fold change)≥1,P≤0.05;down:Log2(Fold change)≤-1,P≤0.05;横坐标代表基因在不同样本中表达倍数变化;纵坐标代表基因表达量变化差异的统计学显著性。
3.2 差异表达基因的功能富集分析 使用DAVID进行差异表达基因的GO功能和KEGG途径富集分析(见表2~3)。MC组和CC组的GO分析结果表明差异表达基因主要富含CCs,包括细胞外泌体、细胞外区域、细胞外空间、质膜的组成部分,中间丝和编码角质化包膜。BP分析显示差异表达基因显著富集离子转运,炎症应答,角化和角化细胞分化。MF分析显示差异表达基因显著富集结构分子活性,金属离子结合和肌动蛋白结合。而KEGG通路分析的结果显示差异表达基因显著富集在细胞因子-细胞因子受体相互作用通路,扩张型心肌病通路,心律失常性右心室心肌病(ARVC)通路,肥厚型心肌病(HCM)通路,ECM-受体相互作用通路,蛋白质消化吸收通路和雌激素信号通路中。MM组和MC组的GO分析结果表明差异表达基因主要富含CCs,包括膜、细胞外区域、细胞外空间、质膜的组成部分,中间丝和编码角质化包膜。BP分析显示差异表达基因显著富集离子转运,跨膜转运和炎症应答。MF分析显示差异表达基因显著富集肿瘤坏死因子激活受体活性和离子通道活性。而KEGG通路分析的结果显示差异表达基因显著富集神经活性配体-受体相互作用和ECM-受体相互作用通路中。

表2 CC/MC组差异表达基因的GO分析及KEGG分析
在MC/CC组和MM/MC组表达均有明显差异的103个基因的GO分析和KEGG分析结果(见表4)显示,明显差异基因主要富含CCs,包括膜和质膜的组成。BP结果表示明显差异基因主要富集在离子迁移和跨膜转运中。MF结果表明差异基因主要富集在离子通道活性和钙调蛋白结合中。而KEGG通路分析结果显示,明显差异基因显著富集在心律失常性右室心肌病通路和细胞外基质-受体相互作用通路中。

表4 MC/CC和MM/MC组表达均有明显差异的基因的GO分析和KEGG分析
3.3 PPI网络构成与Hub基因的确定 用STRING工具预测筛选出的103个具有明显差异表达基因之间的蛋白质的相互作用(见图4)。PPI网络共涉及97个节点和23个边缘。通过PPI网络中的聚类系数评估了前10个基因(见表5)。结果显示,ATPase肌浆/内质网Ca2+转运1(Atp2a1;degree=2)为最优基因,其次为ⅩⅩⅣ型胶原蛋白alpha 1链(Col24a1;degree=2),Kelch-like 41(Klhl41;degree=2),肌钙蛋白T1,慢骨骼型(Tnnt1;degree=2),钾电压门控通道亚家族H成员5(Kcnh5;degree=2),肿瘤坏死因子受体超家族成员4(Tnfrsf4;degree=2),X连锁Kx血型相关4(Xkr4;degree=2),磷脂酰肌醇特异性磷脂酶C(Plcxd3;degree=2),GPRIN家庭成员3(Gprin3;degree=2),二酰基甘油激酶(Dgkh;degree=1)。结合RNA-Seq结果,选取表达量较高的Tnfrsf4、Xkr4、Gprin3、Plcxd34个基因进行验证。其中Tnfrsf4在MC组下调,MM组上调;Xkr4、Gprin3、Plcxd33个基因在MC组上调,MM组下调。

表3 MC/MM组差异表达基因的GO分析及KEGG分析
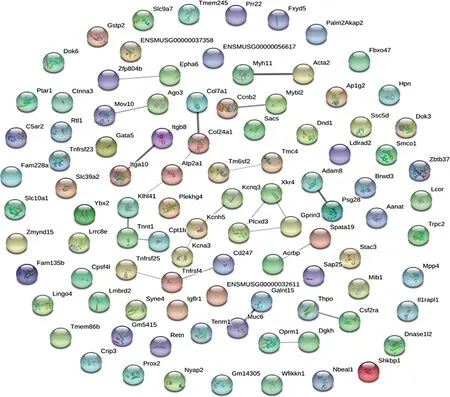
图4 差异表达基因构建的蛋白质-蛋白质相互作用网络

表5 前10个中心基因
3.4 实时荧光定量PCR验证 RT-qPCR结果显示,与空白对照组(CC)比较,衰老细胞组(MC)中的Tnfrsf4表达水平下调,Xkr4、Gprin3、Plcxd3表达水平上调。与MC组比较,何首乌提取液治疗组(MM)中的Tnfrsf4表达水平上调,Xkr4、Gprin3、Plcxd3表达水平下调(见图5),且均有统计学意义(P<0.05),与RNA-seq测序结果一致(见表6)。

A:Tnfrsf4RT-qPCR结果;B:Xkr4RT-qPCR结果;C:Gprin3RT-qPCR;D:Plcxd3RT-qPCR结果衰老组与空白对照组比较,#:P<0.05,##:P<0.01,何首乌提取液治疗组与D-Gal衰老组比较。

表6 Tnfrsf4、Xkr4、Gprin3、Plcxd3在转录组测序中的表达
4 讨论
转录组学是从整体转录水平系统研究基因转录图谱并揭示复杂生物学通路和性状调控网络分子机制的学科[16]。通过转录组测序可以对全部转录组或基因组的基因进行差异性筛选[17],本实验通过对筛选出的差异表达基因的分析,找出各组间的表达差异,初步确定何首乌延缓脑衰老的潜在作用靶点。
生物的衰老是一个极其复杂的生物化学过程,它涉及蛋白质、脂类和核酸等显著性的改变,体现在生理完整性的逐步丢失,从而导致功能衰退,引发与年龄有关的疾病,包括神经退行性疾病、动脉粥样硬化、癌症等,提高死亡的风险性[18-19]。而脑衰老是其中一个重要的表现。衰老时,病变最先发生于海马区域,而后增强神经细胞敏感性,使凋亡几率增加,进而引起神经退行性疾病[20],如阿尔茨海默病、帕金森病等。若凋亡机制发生过多,则会造成不可逆的细胞丢失,严重的可引起缺血性损伤和自身免疫病等[21-22]。
Tnfrsf4是肿瘤坏死因子(TNF)受体超家族的成员,通常被认为是一种共刺激分子[23-24]。研究表明,敲除Tnfrsf4后,抗凋亡分子、凋亡抑制剂Bcl-2、Bcl-xL和Survivin的表达显著减少,而促凋亡蛋白BCL2L11的表达显著增加[25]。在本研究中,GO及KEGG结果亦表明,Tnfrsf4主要参与炎症反应过程、免疫反应过程并调控凋亡;转录组数据及RT-qPCR结果显示,与正常组比较,衰老模型组中Tnfrsf4呈现低表达,而在经何首乌灌胃后的小鼠脑组织中呈现高表达,因此,何首乌可能通过上调Tnfrsf4,使促凋亡蛋白减少而抗凋亡蛋白增加来达到延缓衰老的作用。Xkr4(XK-Kell血型复合亚单位相关家族,成员4)在小脑中广泛表达[26-27],并且与McLeod综合征有关,包括运动、认知和精神障碍[28]。Suzuki J等人研究发现,凋亡细胞将磷脂酰丝氨酸(PtdSer)暴露在其表面,作为“吞噬我”的信号。而Xkr4可以组织特异性地支持凋亡的PtdSer暴露[29],促进细胞凋亡。在本研究中,GO及KEGG结果亦表明,Xkr4主要为膜的组成部分,同时参与细胞凋亡过程;而转录组测序和RT-qPCR结果显示,与正常组比较,衰老模型组中的Xkr4表达增加,而经何首乌灌胃后的小鼠脑组织中的表达量降低,因此,何首乌可能通过下调Xkr4来抑制细胞凋亡,进而达到延缓衰老的作用。Gprin3为GPRIN家族成员3,是纹状体中D2R功能的假定选择性控制器,在纹状体相关行为和细胞功能中起关键作用,用以解决与D2R相关的纹状体功能障碍,例如精神分裂症,帕金森病等[30]。杨婵的研究表明参芪复方可通过靶向调节Gprin3来调控细胞增殖和凋亡,抑制炎症反应[31]。本研究结果显示,与正常组比较,衰老模型组的Gprin3表达增高,经何首乌灌胃治疗后的小鼠脑组织中的Gprin3表达降低,与杨婵的实验结果一致;而GO和KEGG的结果表明Gprin3参与调控凋亡过程。因此,何首乌通过下调Gprin3达到延缓衰老的作用机制可能与参芪复方控制细胞增殖和凋亡的作用机制相似。Plcxd3是磷酸肌醇特异性磷脂酶(PI-PLC)家族成员,是Gellatly等于2012年鉴定出的一类新的PI-PLC,因其结构中仅包含一个催化X结构域,称为含磷脂酶C X结构域的蛋白质(PLCXD3),在信使RNA(mRNA)水平上,Plcxd3表达在大脑中占主导地位[32],当表达量降低时,机体胰岛素分泌受损[33-34]。Plcxd3编码的蛋白质参与磷酸肌醇信号通路,该通路与双相情感障碍有关[35]。双相情感障碍是一种严重的神经精神疾病,其特征是躁狂和抑郁症反复发作,影响思想、知觉、情感和社交行为[36]。有研究表明,双向情感障碍与衰老加速相关,但这种关联的基础机制尚不清楚[37]。本研究结果显示,与正常组相比,衰老模型组中的Plcxd3表达增高,经何首乌灌胃治疗后的小鼠脑组织中表达量降低;而GO和KEGG的结果表明Plcxd3主要参与脂质分解代谢和信号转导过程,并具有水解酶活性和磷酸二酯水解酶活性。因此,何首乌可能通过下调Plcxd3来影响脂质的分解代谢,进而达到延缓衰老的作用,同时缓解双向情感障碍症状。
综上所述,何首乌可能通过上调Tnfrsf4的表达,下调Xkr4、Gprin3、Plcxd3的表达水平来调控凋亡过程,达到抗衰老的作用。

