不同剂量美托洛尔对心力衰竭患者NT-proBNP、GDF-15及Cys-C的影响
朱洪新 王涛 王皓 霍建凤
心力衰竭是在各种致病因素下,心泵功能减弱,以至不能满足机体组织代谢需要的全身心病理过程或综合征[1]。目前,心力衰竭的治疗关键为阻断神经内分泌系统,抑制心肌重塑[2-3]。美托洛尔为临床应用较频繁的β 受体阻滞剂,可通过选择性抑制心脏β1 受体达到控制患者症状的目的[4]。但该药存在个体差异性,合理使用能抑制过度激活的交感神经系统,控制心率[5]。本研究通过对比不同剂量美托洛尔对心力衰竭患者N 末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)、血清分化生长因子-15(growth differentiation factor-15,GDF-15)及半胱氨酸蛋白酶抑制剂C(cystatin-C,Cys-c)等的影响,以期为临床治疗方案的制定提供参考。现报道如下。
1 资料与方法
1.1 临床资料
选取2018年9月至2019年9月本院收治的95例心力衰竭患者,纳入标准:①符合心力衰竭的诊疗标准[6];②患者发病时间不超过24 h;③临床资料完整且自愿签署知情同意书。排除标准:①合并支气管哮喘等病症不能使用有β 受体阻滞剂的患者;②合并自身免疫性疾病或恶性肿瘤者;③无法配合研究者;④对本研究所用药物过敏者。
所有患者根据目标剂量分为:A 组50 例,男26例,女24 例,平均年龄(61.25±6.53)岁。B 组45 例,男24 例,女21 例,平均年龄(61.29±6.58)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究已通过本院医学伦理委员会批准。
1.2 方法
2 组患者均行常规治疗,在此基础上,加用琥珀酸美托洛尔缓释片(瑞典AstraZeneca AB,B14200011191,47.5 mg/片),从11.875 mg(1/4 片)开始服用,1 次/d,每2~4 w 增加一倍剂量,达到最大耐受量或靶剂量(190 mg/d)后维持治疗。A 组琥珀酸美托洛尔缓释片剂量>95 mg/d,B 组琥珀酸美托洛尔缓释片剂量≤95 mg/d。
最大耐受剂量确定标准[7]:①清晨静息心率55~60 次/min,不宜低于55 次/min,当心率<50 次/min 时减1/2~1 个前次调整剂量;②加量后患者收缩压<12.00 kPa 时减1/2~1 个前次调整剂量;③加量后心功能恶化1 级或以上,经调整心衰基础治疗仍不能改善者时减1/2~1 个前次调整剂量;④琥珀酯美托洛尔维持用药过程中若出现心率<50 次/min则逐渐减量,若出现心衰加重则调整基础治疗。
1.3 观察指标
①NT-proBNP:使用美国罗氏公司Cobas6000 E601 全自动免疫发光分析仪检测。并将NT-proBNP 转化为符合正态分布的血浆N 末端脑钠肽前体的对数值lgNT-proBNP。②GDF-15:采用双抗体夹心酶联免疫吸附实验法检测,试剂盒购自上海蓝基生物有限公司。③Cys-C:采用免疫比浊法进行检测,试剂盒由宁波美康生物科技有限公司提供。④心功能:采用心脏超声多普勒检测患者左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD),左心室射血分数(left ventricular ejection fraction,LVEF)和左心室收缩末期内径(left ventricular systolic end diameter,LVSED)。⑤血管内皮功能:采用Bv-520T 超声多普勒血流检测仪检测所有受试者反应性充血状态下肱动脉血管内径及内径变化率、血流量。同时检测内皮素-1(endotheli-1 acetatecas,ET-1)及一氧化氮(nitric oxide,NO)水平。ET-l 采用双抗夹心酶联免疫吸附法法测定,NO 采用硝酸还原酶法进行检测。⑥不良反应。
1.4 临床疗效[8]
原心力衰竭症状及体征完全消失,心功能达到1 级或改善2 级以上为显效;症状和体征明显缓解,心功能改善1 级,但未达到2 级为有效;患者心功能改善未达到1 级,或加重为无效。
1.5 统计方法
采用SPSS 22.0 软件进行统计分析。计量资料通过(±s)描述,行t检验;计数资料通过n(%)描述,行χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
治疗1年后无脱失病例,所有患者均获得完整随访。A 组总有效率高于B 组,差异有统计学意义(P<0.05)。见表1。

表1 两组临床疗效比较[n(%)]Table 1 Comparison of clinical efficacy between 2 groups[n(%)]
2.2 两组lgNT-proBNP 比较
两组治疗前LgNT-proBNP 水平比较差异无统计学意义(P>0.05),治疗后A 组治疗后任一时间点LgNT-proBNP 水平均低于B 组,差异有统计学意义(P<0.05)。见表2。
表2 两组lgNT-proBNP 值比较(±s,ng/L)Table 2 Comparison of lgnt proBNP values between the two groups(±s,ng/L)
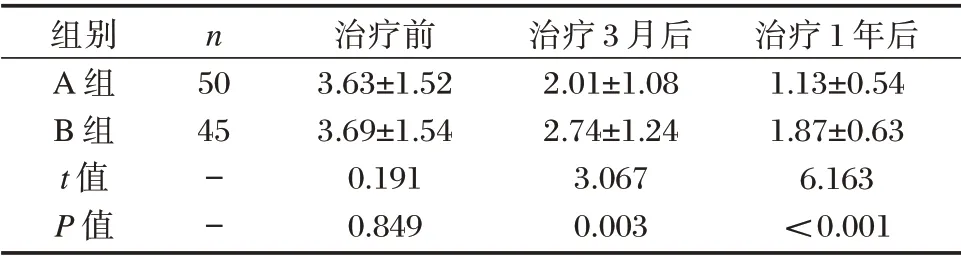
表2 两组lgNT-proBNP 值比较(±s,ng/L)Table 2 Comparison of lgnt proBNP values between the two groups(±s,ng/L)
组别A 组B 组t 值P 值n 50 45--治疗前3.63±1.52 3.69±1.54 0.191 0.849治疗3月后2.01±1.08 2.74±1.24 3.067 0.003治疗1年后1.13±0.54 1.87±0.63 6.163<0.001
2.3 两组GDF-15 比较
两组治疗前GDF-15 水平比较差异无统计学意义(P>0.05),治疗后A 组治疗后任一时间点GDF-15水平均低于B 组,差异有统计学意义(P<0.05)。见表3。
表3 两组治疗前后GDF-15 值比较(n,±s,ng/L)Table 3 Comparison of GDF-15 values between the two groups before and after treatment(n,±s,ng/L)

表3 两组治疗前后GDF-15 值比较(n,±s,ng/L)Table 3 Comparison of GDF-15 values between the two groups before and after treatment(n,±s,ng/L)
组别A 组B 组t 值P 值n 50 45--治疗前1351.26±135.41 1356.42±135.36 0.186 0.853治疗3月后952.15±114.74 1115.24±123.56 6.670<0.001治疗1年后786.39±87.65 913.52±88.36 7.032<0.001
2.4 两组Cys-C 比较
两组治疗前Cys-C 水平比较差异无统计学意义(P>0.05),治疗后A 组治疗后任一时间点Cys-C水平均低于B 组,差异有统计学意义(P<0.05)。见表4。
表4 两组Cys-C 水平比较(n,±s,ng/L)Table 4 Comparison of Cys-C levels between the two groups(n,±s,ng/L)

表4 两组Cys-C 水平比较(n,±s,ng/L)Table 4 Comparison of Cys-C levels between the two groups(n,±s,ng/L)
组别A 组B 组t 值P 值n 50 45--治疗前2.34±1.13 2.37±1.16 0.128 0.899治疗3月后1.25±0.55 1.64±0.63 3.221 0.002治疗1年后0.63±0.12 1.15±0.23 14.013<0.001
2.5 两组心功能比较
两组治疗前LVEDD、LVEF 和LVSED 比较差异无统计学意义(P>0.05)。经治疗后,A 组LVEDD、LVSED 水平低于对B 组,LVEF 高于B 组,差异均有统计学意义(P<0.05)。见表5。
2.6 两组血管内皮功能比较
两组治疗前,血管内皮功能指标水平比较差异无统计学意义(P>0.05)。经治疗后,A 组肱动脉充血后血管内径、肱动脉反应性充血后血管内径变化率、肱动脉、NO 水平高于B 组,ET-1 水平低于B 组,差异均有统计学意义(P<0.05)。见表6。
2.7 两组不良反应比较
A 组出现1 例眩晕,B 组出现1 例恶心呕吐,两组并发症发生率比较差异无统计学意义(χ2=0.001,P=0.972)。
表5 两组心功能比较(n,±s)Table 5 Comparison of cardiac function between the two groups(n,±s)
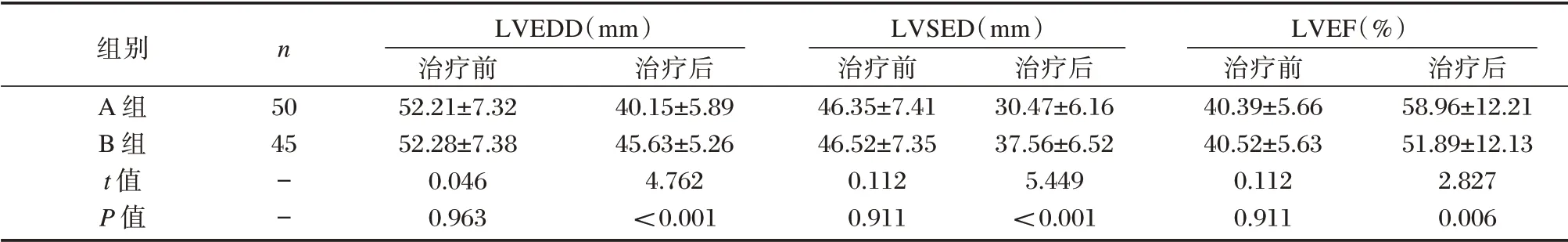
表5 两组心功能比较(n,±s)Table 5 Comparison of cardiac function between the two groups(n,±s)
组别A 组B 组t 值P 值n 50 45--LVEDD(mm)治疗前52.21±7.32 52.28±7.38 0.046 0.963治疗后40.15±5.89 45.63±5.26 4.762<0.001 LVSED(mm)治疗前46.35±7.41 46.52±7.35 0.112 0.911治疗后30.47±6.16 37.56±6.52 5.449<0.001 LVEF(%)治疗前40.39±5.66 40.52±5.63 0.112 0.911治疗后58.96±12.21 51.89±12.13 2.827 0.006
表6 两组血管内皮功能指标比较(±s)Table 6 Comparison of vascular endothelial function indexes between the two groups(±s)
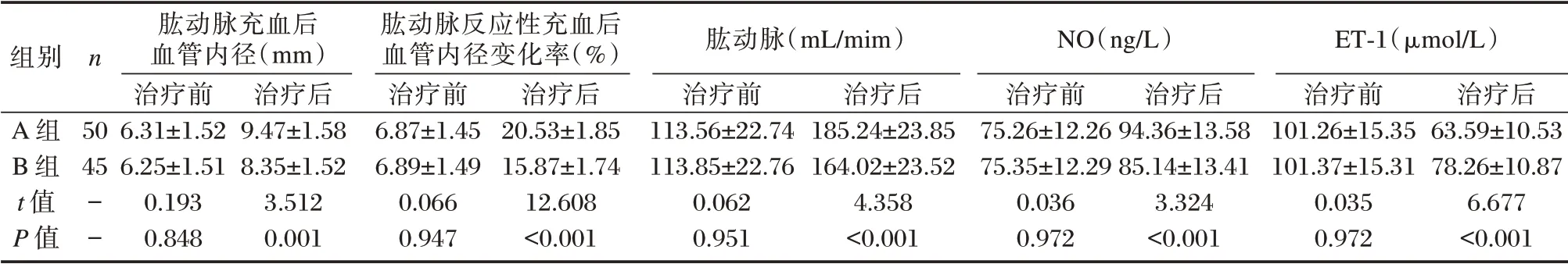
表6 两组血管内皮功能指标比较(±s)Table 6 Comparison of vascular endothelial function indexes between the two groups(±s)
组别n A 组B 组t 值P 值50 45--肱动脉充血后血管内径(mm)治疗前6.31±1.52 6.25±1.51 0.193 0.848治疗后9.47±1.58 8.35±1.52 3.512 0.001肱动脉反应性充血后血管内径变化率(%)治疗前6.87±1.45 6.89±1.49 0.066 0.947治疗后20.53±1.85 15.87±1.74 12.608<0.001肱动脉(mL/mim)治疗前113.56±22.74 113.85±22.76 0.062 0.951治疗后185.24±23.85 164.02±23.52 4.358<0.001 NO(ng/L)治疗前75.26±12.26 75.35±12.29 0.036 0.972治疗后94.36±13.58 85.14±13.41 3.324<0.001 ET-1(μmol/L)治疗前101.26±15.35 101.37±15.31 0.035 0.972治疗后63.59±10.53 78.26±10.87 6.677<0.001
3 讨论
心力衰竭是各种心脏病发展到严重阶段的一种临床症状群,临床主要表现为肺淤血和(或)腔静脉淤血症候群,其预后严重,已成为威胁我国民众生命健康的重要问题。近年来研究发现,神经内分泌细胞因子系统的长期、慢性激活促进心肌重塑,加重心肌损伤和心功能恶化是该病发生发展的基本机制[9]。目前,心力衰竭的治疗策略不断转变,临床治疗目标也不仅局限于改善症状、提高生活质量,更重要的是针对心肌重塑的机制,防止和延缓心肌重塑的发展,从而降低该病病残和病死率[10]。
β-受体阻滞剂能选择性地与β 肾上腺素受体结合,从而拮抗神经递质和儿茶酚胺对β 受体的激动作用[11]。β-受体阻滞剂可在心血管疾病中的恶性循环链中起到重要阻断作用,从而阻止和逆转心室重构,发挥改善内源性心肌功能的“生物学效应”,减少致死性心律失常和心源性猝死的危险,从而降低心力衰竭的发生率和病死率[12]。我国慢性心力衰竭诊断治疗指南也指出所有慢性收缩性心衰,NYHAⅡ~Ⅲ级且病情稳定患者除存在禁忌症或不能耐受的情况,均需长期应用β-受体阻滞剂[13]。但受到不良反应、个体差异、患者依从性等多方面的影响,目前该类药物倾向于低剂量应用。据相关研究显示,长期低剂量应用β-受体阻滞剂的临床疗效并不理想,难以使患者最大程度获益[14]。
当心室容量负荷和压力负荷增高时,心肌细胞受拉后心室反应性合成N 末端脑钠肽前体,并迅速裂解为proBNP,然后再裂解为NT-proBNP 和BNP,因此NT-proBNP 是心血管疾病尤其是心力衰竭诊断和评估的生物标志物[15]。此外,GDF-15及Csy-C 均可在一定程度上反映患者的心力衰竭程度,因此本研究选择此三指标作为疗效评价指标之一。美托洛尔具有较高的亲脂性,以β 肾上腺素能受体阻断为主,能够通过阻断β 抑制肾素的释放,实现减缓心率的作用,且可以促使收缩压同步降低,继而降低氧耗量,缓解心肌缺血症状。本研究结果表明高剂量美托洛尔有利于抑制心肌重塑。提示临床在应用美托洛尔治疗心力衰竭时,可从小剂量开始,逐渐加大使用剂量,最终结合患者的实际情况及其它病史,挑选合适剂量长期维持服用,进而达到减轻临床症状、改善生活质量和降低死亡率及再住院率的目的。
综上所述,美托洛尔逐日加量治疗心力衰竭能可明显调节血管内皮功能,改善心功能,降低NT-proBNP、GDF-15 及Cys-C 指标水平,抑制心肌重塑,安全性高。

