ICAM-1、HSP70及PAF水平变化与脊髓损伤患者病情及预后的关系
谢海洋 王冶 蒋成 张映波
脊髓损伤(Spinal cord injury,SCI)是因脊柱骨各种致病因素(外伤、炎症、肿瘤等)引起脊髓的结构与功能的损害,造成损害平面以下的脊髓神经功能(运动、感觉、括约肌及自主神经功能)的障碍,具有极高的致残率,严重威胁患者的身体健康[1]。相关研究表示,SCI 尽早干预患者预后较好,故寻找有效的分子标记物用来评价SCI 患者预后有重要意义[2]。细胞间粘附分子-1(Intercellular adhesion molecular-1,ICAM-1)可调节细胞与细胞、细胞与细胞外基质,起到粘附作用,同时,还参与体机体免疫应答,对T 细胞调节、激活增殖及细胞毒性等具有重要作用[3]。相关研究发现,血小板活化因子(platelet activating factor,PAF)是炎症的自体有效递质,在各种创伤性炎症反应中具有极强的致炎作用[4]。近年来,研究发现热休克蛋白70(Heat shock protein 70,HSP70)在SCI 患者呈高浓度状态,然而其表达与SCI 患者各项临床指标及预后的关系尚不明确[5]。本研究就ICAM-1、HSP70及PAF 水平变化与SCI 患者病情、预后的关系进行研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年6月至2018年6月于本院接受诊治的84 例SCI 患者临床资料设为研究组,其中男45 例,女39 例,平均年龄(34.21±6.37)岁。根据美国脊髓损伤协会(American Spinal Cord Injury Association,ASIA)分级标准[6]将SCI 患者分为:脊髓完全损伤者(A 组=43),脊髓不完全损伤者(B 组=24),脊髓震荡者(C 组=17)。纳入标准:①所有患者符合脊髓损伤神经学分类国际标准(ASIA 2011版)[6];②研究组患者均在受伤后48 小时入院诊治;③均为继发性SCI;④临床资料完整且真实;排除标准:①合并多发性损伤及受伤后严重感染者;②严重精神疾患或痴呆等无法配合本研究者;③存在重要脏器或内分泌、血液系统病变者。选取同期进行健康检查的正常人群作为对照组,共96 例,其中男61 例,女35 例,平均年龄(34.72±6.51)岁。各组性别、年龄等一般资料比较差异无统计学意义,具有可比性(P>0.05)。见表1。本研究通过医院伦理委员会批准,受试者已签署知情同意书。
1.2 研究方法
收集所有患者临床资料,比较ICAM-1、HSP70及PAF 水平在SCI 患者的变化情况。记录所有患者在随访时间内预后情况,根据预后情况分为预后良好组及预后不良组,采用多元Logistic 回归分析影响SCI 患者预后不良的危险因素。
1.3 观察指标
取所有患者清晨空腹静脉全血5 mL,采用未加抗凝剂的标准采样管进行采集,离心(3 000 r/min,10 min)取血清后分别存放在聚丙烯EP 管中,在-80℃冰柜中待检。采用酶联免疫吸附法检测HSP70,试剂盒选取武汉华美生物有限公司。予以美国Beckman Coulter 公司的流式细胞仪,测定ICAM-1 水平。予以反向高效液相色谱法检测PAF水平。所有操作均按照试剂盒上操作步骤进行。
表1 A、B、C 组一般资料比较[n(%),(±s)]Table 1 Comparison of general data of group A,B,C[n(%),(±s)]

表1 A、B、C 组一般资料比较[n(%),(±s)]Table 1 Comparison of general data of group A,B,C[n(%),(±s)]
组别性别(男/女)年龄(岁)受伤时间(h)A 组B 组C 组F/χ2值P 值43 24 17 20/23 15/9 10/7 1.819 0.403 34.52±5.75 34.38±5.73 34.57±5.71 0.010 0.993受伤原因交通事故14(32.55)10(41.66)8(47.05)1.626 0.951坠落伤13(30.23)7(29.16)5(29.41)暴力伤12(27.90)5(20.83)3(17.64)其他4(9.30)2(8.33)1(5.88)损伤部位颈椎17(39.53)10(41.66)8(47.05)3.224 0.780胸椎10(23.25)7(29.16)6(35.29)胸椎合并颈椎6(13.95)4(16.66)1(5.88)腰椎10(23.25)3(12.50)2(11.76)9.48±1.02 9.46±1.05 9.50±1.03 0.010 0.992
1.4 随访方法
本研究随访从患者治疗开始,为期2年,截止于2020年6月。患者的随访时间分布在2~24 个月,平均随访时间为(15.71±5.93)个月。对患者随访的方式主要采用电话随访、微信随访及患者来院复查为主。采用日本骨科学会(Japanese OrthopedicAssociation,JOA)[7]颈脊髓功能评定标准评定疗效,根据Hirabayashi[8]公式计算治疗后末次随访时JOA 评分改善率,患者经治疗后改善率在25%以下者为预后差,其余情况均视为预后好。
1.5 统计学方法
采用SPSS 22.0 软件进行统计分析,计数资料以n(%)表示,χ2检验;计量资料采用(±s)表示,组间比较行t检验,多组间比较行F检验;采用多元Logistic 回归分析影响SCI 患者预后不良的危险因素,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组ICAM-1、HSP70 及PAF 水平
研究组患者ICAM-1、HSP70 及PAF 水平明显高于对照组,差异有统计学意义(P<0.05)。见表2。
2.2 对比A、B、C三组患者ICAM-1、HSP70及PAF水平
ICAM-1、HSP70 及PAF 水平显示:A 组>B 组>C 组,差异有统计学意义(P<0.05)。见表3。
表2 两组ICAM-1、HSP70 及PAF 水平比较(±s)Table 2 Comparison of ICAM-1,HSP70 and PAF levels between 2 groups(±s)
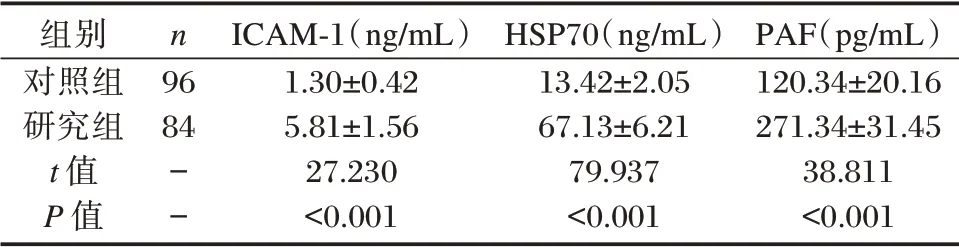
表2 两组ICAM-1、HSP70 及PAF 水平比较(±s)Table 2 Comparison of ICAM-1,HSP70 and PAF levels between 2 groups(±s)
组别对照组研究组t 值P 值n 96 84--ICAM-1(ng/mL)1.30±0.42 5.81±1.56 27.230<0.001 HSP70(ng/mL)13.42±2.05 67.13±6.21 79.937<0.001 PAF(pg/mL)120.34±20.16 271.34±31.45 38.811<0.001
表3 A、B、C组患者ICAM-1、HSP70及PAF水平比较(±s)Table 3 Comparison of ICAM-1,HSP70 and PAF levels among groups A,B and C(±s)

表3 A、B、C组患者ICAM-1、HSP70及PAF水平比较(±s)Table 3 Comparison of ICAM-1,HSP70 and PAF levels among groups A,B and C(±s)
组别A 组B 组C 组F 值P 值n 43 24 17--ICAM-1(ng/mL)6.21±1.16 4.12±1.12 2.34±0.84 83.55<0.001 HSP70(ng/mL)69.42±3.92 44.33±5.13 21.33±3.11 876.86<0.001 PAF(pg/mL)294.12±8.67 234.11±15.67 172.31±13.42 665.11<0.001
2.3 SCI 患者预后情况
84 例患者经两年随访后显示,57 例患者预后良好,预后良好率为67.85%,27 例患者预后不良,预后不良率为32.14%,根据预后情况分为预后良好组及预后不良组。
2.4 影响SCI 患者预后不良的因素分析
2 组年龄、性别、SCI 节段等占比比较差异无统计学意义(P>0.05),2 组受伤至手术时间、外伤类型、ASIA 分级、激素药物使用、ICAM-1、HSP70 及PAF 水平等比较差异有统计学意义(P<0.05)。见表4。
表4 影响SCI 患者预后不良的因素分析[n(%),(±s)]Table 4 Analysis of factors affecting poor prognosis of patients with SCI[n(%),(±s)]
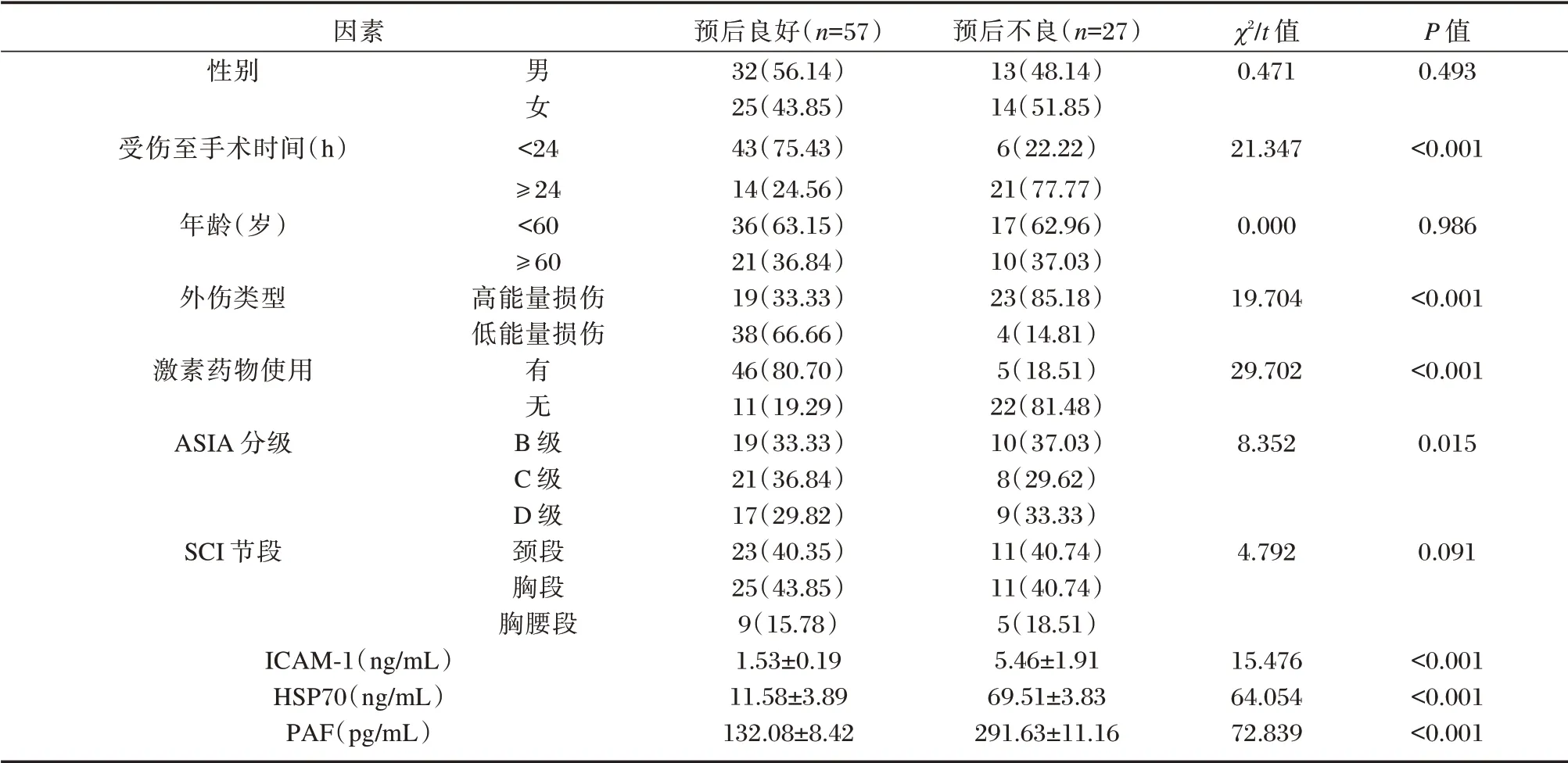
表4 影响SCI 患者预后不良的因素分析[n(%),(±s)]Table 4 Analysis of factors affecting poor prognosis of patients with SCI[n(%),(±s)]
因素性别男女χ2/t 值0.471 P 值0.493受伤至手术时间(h)21.347<0.001年龄(岁)0.000 0.986外伤类型<24≥24<60≥60高能量损伤低能量损伤19.704<0.001激素药物使用有无29.702<0.001 ASIA 分级8.352 0.015 SCI 节段B 级C 级D 级颈段胸段胸腰段4.792 0.091 ICAM-1(ng/mL)HSP70(ng/mL)PAF(pg/mL)预后良好(n=57)32(56.14)25(43.85)43(75.43)14(24.56)36(63.15)21(36.84)19(33.33)38(66.66)46(80.70)11(19.29)19(33.33)21(36.84)17(29.82)23(40.35)25(43.85)9(15.78)1.53±0.19 11.58±3.89 132.08±8.42预后不良(n=27)13(48.14)14(51.85)6(22.22)21(77.77)17(62.96)10(37.03)23(85.18)4(14.81)5(18.51)22(81.48)10(37.03)8(29.62)9(33.33)11(40.74)11(40.74)5(18.51)5.46±1.91 69.51±3.83 291.63±11.16 15.476 64.054 72.839<0.001<0.001<0.001
2.5 影响SCI 患者预后不良的多因素分析
多因素分析结果显示,患者受伤至手术时间、外伤类型、ICAM-1、HSP70 及PAF 水平为SCI 患者预后不良的独立危险因素(P<0.05)。见表5。
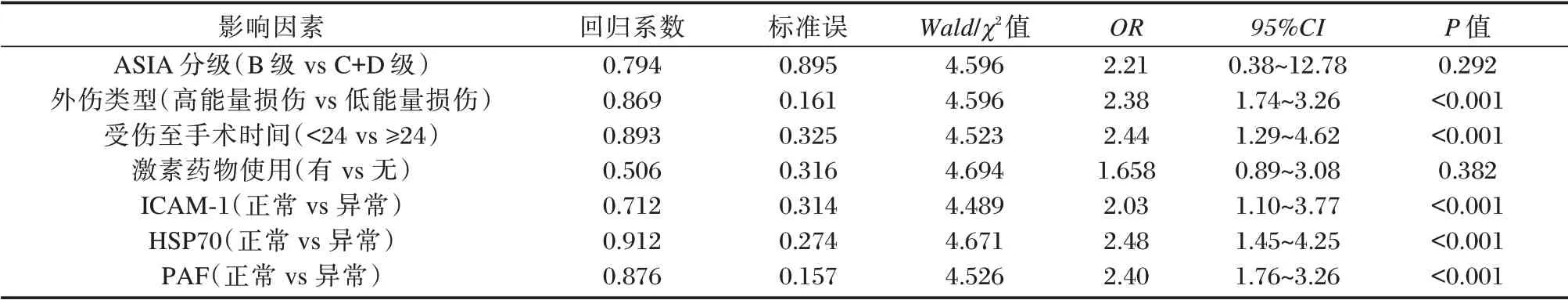
表 5 影响SCI 患者预后不良的多因素分析Table 5 multivariate analysis of poor prognosis in patients with SCI
3 讨论
SCI 是一种极其严重的创伤,可触发受损脊髓炎性因子的释放,加重脊髓受损,治疗不及时可威胁患者生命安危[9]。故寻求与SCI 病情进展有关的分子标志物,对于SCI 诊治和预后尤为重要。
ICAM-1 是中免疫球蛋白超家族一员,可介导炎症细胞黏附参与机体免疫应答,还可作为抗原协同刺激分子激活限制性及细胞毒性T 细胞。研究表发现,ICAM-1 在内皮、角化、成纤维及上皮细胞等作用下,其表达水平可迅速升高[10]。Clark等[11]研究发现,急性SCI 时ICAM-1 可激活神经内分泌系统引起巨噬及淋巴细胞释放细胞因子,使其表达水平较正常人群明显上升。同时,Nakade等[12]研究表示,ICAM-1 水平与急性SCI 免疫活性程度密切相关,可作为判断SCI 预后的标志物。本研究将SCI 患者根据ASIA 分级进行分组检测,发现与上述研究一致,提示ICAM-1 与SCI 患者的疾病进展具有密切关系。另对患者进行随访预后调查显示,ICAM-1 异常为影响SCI 患者预后不良的独立危险因素,说明ICAM-1 与SCI 患者病情进展及预后关系密切,提示其可作为SCI 患者一个潜在的预后分子生物学标志物。
相关临床研究发现,HSP70 参与SCI 病理过程,当脊髓受到损伤时,脊髓组织中星形胶质细胞、小胶质细胞及神经元等均会产生HSP70,HSP70 通过一氧化氮介导产生细胞毒性,减少氧自由基。White A R[13]研究表示,HSP70 可促进超氧化物歧化酶修复,加快氧自由基的清除,利于机体抗氧化功能恢复,减轻脊髓继发损害。类似的,Yanrui 等[14]通过研究发现SCI 患者HSP70 水平与脊髓损伤患者的严重程度存在正相关,脊髓损伤越严重血清中HSP70 含量越高,推测HSP70 在SCI 进展中发挥重要作用。本研究结果提示HSP70 在SCI 的发生发展中发挥着免疫评估的作用。
PAF 是目前为止发现的体内最强血小板聚集剂,一方面,可使血小板发生聚集和释放反应,激活中性粒细胞聚集、释放氧自由基等物质,增加血管壁通透性,促使肿瘤坏死因子产生;另一方面,在脊髓损伤的炎症过程和继发损伤中发挥毒性作用。Zhang 等[15]等研究发现,当脊髓损伤后可刺激PAF 释放,改变PAF 数量及受体活性,并与受体特异性结合,加重脊髓损伤。本研究结果说明PAF与SCI 的发展关系密切,可将其作为预测SCI 患者病情活动及预后的有效指标。
综上,ICAM-1、HSP70 及PAF 在SCI 患者中明显升高,且与患者预后关系密切,可作为预测SCI患者预后的分子标志物和治疗的潜在的靶点。由于本研究纳入样本量较少,实验结果难免存在偏倚,后续将扩大样本量进一步研究,以获得更为准确的实验结果。

