造血干细胞发育过程中的信号通路调控
张春霞,刘峰
优博专栏
造血干细胞发育过程中的信号通路调控
张春霞1,2,刘峰1
1. 中国科学院动物研究所,膜生物学国家重点实验室,北京 100101 2. 波士顿儿童医院,波士顿 02115
血液系统是维持机体生命活动最重要的系统之一,为机体提供所需的氧气和营养物质,通过物质交换维持内环境的稳态,同时为机体提供免疫防御与保护。血细胞是血液的重要组成成分,机体中成熟血细胞类型起源于具有自我更新及分化潜能的多能成体干细胞—造血干细胞(hematopoietic stem cells, HSCs)。造血干细胞及各类血细胞产生、发育及成熟的过程称为造血过程,该过程开始于胚胎发育早期并贯穿整个生命过程,任一阶段出现异常都可能导致血液疾病的发生。因此,深入探究造血发育过程及其调控机制对于认识并治疗血液疾病至关重要。近年来,以小鼠()和斑马鱼()作为动物模型来研究造血发育取得了一系列的进展。其中,BMP、Notch和Wnt等信号通路对造血干细胞的命运决定和产生发挥了重要作用。本文对这些信号通路在小鼠和斑马鱼造血过程中的调控作用进行系统总结,以期能够完善造血发育过程的调控网络并为临床应用提供指导。
造血干细胞;信号通路;BMP;Notch;Wnt
造血干细胞(hematopoietic stem cells, HSCs)是一群具有自我更新及分化潜能的多能干细胞,可以产生所有类型的血细胞[1]。血细胞可以分为髓系和淋系两大类,其中髓系细胞包括红系细胞、粒系细胞、巨核系细胞和单核系细胞,淋系细胞主要包括T淋巴细胞、B淋巴细胞和自然杀伤性细胞(NK细胞)。造血干细胞及各类血细胞产生、发育和成熟的过程称为造血过程。脊椎动物的造血过程起始于胚胎期,可以分为初级造血和次级造血两个阶段。造血干细胞以内皮-造血转化的形式产生于次级造血阶段。造血干细胞发育在脊椎动物中是高度保守的过程,该过程受到多种信号通路和调控因子的精密调控。一些信号通路,如ERK、Notch以及β-Catenin介导的Wnt信号通路,在造血干细胞产生过程中的作用是动态变化的,也是浓度和时间依赖的。深入了解这些信号通路在造血干细胞发育过程中的调控网络和作用机制,不仅能够帮助理解体内造血干细胞的产生过程,也能为体外造血提供理论依据。小鼠()和斑马鱼()是目前最常用的研究造血发育的动物模型。从胚胎发育早期到成体,尽管发生部位有所不同,造血发育的阶段性过程在两种动物模型中是相似的。本文以BMP、Notch和Wnt信号通路为例,详细介绍信号通路在造血发育过程中的调控作用。
1 脊椎动物造血发育过程
1.1 小鼠造血发育
哺乳动物的造血发生起源于胚胎的腹侧中胚层,其中部分细胞特化为成血成血管细胞(hemangioblast),这类细胞同时具有向血细胞和血管细胞分化的能力[2]。在小鼠中,成血成血管细胞最早出现在卵黄囊的血岛区(blood island in the yolk sac),胚胎期7.5天(E7.5)左右此处可检测到血细胞的产生,这一过程称为初级造血(primitive hematopoiesis),主要产生初级红系(primitive erythroid)和初级髓系(primitive myeloid)血细胞,为胚胎早期发育供氧气和免疫防御[3]。E9.5卵黄囊区能够产生一群具有分化成红细胞、巨核细胞和巨噬细胞等多项潜能的红系–髓系前体细胞(erythro-myeloid progenitors, EMPs)[4,5]。近期研究发现特定组织定居的巨噬细胞,如肝脏的Kupffer细胞、脑部的小胶质细胞、上皮的郎格罕氏细胞及肺部的肺泡巨噬细胞等,都来源于卵黄囊的红系–髓系前体细胞,并不依赖于造血干细胞[6,7]。除红系和髓系细胞之外,在造血干细胞产生之前,卵黄囊还能产生一群具有淋系(lymphoid)分化潜能的前体细胞,可以分化为B淋巴细胞和T淋巴细胞,为机体供免疫防御[8]。
初级造血是一个短暂的阶段,其产生的血细胞类型和数目不足以维持胚胎发育和成体需要,因此很快就被次级造血(definitive hematopoiesis)代替[4]。造血干细胞产生于次级造血阶段,主要在E10.5小鼠胚胎的动脉–性腺–中肾区(aorta-gonad-mesonephros, AGM)产生[9],在小鼠的胎盘[10]等区域也能检测到造血干细胞。随着研究的深入,造血干细胞的产生过程已经逐渐明晰。在主动脉腹侧壁的一群内皮细胞可以特化成具有造血潜能的生血内皮(hemogenic endothelium, HE),随后细胞形态发生变化,形成造血簇(hematopoietic clusters),逐渐脱离动脉内皮形成造血干细胞进入主动脉,这一过程称为内皮–造血转化(endothelial-to-hematopoietic transition, EHT)[11]。新产生的造血干细胞在E12左右进入胎肝(fetal liver, FL)并进行大量扩增并逐渐成熟,其中一部分造血干细胞随后进入胸腺,分化为T淋巴细胞。最终,造血干细胞定位到终生造血器官骨髓(bone marrow, BM)。正常状态下骨髓中的造血干细胞处于静息状态,一旦机体需要,造血干细胞将会迅速动员起来并分化成各种血细胞以补充机体需要[1]。
1.2 斑马鱼造血发育
在过去的20年里,斑马鱼凭借其独特的优势,已经成为研究发育的经典动物模型。首先,斑马鱼是体外受精,从受精卵到发育至成体的整个过程都可以在体外直接观察,而且便于进行操控;其次,斑马鱼胚胎是透明的,利用各种转基因或活体标记技术,能够对各组织器官的发育进行实时观察和追踪;再次,斑马鱼产卵的周期比较短,并且较易获得大量胚胎,这样有利于进行高通量筛选实验;最重要的是斑马鱼的基因组与哺乳动物高度保守,斑马鱼中的很多成果可以为哺乳动物的相关研究提供参考[12]。
斑马鱼的造血发育过程与哺乳动物相似,均起源于胚胎的腹侧中胚层。在发育过程中,后部的侧板中胚层(posterior lateral mesoderm, PLM)逐渐向中间迁移形成中间细胞团(intermediate cell mass, ICM),并在此处产生初级红系细胞。同时前部侧板中胚层(anterior lateral mesoderm, ALM)能够产生初级髓系细胞[12,13]。斑马鱼的红系–髓系前体细胞出现在受精后36小时(36 hours post fertilization, 36 hpf)左右的尾部造血组织(caudal hematopoietic tissue, CHT),并且能够在此处进行分化[14]。斑马鱼的造血干细胞也是在AGM区域经过内皮–造血转化过程产生。利用转基因荧光标记的方法对斑马鱼造血干细胞的产生过程进行实时追踪观察发现,主动脉腹侧壁的部分内皮细胞可以特化成为生血内皮,其形态也由扁平逐渐变成圆形,最后以出芽的形式脱离主动脉[14,15]。与小鼠不同的是,斑马鱼的造血干细胞不形成血细胞簇,而是以单个细胞的形式产生,并在产生后直接进入动静脉之间的间充质,随后进入静脉。斑马鱼的内皮–造血转化过程起始于32 hpf,在60 hpf之前结束。新产生的造血干细胞随后会迁移到CHT区域进行扩增和分化,部分细胞会迁移到胸腺分化成T淋巴细胞。造血干细胞最终会进入斑马鱼的终生造血器官—肾脏(Kidney Marrow),为胚胎和成体提供各类血细胞。
2 造血干细胞产生过程的关键转录因子
在造血发育过程中,转录因子Scl (stem cell leukemia,也称作T-cell acute lymphocytic leukemia 1, TAL1)是成血成血管细胞的标记基因之一,对主动脉和造血干细胞的发育都有重要的调控作用[16,17]。斑马鱼的基因有两个转录本—和,虽然这两个转录本都能够参与调控造血干细胞的产生,但是它们分别调控内皮-造血转化过程的不同阶段。通过构建荧光标记的和转基因斑马鱼并进行实时观察发现,在生血内皮细胞中特异表达,对生血内皮的命运决定至关重要,而则在新产生的造血干细胞中特异表达,对造血干细胞在AGM区的维持发挥作用[18]。
作为常用的造血干细胞标记基因之一,转录因子Runx1(RUNX family transcription factor 1,也称作acute mylogenous leukemia 1, AML1)可以标记所有的胚胎造血干细胞[19]。在小鼠胚胎中进行的功能实验发现,缺失后次级造血过程被阻断[20]。进一步的条件性敲除实验发现,内皮细胞中的Runx1对于造血干细胞的产生必不可少,而造血干细胞产生之后,Runx1对造血维持并不重要[21]。近年来,对于Runx1在造血干细胞产生过程中的作用有了进一步认识。通过观察斑马鱼内皮–造血转化过程发现,缺失后,部分内皮细胞可以发生形变并开始出芽,但在形成造血干细胞过程中这群细胞会发生破裂,导致造血干细胞无法产生[15]。随后的研究发现,Runx1可以保证造血特性的获得,而其下游靶基因Gfi1/Gfi1b (growth factor independent 1A transcription repressor 1)能够在生血内皮细胞中抑制内皮基因的表达,并促进细胞发生形变,进而保证造血干细胞的正常产生[22]。
除此之外,Gata2 (GATA binding protein 2)也是造血干细胞产生的关键调控因子。在小鼠的造血发育过程中,Gata2在主动脉及造血干细胞簇中特异表达[23]。在内皮细胞中特异性敲除Gata2发现,生血内皮可以正常产生,但是内皮-造血转化过程不能发生[24],与Runx1不同的是,在造血干细胞产生之后,血细胞中的Gata2对于造血干细胞的生存和维持也非常重要[24,25]。斑马鱼的有两个同源基因—,和。其中,在受精后11小时就开始表达于成血成血管细胞中[26],而特异性表达在生血内皮中[27]。在功能上,Gata2a和Gata2b都能通过调控的表达来促进生血内皮的特化,同时又受到Gata2a的调控[27,28]。
3 调控造血干细胞发育的信号通路
3.1 BMP信号通路
骨形态发生蛋白(bone morphogenesis proteins, BMPs)是转化生长因子(transforming growth factor β, TGF-β)超家族的一员[29]。作为一种形态发生素,BMP信号在胚胎发生、发育以及成体组织稳态的维持中都发挥着重要作用[30]。经典的BMP信号通路是Smads依赖性的。BMP配体先与I型受体(BMPRIs) 结合,形成复合体后再与II型受体(BMPRII)结合。II型受体是持续激活型的,能够磷酸化I型受体。激活的I型受体随后磷酸化下游的Smad蛋白。作为细胞内的信号分子,脊椎动物中的8种Smad蛋白可以分为3类:受体调节型Smads (receptor-regulated Smads, R-Smads)、共配体型Smads (common-mediator Smads, Co-Smads)以及抑制型Smads (inhibitory Smads, I-Smads)。Co-Smads (Smad4)和I-Smads (Smad6和Smad7)在TGF-β超家族中是通用的,而R-Smads中能够参与BMP信号传导的主要包括Smad1、Smad5和Smad8[31]。
经受体激活后的R-Smads从细胞膜上脱离,在胞内与Smad4结合并进入细胞核。在细胞核内,Smads可以结合DNA,同时可以招募共同作用因子调控基因表达,如Smad1/5–Smad4与OAZ (Olf-1/ EBF-associated zinc finger)形成复合体后能够招募共激活因子p300/CBP等促进基因表达[32];Smad1- Smad4与Nkx3.2形成复合体后能够招募共抑制因子mSin3/HDAC1等抑制基因表达[33]。作为抑制型Smads,Smad6能够抑制Smad4与磷酸化Smad1的结合从而阻断BMP信号的传递[34];Smad7能够竞争性地结合TGF-β或BMP受体,并能够与Smurf1/2共同作用通过泛素化途径降解受体进而阻断信号的传递[35,36]。
3.1.1 经典的BMP-Smad1/5在HSC发育过程的调控作用
脊椎动物的造血发育起源于腹侧中胚层, BMP蛋白(尤其是BMP4)能够诱导腹侧中胚层的形成[37,38]。为了进一步研究BMP信号通路在造血发育中的作用,研究人员用转基因的方法在时间和空间上来控制BMP信号的活性。首先,为避免BMP信号缺失对早期中胚层发育的影响,研究人员利用造血、血管及前肾前体细胞特异性的启动子在斑马鱼胚胎侧板中胚层中过表达功能缺失的BMP受体,发现BMP信号在这些前体细胞中的缺失能够促进血管和造血的发育但抑制前肾发育,说明BMP信号在细胞命运决定中起到重要的调控作用[39]。随后,为避免对动脉发育的影响,研究人员利用热激蛋白(heat shock protein 70, hsp70)启动子特异性地在斑马鱼动脉发育完成之后过表达功能缺失的BMP受体来抑制BMP信号通路,结果发现造血干细胞的产生和维持不能正常进行[40],说明BMP信号在造血发育中具有不可缺少的作用。虽然BMP4在24hpf的斑马鱼胚胎中表达于腹侧间充质(ventral mesenchyme)中,但是BMP受体Bmpr2a在主动脉内皮中可以检测到[41],暗示着BMP受体可以将BMP信号传递到主动脉中,进而调控造血干细胞的产生。在小鼠胚胎中,BMP4在腹侧间充质中表达,BMP受体Alk3、Alk6和BmprII,以及BMP下游效应因子Smad1、4、5在AGM区动脉和血细胞中表达用小分子药物抑制BMP信号后,小鼠造血活性明显降低[42]。以上这些研究说明BMP信号对造血干细胞的产生和维持都发挥重要作用。
要让加油站站点、库存发挥作用,就要有足够的运力保障。“和过去几年相比,现在农民用油都比较理性了。以前油价低时,农民喜欢集中一起买很多油储备起来,现在油价变化频繁,农民用油比较均衡,随用随买。”刘延奎向记者介绍道。
对于BMP信号通路调控造血发育过程的分子机制,近年来也有深入研究。作为BMP信号通路下游的关键信号分子,Smad1和Smad5对于斑马鱼的初级造血过程发挥着不同的作用。Smad1缺失能够增加初级红细胞的数目,而成熟巨噬细胞的产生受到抑制;Smad5缺失导致初级红细胞的缺陷,巨噬细胞不受影响;但是Smad1或Smad5的缺失都会导致次级造血前体细胞的减少[43,44]。在小鼠成血成血管前体细胞中,缺失Smad1可以促进后续造血基因的表达,同时能够使胞核内的磷酸化Smad2 (pSmad2)信号增强,这也暗示着BMP和TGF-β信号通路在造血发育调控中存在互作[45]。另外,作为TGF-β超家族共用的Co-Smad,Smad4在小鼠内皮细胞而不是血细胞中的缺失能够增加造血动脉内造血簇的产生,也能够促进体外造血前体细胞的产生[46],意味着内皮细胞的Smad4在小鼠造血发育过程中发挥着抑制作用。但是Smad5敲除的小鼠,造血干细胞的产生明显减少,内皮细胞的特性有所增强[44]。体外实验发现Smad1直接结合到启动子区域,促进其表达;同时,Smad6可以在Smurf1的协助下抑制Runx1的活性[47],暗示着BMP信号通路可能通过Smad1直接调控造血基因的表达;但在体内造血过程中是否存在直接调控还有待进一步验证。
3.1.2 造血干细胞发育过程中BMP信号通路与FGF信号通路的相互作用
在脊椎动物早期胚胎发育,包括神经特化、初级造血和胚胎干细胞命运维持等过程中,BMP信号通路和ERK介导的FGF信号通路都发挥作用[48~50],共同对细胞命运的选择进行调控。通过启动子驱动的遗传学控制以及特异性的化学抑制剂处理,研究人员发现在造血干细胞的产生过程中BMP信号通路持续发挥作用,而ERK信号通路的作用是动态变化的。在血管发生过程中,ERK信号通路是动脉分化所必须的,一旦动静脉分化完成,ERK信号就需要下调至阈值范围内以保证造血干细胞的产生。BMP信号通路在Smad1/5介导下调控ERK信号。Smad1/5招募共抑制因子HDAC1到启动子区,使其乙酰化水平下降,从而在转录水平上抑制的表达。进一步研究发现,在斑马鱼造血发育过程中,过度激活的ERK信号能够增强动脉内皮细胞的特性以及内皮细胞间的紧密连接,最终导致生血内皮的产生及内皮–造血转化过程受到抑制,进而影响造血干细胞的产生[44]。在小鼠造血发育过程中,研究人员在内皮细胞内特异性敲除Smad4,发现动脉内皮中的BMP4表达增加,而增加的BMP4能够通过非Smad依赖的方式激活ERK通路,从而增加造血细胞簇的产生[46]。这两项研究说明BMP信号通路可以在蛋白水平和转录水平上通过调控ERK信号的活性来影响造血干细胞的产生,而ERK信号对造血干细胞的调控是动态变化的(图1)。
3.2 Notch信号通路
Notch蛋白是一个在进化上非常保守的跨膜受体蛋白,能够介导细胞-细胞间的信号传导,对于细胞命运决定非常重要[51]。在哺乳动物和斑马鱼中,Notch信号是由多个蛋白之间的相互关联进行信号传递的,包括信号接收细胞表面的Notch信号的跨膜受体(小鼠Notch1、Notch2、Notch3和Notch4,斑马鱼Notch1a、Notch1b、Notch2和Notch3)与信号释放细胞所释放的Notch配体(Jagged和Delta)结合[52,53]。随后,在ADAM TACE金属蛋白酶(ADAM metalloprotease)的作用下,Notch受体S2位点被切割,在γ-分泌酶(γ-Secretase)的作用下S3位点被切割,释放出Notch细胞内结构域(Notch intracellular domain, NICD)。而在无Notch信号激活的情况下,细胞核内的RBPj能够招募转录共抑制复合物(nuclear corepressor, NCoR)以及组蛋白去乙酰化酶(histone deacetylase, HDACs)抑制Notch信号靶基因的转录。Notch信号激活后,NICD可以入核,替换RBPj并且招募转录共激活复合物从而激活Notch信号靶基因的转录[54]。
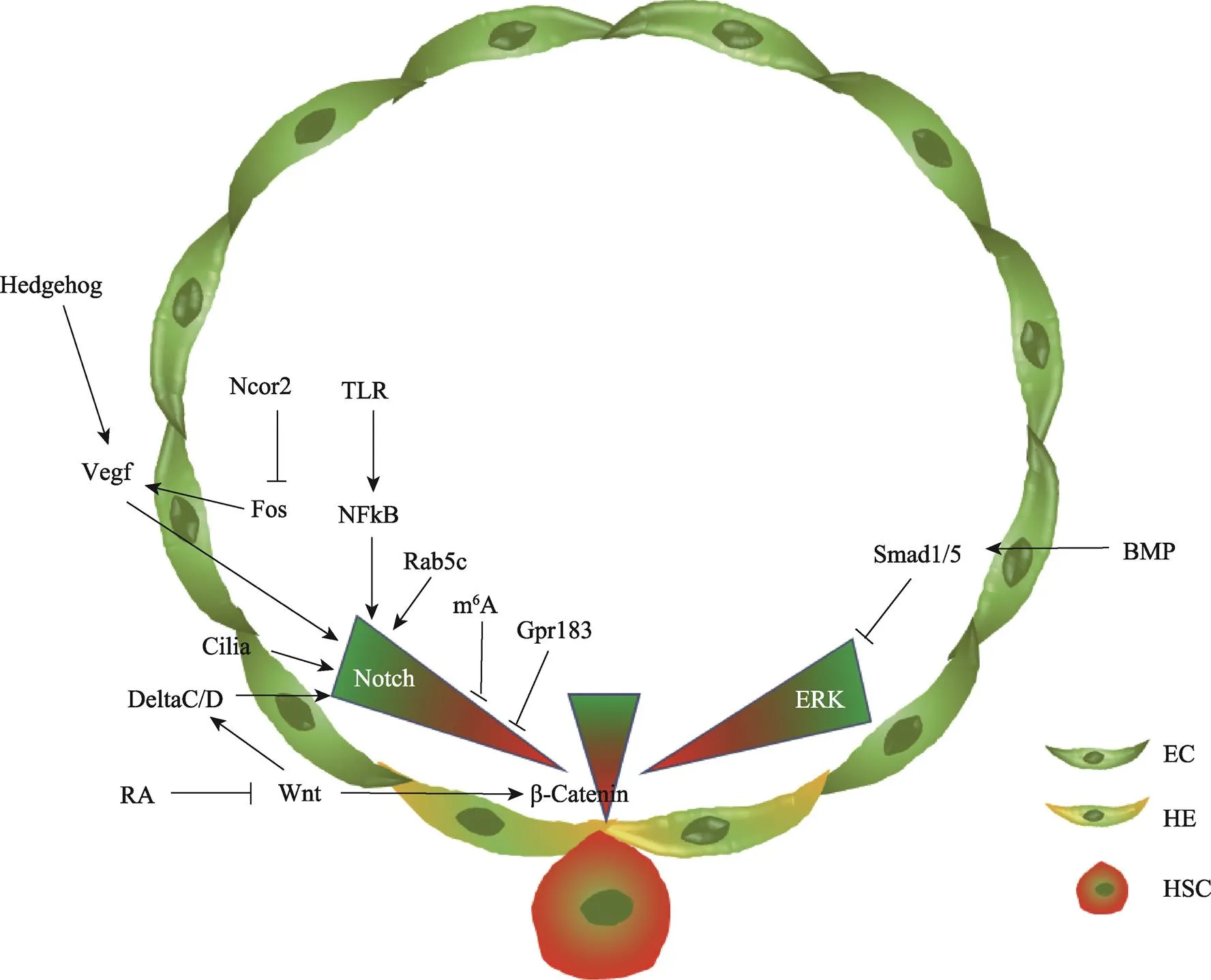
图1 斑马鱼造血干细胞发育过程中的信号通路调控示意图
3.2.1 Notch信号通路在HSC发育过程的调控作用
Notch信号是造血干细胞发育过程中非常重要,也是研究较多的信号通路。Notch信号缺失的突变体中动脉血管不能正常分化[55],作为造血干细胞的来源,动脉血管的缺陷会导致造血干细胞异常产生,这一功能是由Notch1介导的[56]。动脉特异性标记基因作为靶基因,可以直接受Notch1调控[57]。进一步研究发现,Notch信号通路对造血干细胞命运决定及其产生过程也发挥着细胞自主性调控作用。利用hsp70:gal4;uas:NICD转基因斑马鱼品系,在不同时期进行热激处理来控制动脉标记基因的表达,发现Notch通过Runx1调控造血干细胞的产生与动脉发育是两个独立的过程[58]。小鼠中的实验也证明,Jagged1介导的Notch1信号的激活可以通过调节Gata2和Cdca7调控基因的表达,进而调控造血干细胞的产生,这也不依赖于动脉发育[27,59~61]。整体来讲,不同的Notch配体可以介导不同强度的Notch信号,Jagged1能够介导生血内皮细胞中低强度的Notch信号来维持造血干细胞的产生,而Dll4维持内皮细胞中高强度的Notch信号来保证动脉的分化[62]。
近年来,随着研究的深入,越来越多的结果证明Notch信号通路在造血发育过程中的作用是动态变化的,而且也是剂量依赖性的。在斑马鱼中,利用Notch信号的报告基因转基因和造血干细胞标记基因以及转基因鱼系,追踪斑马鱼造血过程,发现tp1cmyb或tp1runx1细胞不会发生内皮-造血转化,是因为这些细胞首先要失去Notch活性转变成tp1细胞后才能产生造血特性,最终转变成造血干细胞。另外,应用转基因鱼系Tg (hsp70:dn- MAML)和Tg (hsp70:GAL4/UAS:NICD)胚胎,通过在不同时期热激处理控制Notch信号强度,研究者发现在动静脉分化之前,激活Notch信号能够促进造血干细胞的产生。在动静脉发育完成后,动脉内皮细胞中的Notch信号的持续激活则会抑制造血干细胞的产生,而降低Notch信号强度,能够促进造血干细胞的产生[63]。在鸡胚造血干细胞产生过程中,随着表达的增加,Notch信号会逐渐降低,而抑制Notch信号后会在一定程度上促进造血干细胞的产生[64]。
3.2.2 Notch信号通路上游调控因子
随着对造血干细胞产生中Notch信号动态调控机制的认识越来越清楚,越来越多的研究阐释了Notch信号通路的上游调控机制(图1)。首先,为保证动脉内皮的分化及造血干细胞的产生,Notch信号需要正确的激活。在动静脉分化阶段,脊索分泌的Hedgehog信号能够促进体节中血管内皮生长因子(Vascular endothelial growth factor, Vegf)的表达,Vegf可以与具有动脉特性的成血管细胞表面的Vegf受体结合,进而激活动脉内皮中的Notch信号,促进动脉的分化[65]。炎性信号也可以激活Notch信号并且特异性地调控造血干细胞的产生,而对动脉发育没有影响。初级中性粒细胞分泌的肿瘤坏死因子a (tumor necrosis factor a, TNFa)和粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)可以与内皮细胞表面的受体TNFR2,Toll样受体(Toll-like receptor 4, TLR4)结合,通过经典的炎性信号通路使得内皮细胞内的NFkB进入细胞核,进而调控Notch受体Jagged1的表达[66,67]。除此之外,内皮细胞内的初级纤毛发生也能够促进Notch信号在动脉内皮的激活,从而促进生血内皮细胞的特化,保障造血干细胞的正常产生[68]。
另一方面,动脉内皮分化完成后,生血内皮细胞内Notch信号的下降也受到严密的调控。在转录水平上,NcoR2作为一个转录共抑制因子,特异表达在斑马鱼AGM区,通过调控启动子的乙酰化水平抑制其转录,进而抑制Vegfd及其下游的Notch信号,以保证内皮-造血转化过程中内皮特性的降低及造血特性的获得[69]。在转录后调控水平上,内皮细胞表达的N6-methyladenosine (m6A)甲基转移酶Mettl3能够在mRNA的3′UTR区域进行m6A修饰,从而使得mRNA能被Ythdf2识别并降解。Mettl3或Ythdf2的缺失都会导致mRNA水平的升高,最终导致内皮细胞特性的增强而阻止造血干细胞的产生[70]。在蛋白水平上,生血内皮细胞中的G蛋白偶联受体183 (G protein- coupled receptor 183, Gpr183)在内皮-造血转化开始之前能够通过招募β-Arrestin1和E3连接酶Nedd4来降解Notch1蛋白从而降低Notch信号的活性,以保证造血干细胞的正常产生[63]。此外,在生血内皮特化过程中,Rab5c通过精密调控Notch信号通路配体和受体的内吞运输,最终促进了造血干细胞的发育[71]。
3.3 Wnt信号通路
Wnt信号通路可以分为β-Catenin依赖的经典Wnt信号通路(canonical pathway),非典型平面细胞极性途径(planar cell polarity pathway)以及非经典Wnt信号/钙通路(Wnt/Ca2+pathway)。这3种信号通路都依赖于Wnt配体与细胞膜表面受体Frizzled (Fzd)的结合以及细胞内Dishevelled的招募。Wnt信号通路的激活对于胚胎早期形态发生,体轴发育以及干细胞自我更新都至关重要[72]。
在β-Catenin依赖的经典Wnt信号通路中,无Wnt配体的情况下,细胞内的β-Catenin被降解复合物(destruction complex, Dishevelled-Axin-GSK3)结合并磷酸化,磷酸化的β-Catenin被β-TrCP识别并泛素化,从而被进一步降解。在Wnt配体与细胞膜上的受体Frizzled (通常为Fzd1或Fzd4)以及共受体LRP5或LRP6结合后使得LRP蛋白发生磷酸化,磷酸化的LRP能够结合降解复合物,阻止β-TrCP对β-Catenin的泛素化及降解,最终细胞浆内的β-Catenin得以稳定存在。部分β-Catenin进入细胞核与TCF/LEF转录因子家族共同调控下游基因的表达,进而调控胚胎体轴建立、组织发生、干细胞的自我更新、增殖和分化,以及成体组织稳态等过程[73]。
在非典型平面细胞极性途径(Wnt/PCP pathway)中,Wnt配体(如Wnt5a、Wnt7、Wnt11等)与受体Frizzled (通常为Fzd3、Fzd6和Fzd7)及共受体(如PTK7、ROR2和RYK)或细胞表面蛋白(CD146、VANGL2、Syndecan和Glypican)结合后,进一步招募Dishevelled与受体复合物结合,激活下游的Rho家族的小G蛋白(如Cdc42、Rac1和RhoA)来调控细胞骨架的形成,并通过JNK通路调控下游基因的转录,进而调控细胞极性及细胞迁移[74]。在非经典Wnt信号/钙通路(Wnt/Ca2+pathway)中,Wnt配体(如Wnt5a)与受体Frizzled结合后能够通过G蛋白将信号传递给PLCr从而促进Ca2+的释放。Ca2+的增加一方面能通过CaMKII激酶来调控下游信号,另一方面能够通过NFAT来调控下游基因的表达[75]。Wnt信号/钙通路对于胚胎背腹分化和体轴形成以及细胞分化都有重要作用[76]。
3.3.1 Wnt信号通路在HSC发育过程的调控作用
在斑马鱼中,过表达Wnt信号通路下游的抑制因子和能够抑制造血干细胞的产生,而前列腺素E2 (prostaglandin E2, PGE2)可以调控Wnt信号通路中β-Catenin的磷酸化进而调控造血发育[77]。斑马鱼体节中Wnt9a的缺失虽然对造血干细胞的命运决定没有影响,但却导致造血干细胞整体数目减少。进一步的实验说明体节中的Wnt9a能够为造血干细胞的增殖提供有利微环境,从而保证造血干细胞的正常作用。Wnt信号通路可以和BMP信号通路共同激活Cdx-Hox,进而调控造血过程[78]。在小鼠中,利用GSK3的抑制剂来增强Wnt信号能够增加造血干细胞的数目;相反,β-Catenin的小分子拮抗剂处理能够减少造血干细胞的数目。另外,在小鼠的胚胎造血过程中发现,Wnt对造血干细胞产生的作用也是动态变化的[79]。在内皮–造血转化发生之前,β-Catenin在内皮细胞中的激活可以促进造血干细胞的产生,一旦造血的命运决定完成之后,β-Catenin的活性就会下调[79]。近期对于视黄酸(retinoic acid, RA)信号通路的研究发现,它能够下调生血内皮细胞或造血前体细胞中的Wnt信号通路,以促进造血干细胞的产生[80]。
除经典的Wnt/β-Catenin信号通路之外,β-Catenin非依赖性的Wnt信号通路也能够调控造血发育过程(图1)。在受精后14~17小时左右斑马鱼胚胎中,体节中的Wnt16可以促进Notch配体DeltaC和DeltaD的表达,体节中的Notch3能够接受DeltaC和DeltaD传递的信号,进而促进生骨节(sclerotome)和造血干细胞的特化,以细胞非自主性的方式调控造血干细胞的产生[81,82]。鉴于斑马鱼胚胎发育中Wnt16与FGF的活性有时间和空间上的相似性,研究人员对两个信号通路进行检测后发现,Wnt16对DeltaC的调控作用是由FGF信号通路介导的[83]。另外,Rspondin1作为Wnt信号的激活因子,可以通过调控Wnt16的表达来调控造血干细胞的产生[84]。但是目前对于体节如何调控造血干细胞命运决定的分子机制还有待进一步研究。
4 结语与展望
造血干细胞能够自我更新并分化产生各种类型的血细胞,其重建造血的能力是临床上利用骨髓移植治疗血液疾病的基础。因此全面系统地研究造血发育过程的分子机制和复杂的信号调控网络,有助于突破临床上造血干细胞匮乏的瓶颈,对血液疾病的治疗和新药的研发都有非常重要的意义。目前,对于造血干细胞的产生过程已经有清晰的认识,但是该过程的调控机制还有待进一步完善。
近年来,随着对造血干细胞产生过程中各个信号通路调控机制的研究越来越多,人们也越来越意识到在内皮-造血转化过程中,调控因子的动态平衡非常重要。例如:ERK和Notch信号的激活在这个过程中的作用都是动态变化的。在内皮细胞中ERK和Notch的激活都是动脉分化所必需的,但是随着内皮-造血转化的开始,内皮细胞若要获得造血特性,细胞内调控内皮特性的ERK和Notch信号活性需要下调,以保证造血特性的获得及维持。一旦这些信号没有及时下调,那么内皮-造血转化过程就不能完成,也不能产生造血干细胞。在体外造血过程中,能否通过调控这些信号通路的活性来促进造血干细胞的产生和维持还需要进一步研究。
致谢
感谢中国科学院动物研究所马东媛博士和中国医学科学院血液病医院(中国医学科学院血液学研究所)王璐博士对本文的仔细阅读和修改。
[1] Orkin SH, Zon LI. Hematopoiesis: an evolving paradigm for stem cell biology.,2008, 132(4): 631–644.
[2] Choi K, Kennedy M, Kazarov A, Papadimitriou JC, Keller G. A common precursor for hematopoietic and endothelial cells.,1998, 125(4): 725–732.
[3] Palis J, Robertson S, Kennedy M, Wall C, Keller G. Development of erythroid and myeloid progenitors in the yolk sac and embryo proper of the mouse.,1999, 126(22): 5073–5084.
[4] Chen MJ, Li Y, De Obaldia ME, Yang Q, Yzaguirre AD, Yamada-Inagawa T, Vink CS, Bhandoola A, Dzierzak E, Speck NA. Erythroid/myeloid progenitors and hematopoietic stem cells originate from distinct populations of endothelial cells.,2011, 9(6): 541–552.
[5] McGrath KE, Frame JM, Fegan KH, Bowen JR, Conway SJ, Catherman SC, Kingsley PD, Koniski AD, Palis J. Distinct sources of hematopoietic progenitors emerge before HSCs and provide functional blood cells in the mammalian embryo.,2015, 11(12): 1892–1904.
[6] Schulz C, Gomez Perdiguero E, Chorro L, Szabo-Rogers H, Cagnard N, Kierdorf K, Prinz M, Wu BS, Jacobsen SEW, Pollard JW, Frampton J, Liu KJ, Geissmann F. A lineage of myeloid cells independent of Myb and hematopoietic stem cells.,2012, 336(6077): 86–90.
[7] Gomez Perdiguero E, Klapproth K, Schulz C, Busch K, Azzoni E, Crozet L, Garner H, Trouillet C, de Bruijn MF, Geissmann F, Rodewald HR. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors.,2015, 518(7540): 547–551.
[8] Böiers C, Carrelha J, Lutteropp M, Luc S, Green JCA, Azzoni E, Woll PS, Mead AJ, Hultquist A, Swiers G, Perdiguero EG, Macaulay IC, Melchiori L, Luis TC, Kharazi S, Bouriez-Jones T, Deng QL, Ponten A, Atkinson D, Jensen CT, Sitnicka E, Geissmann F, Godin I, Sandberg R, de Bruijn MFTR, Jacobsen SEW. Lymphomyeloid contribution of an immune-restricted progenitor emerging prior to definitive hematopoietic stem cells.,2013, 13(5): 535–548.
[9] Müller AM, Medvinsky A, Strouboulis J, Grosveld F, Dzierzak E. Development of hematopoietic stem cell activity in the mouse embryo.,1994, 1(4): 291–301.
[10] Gekas C, Dieterlen-Lievre F, Orkin SH, Mikkola HKA. The placenta is a niche for hematopoietic stem cells.,2005, 8(3): 365–375.
[11] Boisset JC, van Cappellen W, Andrieu-Soler C, Galjart N, Dzierzak E, Robin C. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium.,2010, 464(7285): 116–120.
[12] Chen AT, Zon LI. Zebrafish blood stem cells.,2009, 108(1): 35–42.
[13] Detrich HW, Kieran MW, Chan FY, Barone LM, Yee K, Rundstadler JA, Pratt S, Ransom D, Zon LI. Intraembryonic hematopoietic cell migration during vertebrate development.,1995, 92(23): 10713–10717.
[14] Bertrand JY, Kim AD, Violette EP, Stachura DL, Cisson JL, Traver D. Definitive hematopoiesis initiates through a committed erythromyeloid progenitor in the zebrafish embryo.,2007, 134(23): 4147–4156.
[15] Kissa K, Herbomel P. Blood stem cells emerge from aortic endothelium by a novel type of cell transition.,2010, 464(7285): 112–115.
[16] Patterson LJ, Gering M, Patient R. Scl is required for dorsal aorta as well as blood formation in zebrafish embryos.,2005, 105(9): 3502–3511.
[17] Ren X, Gomez GA, Zhang B, Lin S. Scl isoforms act downstream of etsrp to specify angioblasts and definitive hematopoietic stem cells.,2010, 115(26): 5338– 5346.
[18] Zhen FH, Lan YH, Yan B, Zhang WQ, Wen ZL. Hemogenic endothelium specification and hematopoietic stem cell maintenance employ distinct Scl isoforms.,2013, 140(19): 3977–3985.
[19] North TE, Goessling W, Walkley CR, Lengerke C, Kopani KR, Lord AM, Weber GJ, Bowman TV, Jang IH, Grosser T, Fitzgerald GA, Daley GQ, Orkin SH, Zon LI. Prostaglandin E2 regulates vertebrate haematopoietic stem cell homeostasis.,2007, 447(7147): 1007–1011.
[20] Wang Q, Stacy T, Binder M, Marin-Padilla M, Sharpe AH, Speck NA. Disruption of the Cbfa2 gene causes necrosis and hemorrhaging in the central nervous system and blocks definitive hematopoiesis.,1996, 93(8): 3444–3449.
[21] Chen MJ, Yokomizo T, Zeigler BM, Dzierzak E, Speck NA. Runx1 is required for the endothelial to haematopoietic cell transition but not thereafter.,2009, 457(7231): 887–891.
[22] Lancrin C, Mazan M, Stefanska M, Patel R, Lichtinger M, Costa G, Vargel O, Wilson NK, Möröy T, Bonifer C, Göttgens B, Kouskoff V, Lacaud G. GFI1 and GFI1B control the loss of endothelial identity of hemogenic endothelium during hematopoietic commitment.,2012, 120(2): 314–322.
[23] Eich C, Arlt J, Vink CS, Solaimani Kartalaei P, Kaimakis P, Mariani SA, van der Linden R, van Cappellen WA, Dzierzak E. In vivo single cell analysis reveals Gata2 dynamics in cells transitioning to hematopoietic fate.,2018, 215(1): 233–248.
[24] de Pater E, Kaimakis P, Vink CS, Yokomizo T, Yamada-Inagawa T, van der Linden R, Kartalaei PS, Camper SA, Speck N, Dzierzak E. Gata2 is required for HSC generation and survival.,2013, 210(13): 2843–2850.
[25] Gao X, Johnson KD, Chang YI, Boyer ME, Dewey CN, Zhang J, Bresnick EH. Gata2 cis-element is required for hematopoietic stem cell generation in the mammalian embryo.,2013, 210(13): 2833–2842.
[26] Patterson LJ, Gering M, Eckfeldt CE, Green AR, Verfaillie CM, Ekker SC, Patient R. The transcription factors Scl and Lmo2 act together during development of the hemangioblast in zebrafish.,2006, 109(6): 2389–2398.
[27] Butko E, Distel M, Pouget C, Weijts B, Kobayashi I, Ng K, Mosimann C, Poulain FE, McPherson A, Ni CW, Stachura DL, Del Cid N, Espín-Palazón R, Lawson ND, Dorsky R, Clements WK, Traver D. Gata2b is a restricted early regulator of hemogenic endothelium in the zebrafish embryo.,2015, 142(6): 1050–1061.
[28] Dobrzycki T, Mahony CB, Krecsmarik M, Koyunlar C, Rispoli R, Peulen-Zink J, Gussinklo K, Fedlaoui B, de Pater E, Patient R, Monteiro R. Deletion of a conserved Gata2 enhancer impairs haemogenic endothelium programming and adult Zebrafish haematopoiesis.,2020, 3(1): 71.
[29] Massagué J. TGF-β SIGNAL TRANSDUCTION.,1998, 67(1): 753–791.
[30] Wang RN, Green J, Wang ZL, Deng YL, Qiao M, Peabody M, Zhang Q, Ye JX, Yan ZJ, Denduluri S, Idowu O, Li M, Shen C, Hu A, Haydon RC, Kang R, Mok J, Lee MJ, Luu HL, Shi LL. Bone Morphogenetic Protein (BMP) signaling in development and human diseases.,2014, 1(1): 87–105.
[31] Massagué J, Seoane J, Wotton D. Smad transcription factors.,2005, 19(23): 2783–2810.
[32] Hata A, Seoane J, Lagna G, Montalvo E, Hemmati- Brivanlou A, Massagué J. OAZ uses distinct DNA- and protein-binding zinc fingers in separate BMP-Smad and Olf signaling pathways.,2000, 100(2): 229–240.
[33] Kim DW, Lassar AB. Smad-dependent recruitment of a histone deacetylase/Sin3A complex modulates the bone morphogenetic protein-dependent transcriptional repressor activity of Nkx3.2.,2003, 23(23): 8704– 8717.
[34] Hata A, Lagna G, Massagué J, Hemmati-Brivanlou A. Smad6 inhibits BMP/Smad1 signaling by specifically competing with the Smad4 tumor suppressor.,1998, 12(2): 186–197.
[35] Nakao A, Afrakhte M, Morén A, Nakayama T, Christian JL, Heuchel R, Itoh S, Kawabata M, Heldin NE, Heldin CH, ten Dijke P. Identification of Smad7, a TGFbeta- inducible antagonist of TGF-beta signalling.,1997, 389(6651): 631–635.
[36] Kavsak P, Rasmussen RK, Causing CG, Bonni S, Zhu H, Thomsen GH, Wrana JL. Smad7 binds to Smurf2 to form an E3 ubiquitin ligase that targets the TGF beta receptor for degradation.,2000, 6(6): 1365–1375.
[37] Sadlon TJ, Lewis ID, D'Andrea RJ. BMP4: its role in development of the hematopoietic system and potential as a hematopoietic growth factor.,2004, 22(4): 457–474.
[38] Pyati UJ, Webb AE, Kimelman D. Transgenic zebrafish reveal stage-specific roles for Bmp signaling in ventral and posterior mesoderm development.,2005, 132(10): 2333–2343.
[39] Gupta S, Zhu H, Zon LI, Evans T. BMP signaling restricts hemato-vascular development from lateral mesoderm during somitogenesis.,2006, 133(11): 2177– 2187.
[40] Wilkinson RN, Pouget C, Gering M, Russell AJ, Davies SG, Kimelman D, Patient R. Hedgehog and Bmp polarize hematopoietic stem cell emergence in the zebrafish dorsal aorta.,2009, 16(6): 909–916.
[41] Monteiro R, van Dinther M, Bakkers J, Wilkinson R, Patient R, ten Dijke P, Mummery C. Two novel type II receptors mediate BMP signalling and are required to establish left-right asymmetry in zebrafish.,2008, 315(1): 55–71.
[42] Durand C, Robin C, Bollerot K, Baron MH, Ottersbach K, Dzierzak E. Embryonic stromal clones reveal developmental regulators of definitive hematopoietic stem cells.,2007, 104(52): 20838–20843.
[43] McReynolds LJ, Gupta S, Figueroa ME, Mullins MC, Evans T. Smad1 and Smad5 differentially regulate embryonic hematopoiesis.,2007, 110(12): 3881–3890.
[44] Zhang CX, Lv JH, He QP, Wang SF, Gao Y, Meng AM, Yang X, Liu F. Inhibition of endothelial ERK signalling by Smad1/5 is essential for haematopoietic stem cell emergence.,2014, 5: 3431.
[45] Cook BD, Liu S, Evans T. Smad1 signaling restricts hematopoietic potential after promoting hemangioblast commitment.,2011, 117(24): 6489–6497.
[46] Lan Y, He WY, Li Z, Wang Y, Wang J, Gao J, Wang WL, Cheng T, Liu B, Yang X. Endothelial Smad4 restrains the transition to hematopoietic progenitorssuppression of ERK activation.,2014, 123(14): 2161–2171.
[47] Pimanda JE, Donaldson IJ, de Bruijn MFTR, Kinston S, Knezevic K, Huckle L, Piltz S, Landry JR, Green AR, Tannahill D, Göttgens B. The SCL transcriptional network and BMP signaling pathway interact to regulate RUNX1 activity.,2007, 104(3): 840–845.
[48] Xu RH, Ault KT, Kim J, Park MJ, Hwang YS, Peng Y, Sredni D, Kung HF. Opposite effects of FGF and BMP-4 on embryonic blood formation: roles of PV.1 and GATA-2.,1999, 208(2): 352–361.
[49] Pera EM, Ikeda A, Eivers E, De Robertis EM. Integration of IGF, FGF, and anti-BMP signals via Smad1 phosphorylation in neural induction.,2003, 17(24): 3023–3028.
[50] Yu PZ, Pan G, Yu J, Thomson JA. FGF2 sustains NANOG and switches the outcome of BMP4-induced human embryonic stem cell differentiation.,2011, 8(3): 326–334.
[51] Kopan R, Ilagan MXG. The canonical Notch signaling pathway: unfolding the activation mechanism.,2009, 137(2): 216–233.
[52] Shawber CJ, Kitajewski J. Notch function in the vasculature: insights from zebrafish, mouse and man.,2004, 26(3): 225–234.
[53] Lomeli H, Castillo-Castellanos F. Notch signaling and the emergence of hematopoietic stem cells.,2020, 249(11): 1302–1317.
[54] Butko E, Pouget C, Traver D. Complex regulation of HSC emergence by the Notch signaling pathway.,2016, 409(1): 129–138.
[55] Lawson ND, Scheer N, Pham VN, Kim CH, Chitnis AB, Campos-Ortega JA, Weinstein BM. Notch signaling is required for arterial-venous differentiation during embryonic vascular development.,2001, 128(19): 3675–3683.
[56] Kumano K, Chiba S, Kunisato A, Sata M, Saito T, Nakagami-Yamaguchi E, Yamaguchi T, Masuda S, Shimizu K, Takahashi T, Ogawa S, Hamada Y, Hirai H. Notch1 but not Notch2 is essential for generating hematopoietic stem cells from endothelial cells.,2003, 18(5): 699–711.
[57] Grego-Bessa J, Luna-Zurita L, del Monte G, Bolós V, Melgar P, Arandilla A, Garratt AN, Zang H, Mukouyama YS, Chen HY, Shou WN, Ballestar E, Esteller M, Rojas A, Pérez-Pomares JM, de la Pompa JL. Notch signaling is essential for ventricular chamber development.,2007, 12(3): 415–429.
[58] Burns CE, Traver D, Mayhall E, Shepard JL, Zon LI. Hematopoietic stem cell fate is established by the Notch- Runx pathway.,2005, 19(19): 2331–2342.
[59] Robert-Moreno A, Guiu J, Ruiz-Herguido C, López ME, Inglés-Esteve J, Riera L, Tipping A, Enver T, Dzierzak E, Gridley T, Espinosa L, Bigas A. Impaired embryonic haematopoiesis yet normal arterial development in the absence of the Notch ligand Jagged1.,2008, 27(13): 1886–1895.
[60] Robert-Moreno A, Espinosa L, de la Pompa JL, Bigas A. RBPjkappa-dependent Notch function regulates Gata2 and is essential for the formation of intra-embryonic hematopoietic cells.,2005, 132(5): 1117–1126.
[61] Guiu J, Bergen DJM, De Pater E, Islam ABMMK, Ayllón V, Gama-Norton L, Ruiz-Herguido C, González J, López-Bigas N, Menendez P, Dzierzak E, Espinosa L, Bigas A. Identification of Cdca7 as a novel Notch transcriptional target involved in hematopoietic stem cell emergence.,2014, 211(12): 2411–2423.
[62] Gama-Norton L, Ferrando E, Ruiz-Herguido C, Liu ZY, Guiu J, Islam ABMMK, Lee SU, Yan MH, Guidos CJ, López-Bigas N, Maeda T, Espinosa L, Kopan R, Bigas A. Notch signal strength controls cell fate in the haemogenic endothelium.,2015, 6: 8510.
[63] Zhang PP, He QP, Chen DB, Liu WX, Wang L, Zhang CX, Ma DY, Li W, Liu B, Liu F. G protein-coupled receptor 183 facilitates endothelial-to-hematopoietic transition via Notch1 inhibition.,2015, 25(10): 1093–1107.
[64] Richard C, Drevon C, Canto PY, Villain G, Bollérot K, Lempereur A, Teillet MA, Vincent C, Rosselló Castillo C, Torres M, Piwarzyk E, Speck NA, Souyri M, Jaffredo T. Endothelio-mesenchymal interaction controls runx1 expression and modulates the notch pathway to initiate aortic hematopoiesis.,2013, 24(6): 600–611.
[65] Swift MR, Weinstein BM. Arterial-venous specification during development.,2009, 104(5): 576–588.
[66] He QP, Zhang CX, Wang L, Zhang PP, Ma DY, Lv JH, Liu F. Inflammatory signaling regulates hematopoietic stem and progenitor cell emergence in vertebrates.,2015, 125(7): 1098–1106.
[67] Espín-Palazón R, Stachura DL, Campbell CA, García- Moreno D, Del Cid N, Kim AD, Candel S, Meseguer J, Mulero V, Traver D. Proinflammatory signaling regulates hematopoietic stem cell emergence.,2014, 159(5): 1070–1085.
[68] Liu ZB, Tu HQ, Kang YS, Xue YY, Ma DY, Zhao CT, Li HY, Wang L, Liu F. Primary cilia regulate hematopoietic stem and progenitor cell specification through Notch signaling in zebrafish.,2019, 10(1): 1839.
[69] Wei YL, Ma DY, Gao Y, Zhang CX, Wang L, Liu F. Ncor2 is required for hematopoietic stem cell emergence by inhibiting Fos signaling in zebrafish.,2014, 124(10): 1578–1585.
[70] Zhang CX, Chen YS, Sun BF, Wang L, Yang Y, Ma DY, Lv JH, Heng J, Ding YY, Xue YY, Lu XY, Xiao W, Yang YG, Liu F. m(6)A modulates haematopoietic stem and progenitor cell specification.,2017, 549(7671): 273–276.
[71] Heng J, Lv P, Zhang YF, Cheng XJ, Wang L, Ma DY, Liu F. Rab5c-mediated endocytic trafficking regulates hematopoietic stem and progenitor cell development via Notch and AKT signaling.,2020, 18(4): e3000696.
[72] Steinhart Z, Angers S. Wnt signaling in development and tissue homeostasis.,2018, 145(11).
[73] Clevers H, Nusse R. Wnt/β-catenin signaling and disease.,2012, 149(6): 1192–1205.
[74] Daulat AM, Borg JP. Wnt/Planar cell polarity signaling: new opportunities for cancer treatment.,2017, 3(2): 113–125.
[75] De A. Wnt/Ca2+signaling pathway: a brief overview.,2011, 43(10): 745–756.
[76] Kohn AD, Moon RT. Wnt and calcium signaling: beta-catenin-independent pathways.,2005, 38(3–4): 439–446.
[77] Goessling W, North TE, Loewer S, Lord AM, Lee S, Stoick-Cooper CL, Weidinger G, Puder M, Daley GQ, Moon RT, Zon LI. Genetic interaction of PGE2 and Wnt signaling regulates developmental specification of stem cells and regeneration.,2009, 136(6): 1136–1147.
[78] Lengerke C, Schmitt S, Bowman TV, Jang IH, Maouche-Chretien L, McKinney-Freeman S, Davidson AJ, Hammerschmidt M, Rentzsch F, Green JBA, Zon LI, Daley GQ. BMP and Wnt specify hematopoietic fate by activation of the Cdx-Hox pathway.,2008, 2(1): 72–82.
[79] Ruiz-Herguido C, Guiu J, D'Altri T, Inglés-Esteve J, Dzierzak E, Espinosa L, Bigas A. Hematopoietic stem cell development requires transient Wnt/β-catenin activity.,2012, 209(8): 1457–1468.
[80] Chanda B, Ditadi A, Iscove NN, Keller G. Retinoic acid signaling is essential for embryonic hematopoietic stem cell development.,2013, 155(1): 215–227.
[81] Clements WK, Kim AD, Ong KG, Moore JC, Lawson ND, Traver D. A somitic Wnt16/Notch pathway specifies haematopoietic stem cells.,2011, 474(7350): 220–224.
[82] Kim AD, Melick CH, Clements WK, Stachura DL, Distel M, Panákova D, MacRae C, Mork LA, Crump JG, Traver D. Discrete Notch signaling requirements in the specification of hematopoietic stem cells.,2014, 33(20): 2363–2373.
[83] Lee Y, Manegold JE, Kim AD, Pouget C, Stachura DL, Clements WK, Traver D. FGF signalling specifies haematopoietic stem cells through its regulation of somitic Notch signalling.,2014, 5: 5583.
[84] Genthe JR, Clements WK. R-spondin 1 is required for specification of hematopoietic stem cells through Wnt16 and Vegfa signaling pathways.,2017, 144(4): 590–600.
Regulatory signaling pathways in hematopoietic stem cell development
Chunxia Zhang1,2, Feng Liu1
The blood system provides the body with oxygen and nutrients, maintains the homeostasis of the internal environment through material exchange, and keeps the body with immune defense and protection. Hematopoietic stem cells (HSCs), which are pluripotent adult stem cells with self-renewal and differentiation potential, are the origin of mature blood cells in the body. The production, development and maturation processes of HSCs and their derivatives are the so-called ‘hematopoiesis’, which begins in the early embryonic development and throughout the life course; any abnormality during these processes can cause the occurrence of hematological diseases. Therefore, a deeper understanding of hematopoietic development and its regulation is important to the diagnosis and treatment of blood diseases. In recent years, a series of advances have been made in studying hematopoietic development using mice and zebrafish as animal models. It has been shown that BMP, Notch and Wnt signaling pathways play an important role in the fate determination and generation of HSCs. In this review, we systematically summarize the regulatory roles of these signaling pathways in the hematopoietic process of mice and zebrafish embryos, to improve our understanding on the underlying regulatory network of hematopoietic development and provide guidance for clinical application.
hematopoietic stem cell; signaling pathways; BMP; Notch; Wnt
张春霞,2010—2017年就读于中国科学院动物研究所,在血液与心血管发育研究组攻读博士学位,目前在美国哈佛医学院/波士顿儿童医院做博士后。博士期间,主要研究斑马鱼造血干细胞发育的调控机制,阐明了BMP与ERK信号通路在造血干细胞产生过程中的相互关联(, 2014年),发现了炎性信号通路可以通过Notch信号来调控造血干细胞的产生(, 2015年),首次揭示了m6A修饰在胚胎造血干细胞命运决定中的关键作用(, 2017年)。这些工作不仅增加了人们对造血干细胞产生机制的认识,而且对体外诱导扩增造血干细胞提供了理论指导。博士论文《BMP-ERK信号通路以及炎性信号调控斑马鱼造血干细胞产生的分子机制》获得2020年中国科学院优秀博士生论文。

2021-01-20;
2021-03-01
国家重点研发计划项目(编号:2018YFA0800200,2018YFA080100),中国科学院战略性科技先导专项(编号:XDA16010207)和国家自然科学基金重点项目(编号:32030032,31830061)资助[Supported by the National Key Research and Development Program of China (Nos.2018YFA0800200, 2018YFA080100), the Strategic Priority Research Program of the Chinese Academy of Sciences, China (No. XDA16010207), and the National Natural Science Foundation of China (Nos. 32030032, 31830061)]
张春霞,博士,研究方向:造血干细胞发育。E-mail: zhangchxa@163.com
刘峰,研究员,博士生导师,研究方向:造血干细胞发育。E-mail: liuf@ioz.ac.cn
10.16288/j.yczz.21-026
2021/3/16 11:16:44
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210315.0942.003.html
(责任编委: 张雷)

