屎肠球菌R2发酵豆腐黄浆水的代谢作用
陈志娜,叶 韬,张慧宇,郭晓香,马琳琳,李金凤,张 萍,沈业桥,刘 天
(1 淮南师范学院生物工程学院 安徽淮南232038 2 资源与环境生物技术安徽普通高校重点实验室 安徽淮南232038)
黄浆水是豆腐加工过程中的副产物,富含大豆异黄酮、蛋白质和维生素P、K 等营养物质,以及大量水溶性的糖类,如水苏糖、棉籽糖、蔗糖等[1-2],通常被直接排放,既浪费资源又污染环境[3]。黄浆水在贮藏的过程中可自然发酵为酸浆,是一种良好的豆腐凝固剂。与石膏、卤水作为凝固剂的豆腐相比,酸浆豆腐质地细腻、口感鲜嫩,深受人们喜爱[4]。然而,自然发酵酸浆中含有大量的乳酸菌、酵母及其它微生物,也包括一些有害微生物,如蜡样芽孢杆菌[5],造成酸浆质量不稳定,并对酸浆豆腐的安全性构成威胁,从而限制了其工业化应用。
由于乳酸菌在酸浆形成过程中起主导作用,因此纯种乳酸菌发酵制备酸浆成为趋势。目前已有干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌、解淀粉乳杆菌等[6-9]多种乳酸菌应用于黄浆水发酵中。由于人体不能产生α-半乳糖苷酶,因此黄浆水中的主要低聚糖——水苏糖和棉籽糖等不能被人体消化利用,在肠道中被细菌发酵产气,导致胃肠胀气[10]。研究表明有些乳酸菌,如鼠李糖乳杆菌、干酪乳杆菌等具有α-半乳糖苷酶活性,在发酵的过程中可利用大豆低聚糖缓解胀气[11]。另外,在乳酸菌发酵黄浆水的过程中,在β-葡萄糖苷酶的作用下,糖苷形式的大豆异黄酮可以转化为更易吸收的游离型苷元大豆异黄酮[12],从而提高发酵黄浆水的抗氧化活性[13]。
屎肠球菌(Enterococcus faecium)属于乳酸菌的一种,是肠道内的正常菌群,广泛存在于传统乳制品[14]、泡菜[15]、豆酱[16]等发酵食品中,具有耐酸、耐热、肠道黏附能力强等特点,以及抑制病原菌、增强免疫力等作用[17-18]。课题组前期从泡菜中筛选出1 株屎肠球菌E.faecium R2[19],该菌株可利用豆腐黄浆水中的低聚糖生长产酸,无需补充碳源和其它营养素即可达到豆腐凝固剂所需的酸度。采用该菌种纯种发酵制备酸浆可有效降低大肠杆菌等的污染[20],既解决了自然发酵酸浆中微生物杂乱的问题,提高了酸浆豆腐的安全性,又可降低生产成本,具有广泛的应用前景。为了更好地了解屎肠球菌R2 对豆腐黄浆水的发酵特性,本研究采用HPLC 法对屎肠球菌R2 发酵豆腐黄浆水过程中的低聚糖、有机酸以及大豆异黄酮的组分和含量进行测定与分析,监控发酵过程中α-半乳糖苷酶和β-葡萄糖苷酶活性的变化规律,并对发酵黄浆水的体外抗氧化活性进行评价,揭示屎肠球菌R2 的发酵功能特性,以期为屎肠球菌R2 的工业化应用提供理论依据。
1 材料与方法
1.1 材料与试剂
屎肠球菌E.faecium R2,CGMCC No.14944(专利保藏菌种),保藏于中国微生物菌种保藏管理委员会普通微生物中心,由淮南师范学院食品质量与安全实验室提供;食品级黄豆购于淮南苏果超市;黄浆水,实验室自制;1,1-二苯基-2-三硝基苯肼(DPPH)、Trolox、大豆苷、大豆苷元、染料木苷、染料木素、黄豆黄素、大豆黄素苷、草酸、酒石酸、乳酸、柠檬酸、果糖、葡萄糖、棉籽糖、水苏糖、蔗糖等标准品,美国Sigma 公司;乙睛(色谱纯)、乙酸(色谱纯),天津科密欧化化学试剂有限公司;甲醇(色谱纯),永华化学科技(江苏)有限公司;对硝基苯酚、4-硝基苯-α-D-吡喃半乳糖苷、4-硝基苯-β-D-吡喃葡萄糖苷,阿拉丁生化科技股份有限公司;其它试剂均为国产分析纯。
MRS 液体培养基:蛋白胨10 g,酵母浸粉5 g,磷酸氢二钾2 g,柠檬酸二铵2 g,葡萄糖20 g,牛肉膏10 g,无水乙酸钠5 g,硫酸镁0.2 g,硫酸锰0.05 g,吐温-80 1 mL,121 ℃灭菌15 min,冷却备用。
黄浆水培养基:将100 mL 黄浆水加入到250 mL 锥形瓶中,密封后121 ℃灭菌15 min,冷却备用。
1.2 仪器与设备
SW-CJ-2D 型超净工作台,苏州净化设备有限公司;LRH-250-A 生化培养箱,广东泰宏君科学仪器股份有限公司;LDZW-60KCS-ll 型立式压力蒸汽灭菌锅,上海申安医疗器械;T6 新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;5804R 型离心机,Eppendorf 公司;KQ-400B型超声波清洗机,昆山超声仪器有限公司;HPLC2998 高效液相色谱,Waters 公司;250 mm×4.6 mm 5 μm 氨 基 柱、250 mm×4.6 mm 5 μm Thermo C18 柱,Aglient 公司。
1.3 方法
1.3.1 黄浆水的制备 以传统工艺制作的卤水黄浆水作为初级黄浆水,初级黄浆水接种屎肠球菌发酵剂(接种量3%)发酵36 h 制得一代酸浆。以一代酸浆做为凝固剂制得二级豆腐黄浆水,再接种屎肠球菌发酵剂(接种量3%)发酵36 h 制得二代酸浆。以二代酸浆做凝固剂制得三级豆腐黄浆水,如此循环三代后消除原卤盐凝固剂的影响,试验采用三代以后酸浆点制豆腐过程中所产生的黄浆水[21]。
1.3.2 样品制备 将活化后的屎肠球菌R2 按3%接种量接入新鲜豆腐黄浆水培养基中,于37℃下静置培养,获得发酵0,12,24,36 h 的样品,测定发酵过程中的屎肠球菌R2 生物量和pH 的变化趋势。样品经0.45 μm 微孔滤膜过滤后供后续分析使用。
1.3.3 HPLC 测定大豆低聚糖 色谱柱:Aglient氨基柱(250 mm×4.6 mm,5 μm);流动相:70%乙腈-30%水(蔗糖、果糖、葡萄糖),68%乙腈-32%水(棉籽糖、水苏糖);流速:1.0 mL/min;进样量:10 μL;柱温:35 ℃;检测器:示差折光检测器。大豆低聚糖的标准曲线见表1。
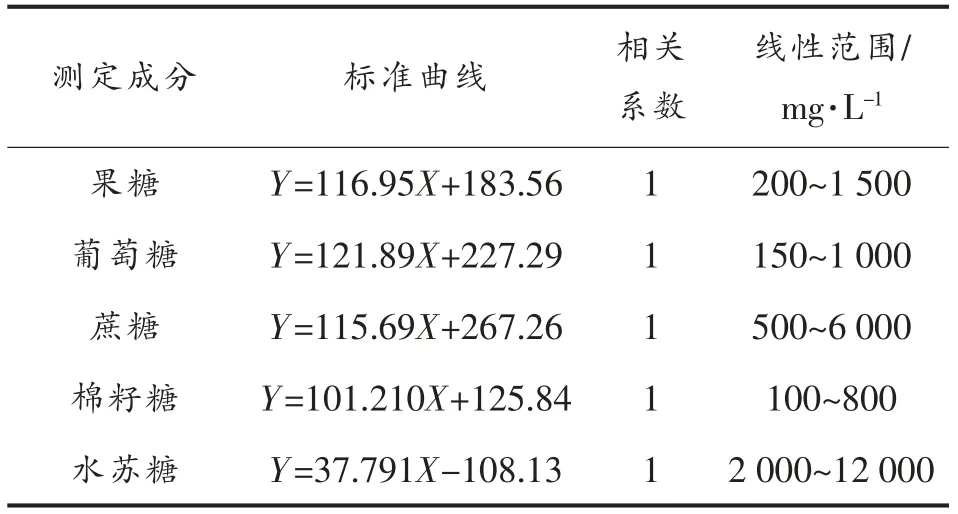
表1 大豆低聚糖标准品的标准曲线Table 1 The standard curves of soybean oligosaccharides
1.3.4 HPLC 测定有机酸 色谱柱:Agilent ZORBAX SB-Aq (250 mm×4.6 mm,5 μm);Thermo C18 柱(250 mm×4.6 mm,5 μm);流动相:10 mmol/L 磷酸氢二钾 (用磷酸调pH 为2.55);流速:0.5 mL/min;柱温:30 ℃;进样量:10 μL。检测器:紫外检测器;波长:210 nm。有机酸的标准曲线见表2。
1.3.5 HPLC 测定大豆异黄酮 色谱柱:Thermo C18 柱(250 mm×4.6 mm,5 μm);流动相:A:0.1%乙酸乙腈溶液,B:0.1%乙酸溶液;流速:1.0 mL/min,柱温:30 ℃;进样量:10 μL。检测器:紫外检测器;波长:260 nm。梯度洗脱条件按照GB/T 26625-2011。大豆异黄酮标准曲线见表3。
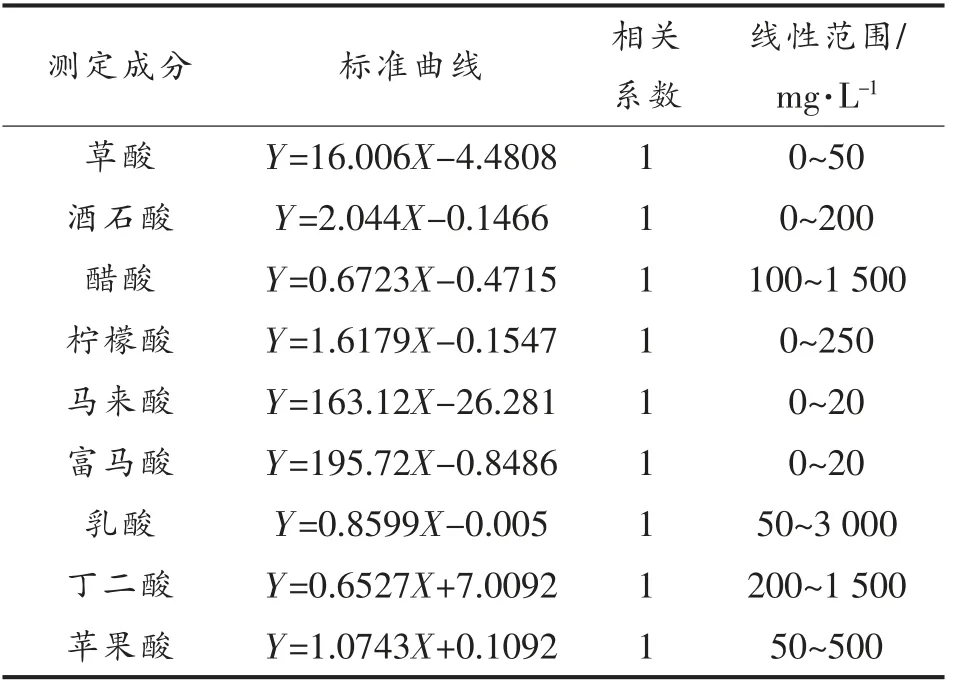
表2 有机酸标准品的标准曲线Table 2 The standard curves of organic acids
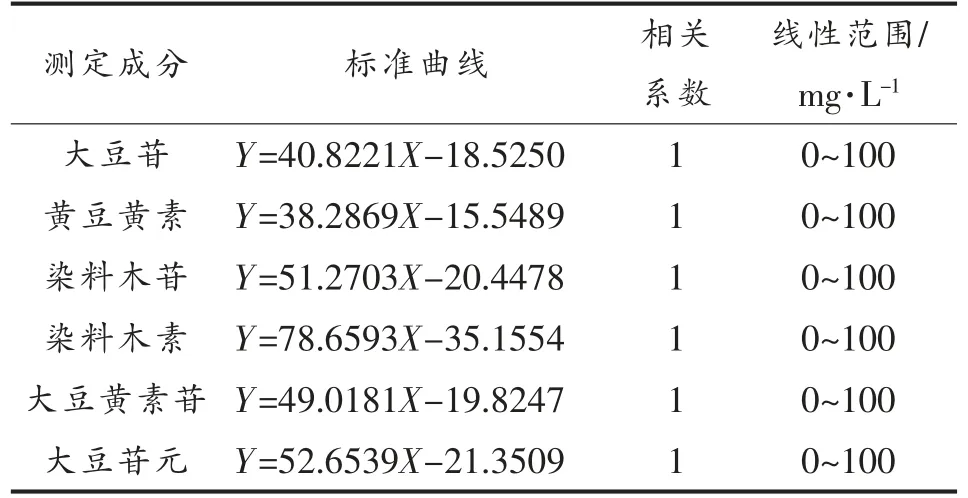
表3 大豆异黄酮标准品的标准曲线Table 3 The standard curves of soybean isoflavones
1.3.6 酶的定位及活性测定
1)粗酶液的制备 将屎肠球菌R2 以3%接种量接种到黄浆水培养基中,于37 ℃下静置培养,分别于12,24,36 h 取发酵液。发酵液于4 ℃下5 000 r/min 离心10 min,得菌液上清及沉淀;菌体沉淀用生理盐水洗涤2 次后,悬浮于2 mL、pH=5.0 乙酸-乙酸钠缓冲溶液中,于冰浴条件下进行超声破碎,超声功率130 W,破碎时间15 min,间隔时间2 s。破碎后于4 ℃、12 000 r/min 下离心10 min,得菌体碎片和破碎上清;菌体碎片用5 mL、pH=5.0 乙酸-乙酸钠缓冲溶液洗涤2 次后溶于1 mL pH=5.0 的乙酸-乙酸钠缓冲液中用作酶活测定,菌液上清、破碎上清直接进行酶活测定[22]。
2)绘制标准曲线 准确称取0.1391 g 对硝基苯酚,精确到0.001 g,用0.2 mol/L 碳酸钠溶液定容至100 mL,4 ℃下保存备用。依次移取对硝基苯酚标准贮备液1,2,3,4,5,7,9 mL,用0.2 mol/L 碳酸钠溶液定容至100 mL,配成浓度为0.1,0.2,0.3,0.4,0.5,0.7,0.9 mmol/L 的对硝基苯酚标准工作液。
吸取1 mL 对硝基酚标准溶液于试管中,加入1 mL pH=5.0 的乙酸-乙酸钠缓冲液;对照的空白试管中加入2 mL pH=5.0 的乙酸-乙酸钠缓冲液;在所有的试管中加入8 mL 0.2 mol/L 碳酸钠溶液,振荡,在400 nm 处测定吸光值。以对硝基苯酚含量为X 轴、吸光值为Y 轴,绘制标准曲线。标准曲线方程为Y=1.642X+0.006,R2=0.999。
3)酶活测定 将粗酶液、10 mmol/L 对硝基苯-α-D-吡喃半乳糖苷溶液和10 mmol/L 对硝基苯-β-D-吡喃葡萄糖苷溶液分别于37 ℃水浴中预热10 min。然后吸取0.4 mL 粗酶液于干净的试管中,分别加入0.4 mL 对硝基苯-α-D-吡喃半乳糖苷溶液或10 mmol/L 对硝基苯-β-D-吡喃葡萄糖苷溶液,破碎上清和破碎沉淀酶活测定以缓冲液代替粗酶液作为空白对照,菌液上清酶活测定以加热使酶失活的上清液作为空白对照,于37 ℃中水浴10 min 后,加入3.2 mL 0.2 mol/L 碳酸钠溶液,振荡混匀,终止酶反应,待冷却至室温后,将反应液于400 nm 处测定吸光值。按照标准曲线回归方程计算样品中菌液上清、破碎上清和破碎沉淀中的α-半乳糖苷酶和β-葡萄糖苷酶活力[22]。
酶活力单位定义:在37 ℃,pH 5.0 条件下,1 min 催化生成1 nmol 对硝基苯酚所需要的酶量为1 个酶活单位(U)。
1.3.7 对DPPH·清除能力的测定 参考刘力[13]的方法略有修改,取2.0 mL 0.05 g/L DPPH 无水乙醇溶液,加入2.0 mL 发酵液,摇匀,置于25 ℃水浴中避光反应30 min 后,于8 000 r/min 下离心10 min,期间注意避光。在517 nm 处测定吸光度值。蒸馏水作为对照,Trolox 作为标准物质,绘制标准曲线。标准曲线方程Y=-0.0285X+0.8299,R2=0.9907,结果以μg Trolox/mL 表示。
1.4 数据处理
结果以平均值±标准差表示。使用SPSS18.0软件对结果进行统计分析(One-way ANOVA),利用Duncan’s multiple range test 方法进行显著性分析,选取P<0.05 为显著水平。采用OriginPro8.0软件绘图。
2 结果与分析
2.1 发酵过程中酸度的变化
豆腐黄浆水中含有小分子糖类、蛋白质及一些生物活性物质,适于微生物的生长,pH 值可以反映屎肠球菌R2 发酵黄浆水后形成的游离H+和有机酸的变化情况。图1为屎肠球菌R2 发酵黄浆水过程中OD 值和pH 的变化规律。从图1中可以看出,屎肠球菌R2 能够利用豆腐黄浆水中的小分子糖类生长,降低黄浆水的pH 值。随着发酵时间的延长,菌体生长量逐渐增加,pH 值逐渐下降,其中12~24 h 之间菌体生长最快,pH 下降最明显。
2.2 发酵处理对豆腐黄浆水中低聚糖含量的影响
图2为屎肠球菌R2 发酵豆腐黄浆水过程中低聚糖含量的变化规律。新鲜豆腐黄浆水中5 种糖的含量为19 418.22 mg/L,其中水苏糖和蔗糖含量较高,水苏糖含量占5 种糖含量的58%,蔗糖含量占5 种糖含量的30%,棉籽糖、葡萄糖和果糖的含量相对较低。在屎肠球菌R2 发酵豆腐黄浆水的过程中,低聚糖含量均有不同程度的下降。发酵12 h 后,葡萄糖的含量迅速下降,利用率达到43%,其次为棉籽糖和果糖,利用率均为17%,水苏糖和蔗糖的利用率较低,分别为4%和3%;发酵24 h 后葡萄糖基本利用完毕,无法检出。此时,果糖的利用率达到68%,棉籽糖的利用率达到22%,水苏糖和蔗糖的利用率均为12%。表明屎肠球菌R2 在发酵豆腐黄浆水时优先利用葡萄糖,其次为果糖和棉籽糖;发酵36 h 后,果糖的含量几乎没有发生变化(P<0.05),蔗糖的利用率达到31%,棉籽糖和水苏糖的利用率分别为38%和24%。因此,经过屎肠球菌R2 的发酵作用,可以有效地缓解棉籽糖和水苏糖引起的胃胀气。
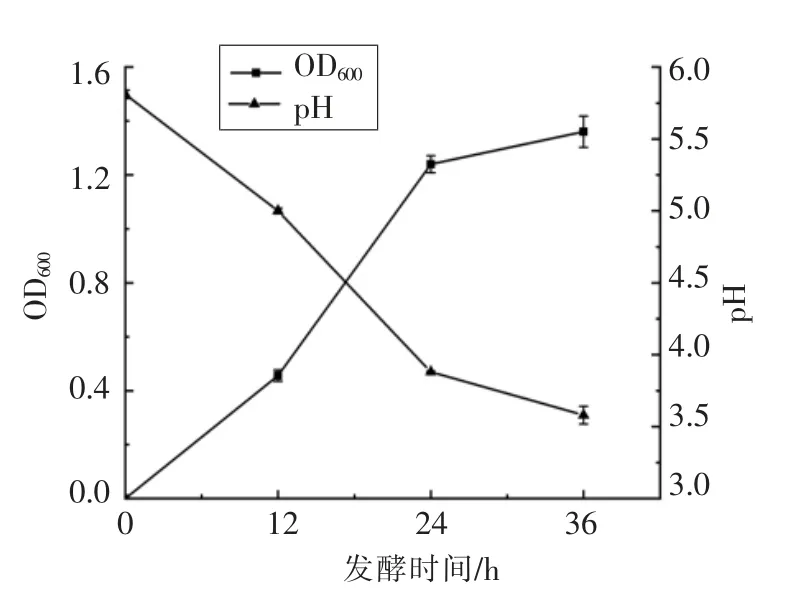
图1 屎肠球菌R2 发酵黄浆水过程中pH和OD 值的变化规律Fig.1 Changes of pH and OD values in fermented tofu whey (FTW)during the fermentation with E.faecium R2
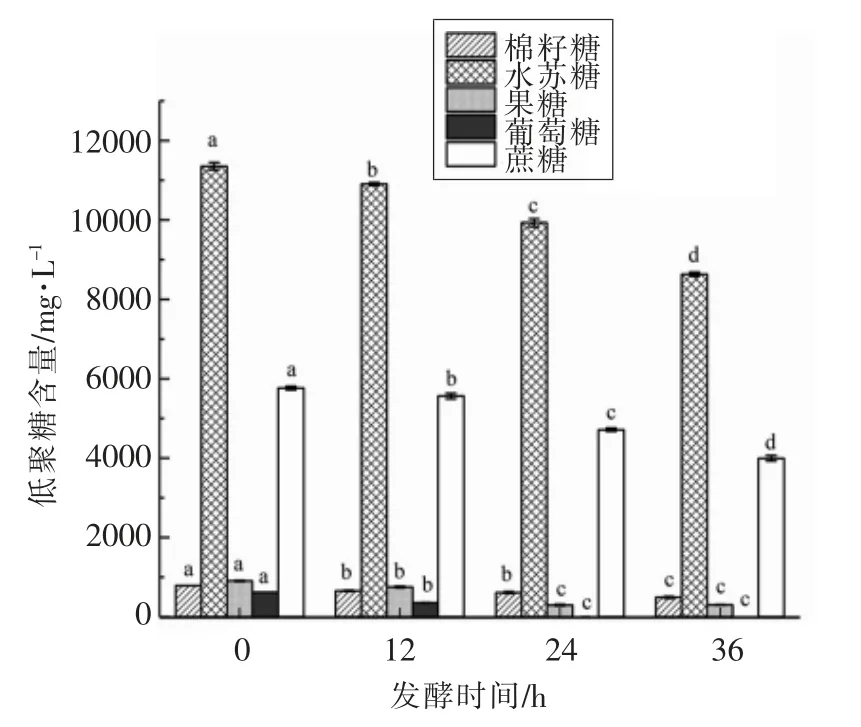
图2 屎肠球菌R2 发酵豆腐黄浆水过程中低聚糖含量的变化Fig.2 Changes of oligosaccharides in FTW during the fermentation with E.faecium R2
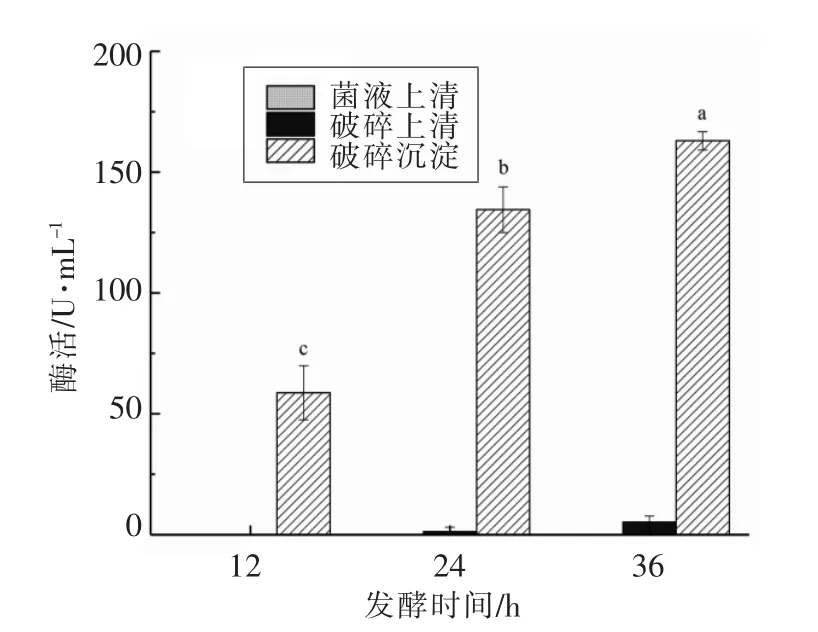
图3 屎肠球菌R2 不同部位的α-半乳糖苷酶活性Fig.3 α-galactosidase activity of different fractions in E.faecium R2
2.3 屎肠球菌R2 α-半乳糖苷酶的定位及活性分析
棉籽糖和水苏糖的代谢需要α-半乳糖苷酶,研究表明,鼠李糖乳杆菌(Lactobacillus rhamnosus)、干酪乳杆菌(Lact.casei)、植物乳杆菌(Lact.plantarum)、发酵乳杆菌(Lact.fermentum)、短乳杆菌(Lact.s brevis)、布氏乳杆菌(Lact.buchneri)、肠膜明串株菌(Leuconostoc mesenteroides)和罗伊氏乳杆菌(Lact.reuteri)等[23-26]在发酵的过程中可以分泌α-半乳糖酶,将α-半乳糖苷类寡糖水解为可消化的糖类。屎肠球菌R2 不同部位的α-半乳糖苷酶酶活见图3。如图3所示,菌液上清酶活几乎为零,说明α-半乳糖苷酶没有被分泌到细胞外,屎肠球菌R2 的α-半乳糖苷酶不是胞外酶;细胞破碎并离心后,细胞破碎上清和破碎沉淀均具有酶活,说明屎肠球菌R2 的α-半乳糖苷酶属于胞内酶;细胞破碎沉淀酶活显著高于破碎上清酶活,说明该酶以可溶性蛋白和不可溶性蛋白两种形式存在,且主要以不可溶性蛋白形式为主。这一结果与Ames 等[27]的研究一致,其研究表明大多数α-半乳糖苷酶位于G+阳性菌细胞质中。Mital 等[28]研究证明乳酸菌所产生的α-半乳糖苷酶类的活性范围在pH 4.5~8.0,而屎肠球菌R2 发酵36 h后pH 下降到3.58(图1),严重偏离了该酶的最适pH,这导致了豆腐黄浆水中棉籽糖和水苏糖被部分分解(图2),而不是被全部降解,这一结果与付亭亭等[29]的研究一致。
2.4 发酵处理对豆腐黄浆水中有机酸含量的影响
表4显示了屎肠球菌R2 发酵豆腐黄浆水过程中乳酸、醋酸、酒石酸等9 种有机酸的变化。结果表明,在新鲜豆腐黄浆水中丁二酸含量最高,柠檬酸含量次之,接下来为醋酸、酒石酸、苹果酸和乳酸,马来酸和富马酸含量很低,草酸含量最低,未检出。
经屎肠球菌R2 的发酵后,豆腐黄浆水中的有机酸总量有了大幅度的升高,这与发酵过程中黄浆水中的pH 值的下降规律一致。从表4中可以看出,发酵过程中乳酸的量增幅最大,由99.60 mg/L 增加到2 678.88 mg/L,提高了27 倍;其次是醋酸由950.26 mg/L 增加到1 210.91 mg/L;马来酸的含量稍有增加,富马酸的含量呈现先升高随后降低的趋势。酒石酸、柠檬酸和苹果酸的含量在整个发酵过程中逐渐降低,丁二酸的含量稍有波动。

表4 屎肠球菌R2 发酵豆腐黄浆水过程中有机酸含量的变化(mg/L)Table 4 Changes of organic acids in FTW during the fermentation with E.faecium R2 (mg/L)
2.5 发酵处理对豆腐黄浆水中大豆异黄酮组成和含量的影响
大豆异黄酮是大豆生长中形成的一类次级代谢产物,具有抗肿瘤、预防心血管疾病、骨质疏松症、改善妇女更年期综合征等多种功效[30]。大豆异黄酮共有12 种异构体,以游离型黄酮苷元(Aglycones)和结合型糖苷(Glycosides)2 种形式存在。苷元型大豆异黄酮主要包括染料木素(Genistein)、黄豆黄素(Glycitein)和大豆苷元(Daidzein);糖苷型大豆异黄酮主要包括染料木苷(Genistin)、大豆黄素苷(Glycitin)、大豆苷(Daidzin)以及它们各自的乙酰基葡萄糖苷和丙二酰葡萄糖苷衍生物[31]。天然存在的大豆异黄酮主要以结合型β-葡萄糖苷的形式存在,这种形式的大豆异黄酮较难被人体吸收;游离苷元型大豆异黄酮不仅具有更高的生物活性,而且更容易被肠道吸收[13]。
研究了屎肠球菌R2 的发酵作用对豆腐黄浆水中染料木苷、大豆黄素苷、大豆苷、染料木素、大豆苷元及黄豆黄素含量的影响,结果如图4所示。在新鲜豆腐黄浆水中大豆异黄酮总量为245.17 mg/L,其中糖苷型大豆异黄酮含量为175.12 mg/L,这与贺云[31]的结果一致,即大部分大豆异黄酮以结合型糖苷的形式存在。
新鲜豆腐黄浆水经过屎肠球菌R2 的发酵作用后,其大豆异黄酮组分的存在形式及含量都发生了变化。结果表明,随着发酵时间的延长,糖苷型大豆异黄酮含量逐渐降低,苷元型大豆异黄酮含量明显升高,这表明屎肠球菌R2 能够促进糖苷型大豆异黄酮向苷元型大豆异黄酮转化。发酵36 h 后,低活性糖苷型异黄酮含量显著减少(P<0.05),其含量下降到23.40 mg/L;其中大豆苷和染料木苷在发酵24 h 后含量为零,全部转化,而大豆黄素苷的含量变化相对较小;同时,游离型苷元异黄酮的含量显著增加(P<0.05),由70.05 mg/L增加到115.21 mg/L;其中大豆苷元含量由25.43 mg/L 增加至43.17 mg/L,染料木素含量由24.90 mg/L 增加至50.16 mg/L,黄豆黄素含量由19.72 mg/L 增加至21.88 mg/L。
发酵24 h 后染料木苷和大豆苷已被完全转化,但是24 h 后染料木素和大豆苷元的含量仍在增加(P<0.05),说明还存在丙二酰染料木苷和丙二酰大豆苷,当原有的染料木苷和大豆苷消耗完以后,这两种丙二酰葡萄糖苷转化成相应的β-葡萄糖苷后又继续向苷元型异黄酮转化[32]。另外,经过屎肠球菌R2 的发酵作用,大豆异黄酮总量由245.17 mg/L 下降到 138.60 mg/L,可能是因为大豆苷转化成大豆苷元后,在屎肠球菌R2 的作用下又进一步转化成雌马酚。雌马酚是大豆异黄酮重要的代谢终产物,由大豆苷元在肠道菌的作用下经特异性代谢得到,具有较异黄酮前体更高的生物活性,且性质稳定,容易被人体吸收[33]。姜雪[34]从女性体内筛选出1 株可以转化大豆苷元生成雌马酚的肠道菌屎肠球菌HY-1。因此,屎肠球菌R2很可能也具有将大豆苷元转化成雌马酚的能力。
2.6 屎肠球菌R2 β-葡萄糖苷酶的定位及活性分析
研究表明乳酸菌在发酵过程中可促进豆腐黄浆中糖苷型大豆异黄酮向游离苷元型大豆异黄酮转化,这主要是β-葡萄糖苷酶的酶解作用[30]。对屎肠球菌R2 发酵过程中不同部位的β-葡萄糖苷酶酶活进行测定,结果如图5所示,可知屎肠球菌R2 具有β-葡萄糖苷酶酶活,且不同部位的酶活具有显著差异(P<0.05)。菌体上清中的β-葡萄糖苷酶酶活几乎为零,破碎沉淀酶活显著高于破碎上清酶活,说明屎肠球菌R2 的β-葡萄糖苷酶属于胞内酶,且主要以不可溶性蛋白形式为主。这一结果与张哲[35]的研究一致,其研究发现植物乳杆菌的β-葡萄糖苷酶为胞内酶,主要为处于细胞膜上的不可溶性酶,还有少量存在于原生质体内细胞液中的可溶性酶。由图5可以看出,随着发酵时间的延长,β-葡萄糖苷酶的酶活先增加后稍有下降,在发酵24 h 时达到最大。
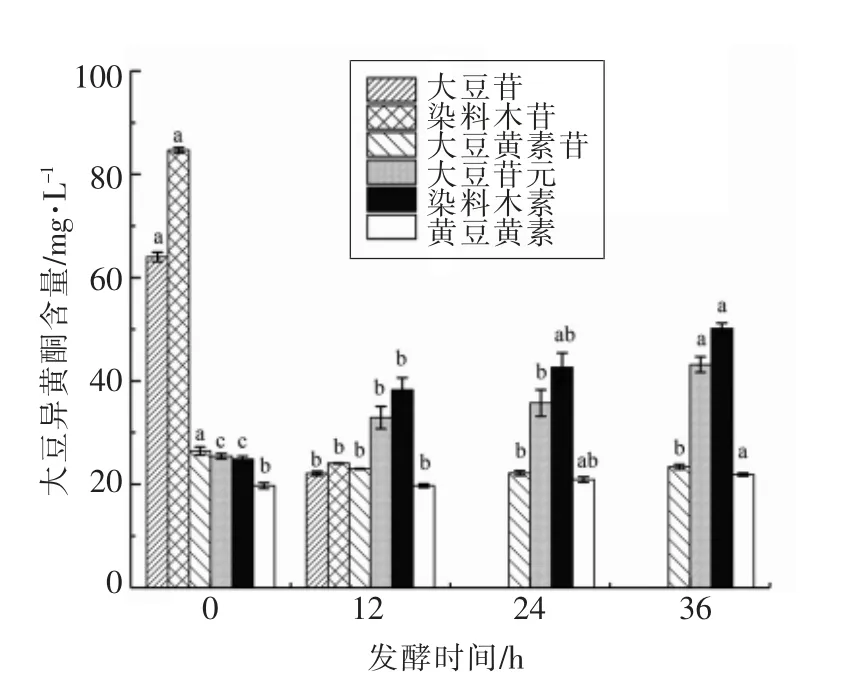
图4 屎肠球菌R2 发酵对豆腐黄浆水中大豆异黄酮含量的影响Fig.4 Changes of isoflavones in FTW during the fermentation with E.faecium R2
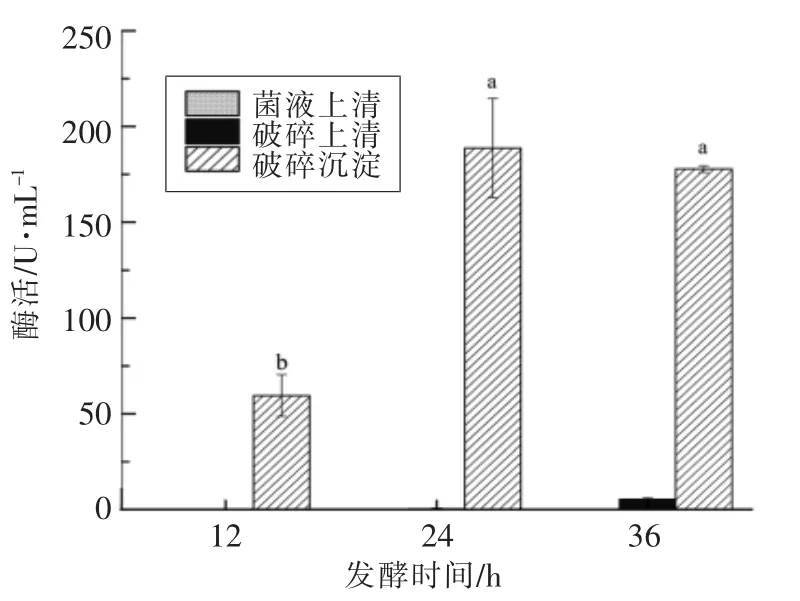
图5 屎肠球菌R2 不同部位的β-葡萄糖苷酶活性Fig.5 β-glucosidase activity of different fractions in E.faecium R2
2.7 发酵处理对豆腐黄浆水清除DPPH 自由基能力的影响
大豆异黄酮具有很强的抗氧化活性,经过乳酸菌的发酵作用,糖苷型大豆异黄酮转化为苷元型大豆异黄酮,抗氧化活性会进一步增强[13]。图6为发酵黄浆水DPPH 自由基的清除能力,由图6可以看出,屎肠球菌R2 发酵豆腐黄浆可显著提高其清除DPPH 自由基的能力,发酵36 h 后,黄浆水DPPH 自由基的清除能力由14.20 μg Trolox/mL 增加到55.25 μg Trolox/mL。
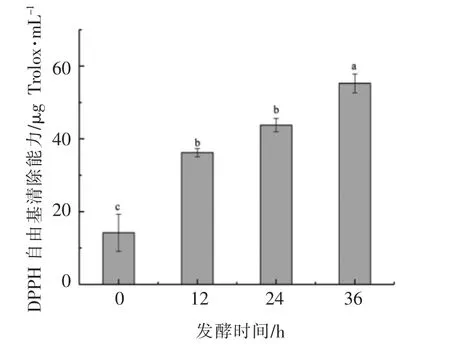
图6 发酵黄浆水DPPH 自由基的清除能力Fig.6 DPPH radical scavenging activities in FTW by E.faecium R2
使用Pearson 相关性检验对大豆异黄酮转化与DPPH 自由基清除能力进行相关性分析,结果如表5所示。结果显示,游离型苷元大豆异黄酮大豆苷元和染料木素的含量与DPPH 自由基清除能力呈显著正相关(P<0.05),并且染料木素的含量与DPPH 自由基清除能力呈极显著正相关(P<0.01),同时,糖苷型大豆异黄酮大豆苷和染料木苷的含量与DPPH 自由基清除能力呈显著负相关 (P<0.05),而大豆黄素苷和黄豆黄素与DPPH 自由基清除能力之间不相关(P<0.05)。说明屎肠球菌R2发酵过程中DPPH 自由基清除能力的提高确实与大豆异黄酮的生物转化有关,且主要因为染料木素和大豆苷元含量的增加。
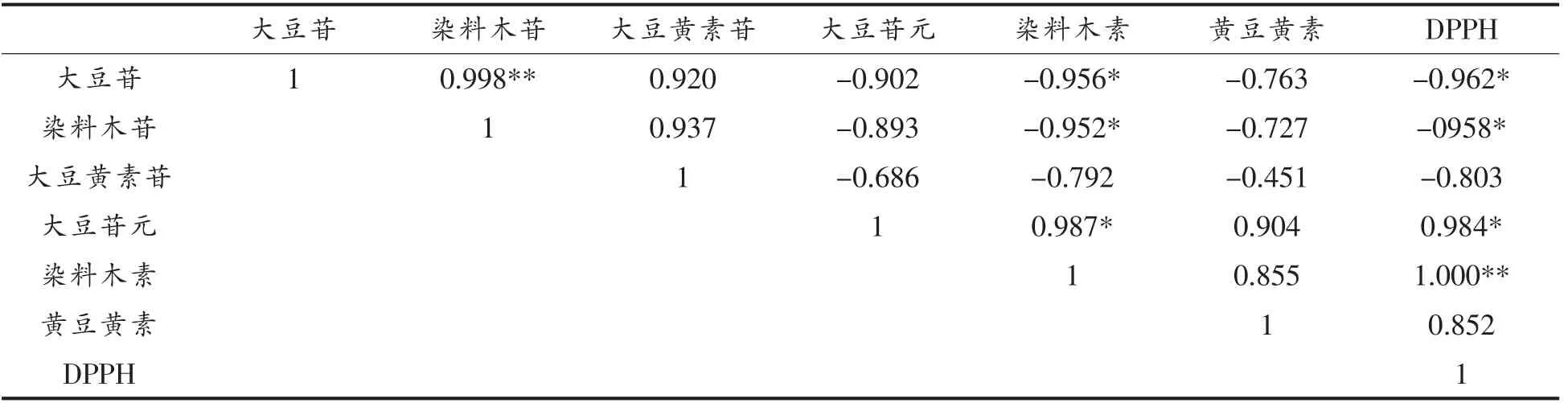
表5 大豆异黄酮生物转化与DPPH 自由基清除能力的相关性Table 5 Pearson correlation coefficients between soybean isoflavone biotransformation and DPPH radical scavenging activities
3 结论
对屎肠球菌R2 发酵作用对豆腐黄浆水中低聚糖、有机酸和大豆低聚糖含量以及DPPH 清除能力的影响进行了研究。结果表明,屎肠球菌R2可以产生α-半乳糖苷酶以利用豆腐黄浆水中的碳水化合物生长产酸,可以有效地降解棉籽糖和水苏糖,产生大量的乳酸、醋酸等有机酸,最终使pH 下降到3.6 以下;同时,屎肠球菌R2 还可以产生β-葡萄糖苷酶将活性低的糖苷型大豆异黄酮(主要为大豆苷和染料木苷)转化为高活性游离型苷元大豆异黄酮,进而显著提高了黄浆水清除DPPH 自由基的能力。对α-半乳糖苷酶和β-葡萄糖苷酶进行了初步定位,结果表明两种酶均属于胞内酶,且主要为不可溶性蛋白酶,但是两种酶的确切位置及酶活特性还需进一步研究;另外,经过屎肠球菌R2 的发酵作用,所测的大豆异黄酮总量有所下降,因此,在发酵的过程中大豆苷元很可能继续转化为大豆异黄酮代谢终产物雌马酚,其具体的代谢机理仍需进一步探讨。

