枯草芽孢杆菌对土壤群落结构的影响
邱萌萌,吴玉斌,陆洪省
(山东科技大学安全与环境工程学院,山东青岛 266000)
芽孢杆菌是土壤和植物微生态区系的优势生物种群,具有很高的抗逆能力和抗菌防病作用。枯草芽孢杆菌是芽孢杆菌中性状优良的分离株,其生理特征多样,在自然界中广泛分布,极易分离培养。枯草芽孢杆菌不仅可以广泛存在于土壤、植物根际表面和其他外部环境中,而且可以存在于植物体内,是植物体内常见的内生细菌,尤其是在植物的根部、茎部。该菌不仅对人畜无毒无害,不污染环境,而且能产生多种抗菌素和酶,具有广谱抗菌活性和极强的抗逆能力。枯草芽孢杆菌可通过成功定殖至植物根际、体表或体内的方式,与病原菌竞争植物周围的营养,分泌抗菌物质以抑制病原菌生长,同时诱导植物防御系统抵御病原菌入侵,改变植物根际土壤中微生物群落结构,从而达到生防的目的,已成为一种理想的生防细菌[1-3]。
高通量测序技术是目前应用最广泛的新一代测序技术,与传统的琼脂培养基培养、Biolog 平板法、磷脂脂肪酸、PCR-DGGE 和RFLP 等分析方法相比,具有通量高、灵敏度高、准确性高和运行成本低等特点。高通量测序技术通过检测土壤微生物细胞内特定遗传物质(原核微生物16S rRNA、真核微生物18S rRNA)的碱基序列,可以更全面、准确地分析土壤中微生物群落的多样性,已广泛应用于土壤微生物群落的研究中[4-6]。本研究通过枯草芽孢杆菌与致病菌的对峙实验验证枯草芽孢杆菌的抑菌作用,通过高通量测序的方法探究枯草芽孢杆菌对土壤中微生物群落的影响。
1 材料与方法
1.1 实验材料
枯草芽孢杆菌可湿性粉剂(1 000 亿孢子/g)由河北冠龙农化有限公司提供;茄链格孢菌、灰葡萄孢菌为山东科技大学环境微生物实验室之前分离得到的菌株;土样由山东省安丘市万芳蔬菜种植大棚提供。
枯草芽孢杆菌液体培养基:20 g 葡萄糖、15 g 蛋白胨、5 g 氯化钠、0.5 g 牛肉膏、1 000 mL 水。固体培养基按20%的比例加入琼脂即可。
茄链格孢菌、灰葡萄孢菌培养基为PDA 培养基。
1.2 菌株的分离鉴定
取5 g 枯草芽孢杆菌可湿性粉剂于10 mL 无菌水中摇匀、溶解。利用无菌接种环蘸取枯草芽孢杆菌溶液在枯草芽孢杆菌固体培养基上划线接种,重复3 个。将接种完成的培养基于自然光、28 ℃环境下培养、观察。待培养基中长出菌落后,挑选与枯草芽孢杆菌颜色形态一致的菌落,委托青岛睿博兴科生物技术有限公司进行测序。
1.3 平板对峙实验
将实验室保存的茄链格孢菌、灰葡萄孢菌进行活化培养后,采用含毒介质法观察枯草芽孢杆菌对两种致病菌的抑制作用。
将分离得到的枯草芽孢杆菌接入液体培养基中培养3 d,5 000 r·min-1离心15 min,取上清液,用0.22 μm的无菌滤膜过滤得无菌滤液。PDA 固体培养基在无菌灭菌锅中灭菌,冷却至60 ℃时,分别按枯草芽孢杆菌无菌滤液与PDA 培养基体积比为1 ∶3 和1 ∶9 的比例制成含毒培养基,倒入提前灭菌好的培养皿中冷却,备用。
在不同比例的含毒培养基的中心处分别接入直径为9 mm 的茄链格孢菌、灰葡萄孢菌菌饼,以不加枯草芽孢杆菌无菌滤液的PDA 培养基为对照,每组重复3 次。在自然光、28 ℃条件下培养 d,观察枯草芽孢杆菌对病原菌的抑制作用,计算抑制率,见公式(1)。

1.4 高通量测序
取5 g 土样于50 mL 水中搅拌、溶解,静置6 h 取上清液得土壤浸出液。
分别取1 mL 土壤浸出液于两个100 mL 锥形瓶中,其中一个加入20 mL 枯草芽孢杆菌液体培养基,另一个加入20 mL 枯草芽孢杆菌液体培养基后再加入1 mL 枯草芽孢杆菌培养2 d 的培养液作为对照。培养7 d 后委托上海生工生物工程有限公司进行高通量测序,分析枯草芽孢杆菌对土壤真菌菌群群落结构和多样性的影响。
1.5 数据整理
利用Word 2010、Excel 2010 进行数据处理、制图、制表,利用MEGA5.1 进行系统树的构建。
2 结果与分析
2.1 菌株系统分类学鉴定
将测得的序列在NCBI 数据库中进行BLAST 同源性比对,与数据库中各菌株序列进行相似性分析,所测枯草芽孢杆菌菌株与Bacillus subtilisstrain BS-S3 菌株的一致性达99%。用MEGA5.1 软件对同源性较高的序列进行序列分析并使用Neighbor-Joining 法构建系统发育树,系统发育树如图1 所示。该序列和Bacillus subtilisstrain BS-S3菌株在同一分支,结合其生物学特性及形态学特征,确定该菌株为枯草芽孢杆菌,并命名为SKD-QM11。
2.2 抑菌作用
经过5 d 培养后发现,无论枯草芽孢杆菌和PDA 培养基的比例为1 ∶3 还是1 ∶9,对茄链格孢菌和灰葡萄孢菌的抑制作用都非常强,其抑制效果如图2、3 所示。采用十字交叉法对菌饼直径进行测量发现,菌饼大小无变化,由抑制率公式得,枯草芽孢杆菌对茄链格孢菌和灰葡萄孢菌的抑制率达到100%。

图1 基于16S rDNA 序列构建的SKD-QM11 系统发育树

图2 茄链格孢菌实验组与对照组培养5 d 生长情况

图3 灰葡萄孢菌实验组与对照组培养5 d 生长情况
2.3 对土壤真菌菌群的影响
由高通量测序结果得,加入枯草芽孢杆菌的土壤浸出液中OTU 数为147,仅加入液体培养基的土壤浸出液中OTU 数为20,说明加入枯草芽孢杆菌会丰富土壤中真菌菌群组成,使真菌种类增多。由表1 可得,在门水平上,加入枯草芽孢杆菌培养液与只加入培养基相比,真菌优势菌有所变化。只加入培养基的土壤浸出液中,变形菌门占了99.95%,几乎所有真菌都属于变形菌门;加入枯草芽孢杆菌的土壤浸出液中,变形菌门所占的比例为63.41%,较只加入培养基的土壤浸出液中变形菌门的比例小,但是莫氏菌门为20.09%,担子菌门比例也有所增加,球囊菌门的真菌由无到有,虽然所占比例较小,但增加了真菌种类,说明加入枯草芽孢杆菌会改变土壤浸出液中门水平的真菌组成。
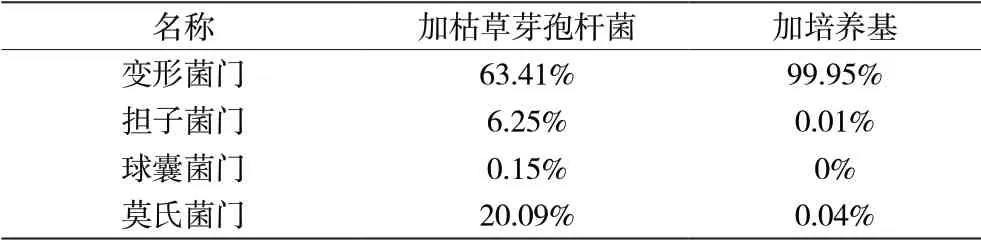
表1 门水平真菌的变化
3 结论
本实验分离出的枯草芽孢杆菌能够抑制茄链格孢菌和灰葡萄孢菌的菌丝生长,对其产生的抑制作用可达到100%。吴颖等人发现,枯草芽孢杆菌抑制茄链格孢菌菌丝和分生孢子的生长[7]。李永刚等报道,枯草芽孢杆菌BS2 的菌液成分及胞外蛋白能有效抑制灰葡萄孢菌的产孢、萌发和菌丝生长[8]。黄华毅等人发现,枯草芽孢杆菌菌液处理病原真菌后,其产生的抗菌物质主要通过溶解细胞壁或细胞膜造成原生质泄漏使菌丝断裂或畸形[9]。枯草芽孢杆菌对植物病原菌具有较强的抑制作用,具有较好的开发前景。
由高通量测序结果可得,枯草芽孢杆菌会改变土壤浸出液中真菌菌群的组成,丰富真菌类别。陈雪丽等利用DGGE-PCR 技术证明在盆栽条件下接种B.subtilis BRF-2 和Paenibacillus polymyxaBRF-1 对不同时期黄瓜和番茄根际土壤中真菌群落结构产生了一定的影响,特别是对番茄根际土壤真菌群落结构影响较大[10]。余贤美等人通过固体平板法和Biolog 法分析了具有良好定殖能力的B.subtilis Bs-15 对枣树根际土壤中微生物的影响,发现其会提高土壤微生物的整体活性以及土壤微生物种群和功能多样性[11]。在本研究中,针对真菌门分类水平,虽然优势菌种类未改变,但是所占比例有所改变,而且提高了其他种类真菌所占的比例,无论是土壤浸出液中的真菌种类还是真菌数量,均可被枯草芽孢杆菌明显改变。

