干旱胁迫对盆栽“川丹参1号”生理指标及主要活性成分含量的影响
邓婉月 冷秋彦 杨在君 余 燕 吴一超
(西华师范大学生命科学学院,637002,四川南充)
近年来,随着全球气候变化,干旱频发,已经成为严重影响农作物产量的农业气象灾害之一。干旱会抑制植物正常生长和光合作用[1-2],从而影响植物次生代谢产物积累和产量[3]。植物在进化过程中为了适应干旱等逆境,演化出了相应的适应机制,通过调节渗透调节物质和保护酶体系等,以抵御或耐受干旱环境的影响,这也是药用植物规范化种植领域研究的热点之一[4]。
丹参(Salvia miltiorrhiza Bge.)为唇形科鼠尾草属多年生草本植物,别名血参、赤参以及红根,是我国常用大宗中药材[5]。《中华人民共和国药典》(2015版)以丹参干燥的根及根茎入药,具活血祛瘀、通经止痛、清心除烦和凉血消痈之功效[6]。现代药理研究表明丹参在治疗心脑血管疾病[7]、抗癌[8-9]、抗炎[10-11]、抗氧化[8]和保肝[12-13]等方面都具有良好的效果。2010年,复方丹参滴丸成为我国第一例通过美国食品和药品监督管理局(FDA)Ⅱ期临床试验并进入FDAⅢ期临床研究的中成药[14]。“川丹参1号”(CDS-1)(川审药2011 002),是四川农业大学张利教授团队在四川省中江县栽培丹参混杂群体中通过近9年的系统选育而成的高产优质丹参品种,是第一个真正意义上经审定的川丹参品种。CDS-1具有出苗早、生育周期长、产量与上级率高、品质优良、区域适应性和抗逆性强等特点[15]。丹参主要活性成分为脂溶性的二萜醌类化合物(丹参酮类)和水溶性的酚酸类[16-17]。川丹参栽培区四川省中江县每年都会有较严重的春旱和伏旱发生,严重影响川丹参的正常生长及丹参药材的产量和质量,目前未见有关CDS-1抗旱能力和干旱适应性的研究。因此,开展CDS-1的抗旱能力研究,有利于在规范化种植中通过科学控水,保证CDS-1的产量和品质,也可以为其在川东北地区的进一步推广种植提供理论依据。
本研究以项目组具有自主知识产权的CDS-1为材料(由四川农业大学张利教授提供),利用不同浓度的PEG-6000溶液模拟干旱胁迫,研究CDS-1在不同程度干旱胁迫下的形态和生理指标变化规律,并采用HPLC法同时测定不同干旱处理下CDS-1主要活性成分含量的变化。探讨CDS-1抗旱能力及干旱对丹参药材品质的影响,以期为CDS-1的引种栽培及规范化种植中的田间水分管理提供科学依据。
1 材料与方法
1.1 试验设计
供试材料为项目组自主培育的CDS-1。于2018年1月,选择粗细均匀且无病虫害的CDS-1根条,剪成约5cm的小段种植于花盆中(每盆土壤的质量相等),置于实验室露台培养,待丹参长出6~8片叶时(2018年6月1日)开始用Hoagland营养液配制的不同浓度PEG-6000溶液模拟长期干旱胁迫(表1),胁迫处理持续至2019年1月丹参收获。设置4个模拟干旱处理组和1个对照组CK,每组5个重复。

表1 不同PEG-6000浓度模拟干旱胁迫处理Table 1 Different concentrations of PEG-6000 simulate drought stress treatments
1.2 试剂
试验所用标准品迷迭香酸、丹酚酸B、丹酚酸A、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA(纯度>98%,HPLC)购自成都曼思特生物科技有限公司;甲醇(HPLC级)和乙腈(HPLC级)购自美国Fisher Scientific公司;其他常用试剂均为分析纯,购自成都科隆化学品有限公司。
1.3 CDS-1生理指标的测定
于2018年10月中旬采摘经模拟干旱胁迫处理的CDS-1茎中部的叶片,测定不同处理样品的生理指标:采用乙醇-丙酮混合液浸泡法测定叶绿素含量[18];采用氯化硝基四氮唑蓝(NBT)光化还原法测定超氧化物歧化酶(SOD)活性,采用愈创木酚法测定过氧化物酶(POD)活性,采用紫外吸收法测定过氧化氢酶(CAT)活性,采用酸性茚三酮法测定脯氨酸(Pro)含量,以上均是在李合生等[19]的方法基础上进行适当修改;采用硫代巴比妥酸法测定丙二醛(MAD)含量[20];采用考马斯亮蓝G-250法测定可溶性蛋白含量,采用蒽酮比色法测定可溶性糖含量[21]。
1.4 CDS-1活性成分的测定
1.4.1 样品溶液的制备 于2019年1月采收各处理CDS-1的根,去除须根和泥土,阴干2d,40℃条件下烘干72h,粉碎过40目筛,于阴凉干燥处密封储存。称取干燥丹参粉约0.15g,置具塞锥形瓶中,加入80%甲醇50mL,密塞,称重,超声提取(140W,42kHz)30min,冷却后,用80%甲醇补足减失的重量,摇匀后过滤,量取续滤液5mL,移至10mL量瓶中,加80%甲醇定容至刻度,然后摇匀,过滤,取续滤液,即得样品溶液。
1.4.2 色谱条件 采用HPLC同时测定CDS-1中6种活性成分含量,色谱条件:色谱柱Agilent Eclipse XDB-C18(5μm,4.6×250mm),流速 1mg/mL,柱温40℃,流动相0.1%磷酸水(A)-乙腈(B),进样量10μL,检测波长270nm,具体洗脱程序:0~5min,20% B;5~15min,20%~25% B;15~25min,25%~61% B;25~40min,61%~90% B;后运行5min。
1.4.3 标准曲线的绘制 分别称取迷迭香酸、丹酚酸B、丹酚酸A、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA对照品,制得迷迭香酸0.0250mg/mL、丹酚酸B 0.1160mg/mL、丹酚酸A 0.0025mg/mL、隐丹参酮0.0050mg/mL、丹参酮Ⅰ 0.0050mg/mL和丹参酮ⅡA 0.0037mg/mL的混合对照品溶液。在上述色谱条件下,分别进样不同体积混合标准溶液进行测定,以浓度(X,mg/mL)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线(表2)。

表2 CDS-1中6种活性成分标准曲线Table 2 Standard curves of six active components of CDS-1
1.5 数据处理
所有试验处理完全随机,采用Microsoft Excel 2016和IBM SPSS Statistics 20进行数据处理和绘图。
2 结果与分析
2.1 模拟干旱胁迫对CDS-1植株形态的影响
从图1可以看出,模拟干旱条件下,CDS-1生长受到明显抑制。CDS-1株高随胁迫程度的增加显著降低,与对照相比,PEG-6000浓度为150和200g/L时株高降低30%~40%;茎分枝数明显减少,在PEG-6000浓度为200g/L时茎分枝数仅为2。在干旱胁迫下CDS-1叶色变浅,因此干旱胁迫严重影响了CDS-1地上部分的正常生长及根系的长度和分布。同时可以看出水分过高也不利于丹参根部的生长。

图1 不同浓度PEG-6000模拟干旱胁迫处理下CDS-1的形态Fig.1 Morphology of CDS-1 under PEG-6000 simulated drought stress with different concentrations
2.2 模拟干旱胁迫下CDS-1叶绿素含量变化
叶绿素是植物合成有机物的关键基础,是反映植物光合作用能力的重要指标之一,不同叶绿素的含量及比值对植物光合作用有很大影响[22]。表3结果表明,随着模拟干旱胁迫程度的增加,CDS-1叶片中叶绿素a和叶绿素b的含量均呈下降的趋势。PEG-6000溶液浓度由0增加到100g/L时,叶绿素a和叶绿素b含量显著降低,此后干旱胁迫程度进一步增加,叶绿素含量下降速度减缓,在整个胁迫处理范围内叶绿素a/b的值逐渐上升,可能是干旱胁迫使CDS-1叶片中的叶绿素a转化为叶绿素b的过程受阻,导致叶绿素b含量下降更为明显[22]。与CK相比,200g/L PEG-6000处理的CDS-1叶绿素a、叶绿素b和总叶绿素含量分别下降25.0%、40.8%和30.7%。

表3 不同浓度PEG-6000模拟干旱胁迫处理下CDS-1叶片的叶绿素含量Table 3 Chlorophyll content in leaves of CDS-1 under PEG-6000 simulated drought stress
2.3 模拟干旱胁迫下CDS-1叶片渗透调节物质含量变化
渗透调节物质(可溶性蛋白、可溶性糖和脯氨酸)对植物在逆境中维持细胞正常的渗透压及活性起着重要作用[23]。由图2可知,随着PEG-6000溶液浓度的增加,CDS-1叶片中可溶性蛋白、可溶性糖和脯氨酸含量整体呈上升趋势。在PEG-6000浓度为150g/L时可溶性蛋白含量达到最大值0.35mg/g,较CK增加约20%;可溶性糖含量在PEG浓度为200g/L时达最大值5.43mg/g;脯氨酸含 量在PEG浓度为200g/L时达到最大值72.21μg/g,比CK增加43.5%。

图2 PEG-6000模拟干旱胁迫对CDS-1叶片中可溶性蛋白、可溶性糖和脯氨酸含量的影响Fig.2 The soluble protein, soluble sugar and proline content in leaves of CDS-1 under PEG-6000 simulated drought stress
2.4 模拟干旱胁迫对CDS-1叶片MDA含量和保护酶活性的影响
MDA含量是体现植物细胞膜受损程度的重要指标,通过测定MDA含量可以评价不同程度干旱胁迫对CDS-1的损伤情况。由图3A可知,随着PEG-6000溶液浓度的增加,CDS-1叶片中MDA含量显著上升,PEG-6000浓度为200g/L时达到最大值1.87nmol/g,较CK增加了5.06倍,说明在重旱条件下CDS-1叶片细胞受到了最为严重的损伤。细胞膜的损伤是导致植物组织受到伤害的重要诱因,在干旱胁迫下,膜脂过氧化是引起植物细胞膜损伤的重要因素,在进化过程中,植物形成了一整套保护酶体系来应对干旱的损伤[23]。SOD、POD和CAT等是主要的活性氧(ROS)清除酶[24],通过测定这3种酶的活性,分析在PEG模拟干旱胁迫下CDS-1抗氧化酶体系的应急响应。图3B显示,随着PEG-6000溶液浓度的增加,CDS-1叶片中SOD活性先上升后下降,在100g/L PEG处理下达到峰值,此后,随着胁迫程度增加,SOD活性显著下降,在PEG浓度为200g/L时最低,仅为CK的48%。图3C显示CDS-1叶片中POD活性随PEG浓度增加显著上升,在PEG浓度为200g/L时达到最大值,为CK的167%。而CAT活性随着胁迫程度的增加呈下降趋势(图3D)。

图3 PEG-6000模拟干旱胁迫对CDS-1叶片中MDA含量,SOD、POD和CAT活性的影响Fig.3 MDA content, and the activities of SOD, POD and CAT in leaves of CDS-1 under PEG-6000 simulated drought stress
2.5 模拟干旱胁迫下CDS-1活性成分的积累
图4是不同处理下CDS-1的HPLC色谱图。从表4可以看出,不同干旱胁迫处理对CDS-1中酚酸类成分含量影响显著,处理液浓度为150g/L和200g/L时丹酚酸B含量略高于50和100g/L处理,与CK无显著性差异。迷迭香酸和丹酚酸A在50~150g/L PEG-6000处理后均有所上升,在150g/L时达最高(分别为8.03和0.93mg/g),分别是CK的145%和175%,而浓度200g/L时明显下降,其中丹酚酸A减少更为显著,甚至低于CK。模拟干旱胁迫对CDS-1丹参酮类成分含量有显著影响,总体趋势是随干旱胁程度增加先显著上升,后急剧下降再回升。50和100g/L处理时的隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA和总酮含量有显著增加,其中除丹参酮Ⅰ,50g/L处理的各丹参酮类成分含量均最高(分别为0.09、0.32和0.64mg/g),与CK相比增幅都在60%以上,但在150g/L处理时丹参酮类成分含量显著降低。迷迭香酸、丹酚酸A和丹酚酸B等酚酸类成分具有很强的抗氧化活性[16],能清除植物内的自由基,抑制脂质过氧化反应,所以其含量在环境干旱程度较低时表现为增加,使植株对不良干旱环境有一定的抵抗能力。在轻度干旱胁迫环境下,CDS-1的酚酸类成分和丹参酮类成分含量显著增加,说明一定程度的干旱胁迫有利于CDS-1活性成分的积累。
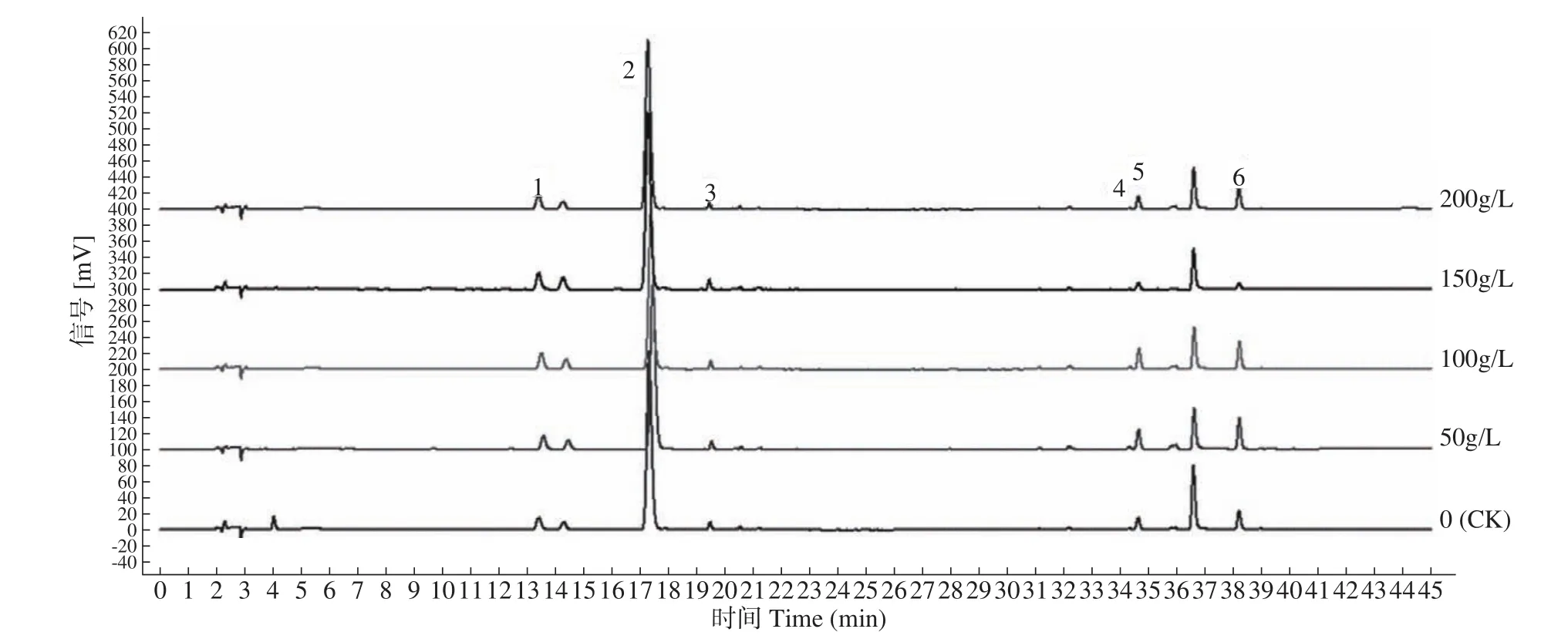
图4 PEG-6000模拟干旱胁迫下CDS-1中6种活性成分HPLC色谱图Fig. 4 The HPLC chromatography of six active components for CDS-1 under PEG-6000 simulated drought stress

表4 不同浓度PEG-6000溶液模拟干旱胁迫处理下CDS-1中6种活性成分含量Table 4 The contents of six active components of CDS-1 under PEG-6000 simulated drought stress mg/g
3 讨论
诸多研究表明,干旱会使植物缺水而导致植物叶片枯萎、脱落,叶绿素减少和光合能力下降[25],以及一系列生理指标的变化[26]。长期干旱胁迫会严重抑制植物生长和次生代谢产物的积累,严重时会导致植物死亡。
本研究采用PEG-6000模拟干旱胁迫,分析了持续性干旱胁迫对CDS-1生长、生理指标及主要活性成分积累的影响。干旱胁迫下CDS-1叶片叶绿素a和叶绿素b含量均随干旱程度增加显著降低,说明干旱胁迫抑制叶绿素合成并加速其分解,导致其含量急剧下降,显著降低了CDS-1叶片捕获和转化光能的能力,且抑制程度随干旱程度增加而增加。光合色素在植物光合作用中直接参与光能的吸收、传递和引起原初光反应,其含量的高低直接决定植物光合作用强弱[27-28],从而影响植物地上部分的正常生长。当遇到干旱时,植物可通过积累大量渗透调节物质来提高细胞的渗透调节能力,维持植株的生长[29]。干旱胁迫下,CDS-1的渗透调节物质含量总体都显著高于CK,在CDS-1对干旱环境的适应中起着重要作用。
随着干旱胁迫程度增加CDS-1叶片中MDA含量上升,与左小容等[30]研究的商洛丹参幼苗受干旱影响结果类似,这可能是由于干旱胁迫下保护酶(SOD和CAT)活性减弱,ROS不断积累,引起膜脂质过氧化增强,膜透性增大,MDA不断积累。植物体内ROS的积累会促进抗氧化酶系统(SOD、POD和CAT等)活性增强,已有研究表明,在不同干旱胁迫程度下,植物叶片中抗氧化酶活性均有不同程度升高[26,31]。干旱胁迫中,CDS-1叶片SOD活性增强,清除自由基的能力提高,减少了细胞内ROS的积累,降低了因过氧化作用引起的质膜伤害,当干旱胁迫程度较大,自由基产生与清除平衡失调,导致SOD活性降低,对ROS自由基的清除能力也大大减弱,POD活性增强,清除CDS-1叶片水解氧化酶催化的氧化还原反应中产生的细胞毒性物质H2O2的能力提高,防止ROS的大量积累对叶片组织的伤害,从而对细胞起保护作用[32];CAT可以协助SOD清除自由基产生的高浓度H2O2,二者结合起来可将有害的氧自由基和H2O2转化成H2O和O2,以此来抵抗其对细胞的伤害,保护细胞膜的结构[33]。CDS-1叶片中CAT活性随干旱胁迫程度增加呈下降的趋势,表明叶片清除自由基的能力逐渐减弱,因此干旱程度越高CDS-1受到的伤害越严重。
许多研究表明干旱胁迫可以增加植物次生代谢产物的生成和积累,Shi等[34]对丹参毛状根研究结果也显示,渗透胁迫降低根的干重,增加总丹参酮含量。这与水分胁迫增加了丹参根的数量,降低了丹参根的产量,而酚酸类成分主要分布于根内部,丹参酮主要分布在根的表面有关[35]。本研究通过模拟长期干旱胁迫,表明中度干旱胁迫增加了CDS-1根中酚酸类成分含量(丹酚酸B除外),轻度干旱胁迫显著增加了丹参酮类成分在CDS-1根中的含量。丹酚酸类活性成分迷迭香酸、丹酚酸B和丹酚酸A等具有很强的抗氧化作用[36-37],能清除植物内的自由基,抑制脂质过氧化反应,而隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA等成分具有防病抗菌作用[38]。干旱胁迫下CDS-1酚酸类和丹参酮类物质的增加,表明轻度的干旱胁迫可以提高CDS-1酚酸类和丹参酮类主要活性成分的积累,而干旱胁迫下CDS-1的抗氧化性与其次生代谢产物的关系还有待进一步研究。项目组还在进一步开展后续的田间控水对CDS-1品质和产量影响的研究,以期获得精确的田间控水数据,从而在生产中实现CDS-1的控水提质。
4 结论
在50~200g/L的PEG-6000溶液模拟干旱胁迫处理下,CDS-1形态结构、生理生化和活性成分均表现出适应性变化,表明CDS-1具有一定的抗旱能力。轻到中度干旱胁迫(PEG-6000浓度为50~100g/L)有利于CDS-1活性成分的积累,特别是丹参酮类成分较对照组的增幅超60%。因此,在CDS-1规范化种植中可以通过控制田间含水量来提高丹参药材的品质。

