苦荞全基因组SSR位点特征分析与分子标记开发
马名川 刘龙龙 刘 璋 周建萍 南成虎 张丽君
(山西农业大学农业基因资源研究中心/农业农村部黄土高原作物基因资源与种质创制重点实验室/杂粮种质资源发掘与遗传改良山西省重点实验室,030031,山西太原)
苦荞(Fagopyrum tartaricum L. Gertn)属蓼科(Polygonaceae)荞麦属(Fagopyrum Mill),起源于我国,主要分布在我国西南地区和高海拔地区[1]。苦荞具有生育期短、抗逆性强、耐旱和耐瘠薄等特性,可作为应对干旱形势的备荒作物[2]。苦荞营养全面,尤其富含一般作物没有的芦丁和槲皮素等黄酮类物质,具有降糖降脂和抗氧化等功效,使其成为集营养、保健和治疗于一体的“食药兼用”的珍品[3]。
简单重复序列(simple sequence repeats,SSR)也称微卫星DNA(microsatellites DNA),是一类由1~6个核苷酸为单位在基因组中多次串联重复的DNA序列[4]。SSR分子标记数量丰富、多态性高、共显性,并且具有成本低和操作简便等优点,在植物遗传多样性分析、遗传图谱构建、基因定位与克隆等方面得到广泛应用,是目前最常用的分子标记技术之一[5]。
与水稻、小麦、玉米和大豆等主要作物相比,荞麦分子标记方面的研究起步较晚。从利用AFLP[6-8]、RAPD[9-12]和SRAP[13]等第一代分子标记进行荞麦的分子遗传分析,到开始利用SSR分子标记分析荞麦遗传多样性、构建核心种质和绘制连锁图谱,荞麦的分子标记研究已经取得了一些进展。Iwata等[6]开发的5对SSR标记在日本甜荞中具有较高的多态性。Konishi等[14]用开发的54对SSR引物对甜荞居群的遗传变异进行检测。Ma等[15]开发了136对SSR引物,其中10对效应显著,41对可有效鉴别栽培荞麦和野生荞麦的亲缘关系;Li等[16]创新了SSR引物设计方法,开发了4对苦荞SSR引物,效果良好;高帆等[17]构建了我国苦荞的SSR标记体系;韩瑞霞等[18]在苦荞中开发了28对多态性较好的引物;石桃雄等[19]基于甜荞的转录组序列开发SSR标记,筛选到12对多态性引物;黎瑞源等[20]基于苦荞转录组序列设计合成了150对引物,其中30对具有多态性;杜晓磊等[21]构建了首张苦荞SSR遗传连锁图谱;黎瑞源等[22]利用SSR标记,构建了首次以苦荞RIL为作图群体的遗传图谱;莫日更朝格图等[23]、田晓庆等[24]、杨学文等[25]和徐笑宇等[26]利用SSR标记对不同地区的荞麦资源进行了遗传多样性分析。然而,由于适用性不够普遍,功能性不显著,目前适用于荞麦遗传分析的SSR引物数量仍然有限,难以满足荞麦遗传多样性分析和遗传图谱构建等研究需要。2017年苦荞全基因组序列的发表[27]为全面搜索SSR位点和批量开发SSR引物提供了条件。本研究以苦荞全基因组序列为基础,对苦荞基因组SSR序列特征进行了分析,批量开发了SSR引物,并对开发的部分引物进行了多态性筛选,为进一步开展荞麦遗传多样性分析、遗传图谱构建和品种鉴定等研究奠定了基础。
1 材料与方法
1.1 试验材料
选取来源地不同并且表型差异大的5份苦荞资源和3份甜荞资源(表1)作为SSR引物的多态性鉴定。试验材料均由山西省农业科学院农作物品种资源研究所提供。

表1 供试材料信息Table 1 List of accessions used in accessing SSR level in the tartary buckwheat
1.2 试验方法
1.2.1 DNA提取 2018年2月,在山西省农业科学院大吴温室种植8份材料,每份材料种植2行,行长2m,苗期每份材料采集鲜嫩叶片2g,利用高通量粉碎机粉碎,采用DNA提取试剂盒(Ezup柱式植物基因组DNA抽提试剂盒,B518261-0050)提取叶片DNA,在酶标仪上测定DNA质量及浓度,并将DNA稀释至终浓度30ng/μL,置于–20℃保存。
1.2.2 SSR开发 根据已发表的苦荞基因组序列数据,采用MISA1.0对苦荞基因组序列进行SSR序列识别,其中1、2、3、4、5、6个碱基的重复次数最低分别为12、6、5、5、4、4,2个SSR之间距离小于100bp则合并为1个复合型SSR位点。
1.2.3 SSR引物的设计与筛选 利用Primer 3.0模块进行SSR引物批量设计。对8份材料DNA和设计的SSR引物进行PCR扩增,验证引物的多态性。PCR 反应体系 10μL,包括 1.5μL(30ng/μL)基因组DNA,5μL 2×TaqPCRMasterMix[天根生化科技(北京)有限公司,KT:121221],2μL(0.002nmol/μL)的正反引物和1.5μL ddH2O。PCR扩增反应程序:95℃预变性 5min;95℃变性 30s,52℃退火 45s,72℃延伸45s,35个循环;最后72℃延伸10min。反应结束后产物中加入2μL缓冲液并离心,以100~600bp DNA分子量为标准,采用6%~8%的非变性聚丙烯酰胺进行凝胶电泳,电泳缓冲液为0.5×TBE,200~300V电压电泳2~3h,至扩增片段电泳到凝胶中部为止。电泳结束后采用银染法染色,最终将凝胶置于成像仪上成像并标记拍照。
2 结果与分析
2.1 苦荞基因组SSR位点搜索及其组成分析
共检测序列34 554条,序列总长度34 996 377bp,共检测到SSR位点1 640个,频率为4.75%,包含SSR位点的序列1 196条,占总序列数的3.46%,包含2个及以上SSR位点的序列142条,占总序列数的0.41%,复合型SSR 371个,平均每21 339bp出现1个SSR位点。从表2可以看出,苦荞基因组SSR类型以重复5次的序列出现频率最高,有704个,占比42.93%,其次为重复6次的序列,有360个,占比21.95%。从重复类型来看,单核苷酸重复型SSR 54个,二核苷酸重复型400个,三核苷酸重复型1 038个,四核苷酸重复型77个,五核苷酸重复型2个,六核苷酸重复型69个,其中三核苷酸重复型最多,占比63.29%,其次为二核苷酸重复型,占比24.39%。

表2 苦荞全基因组SSR的重复类型、数量与分布频率Table 2 Repeat type, number and frequency of SSRs in tartary buckwheat
从表3可以看出,苦荞基因组SSR核苷酸基序的重复类型共有72种,其中单核苷酸重复类型2种,二核苷酸3种,三核苷酸10种,四核苷酸7种,五核苷酸2种,六核苷酸48种,以六核苷酸基序的重复类型最多。对单元的碱基组合进行统计,出现频率最高的二核苷酸重复型SSR是AT/TA,有310个,占二核苷酸重复基序总数的77.50%,占总SSR的18.90%;三核苷酸重复型SSR以AAG/CTT最多,有277个,占三核苷酸重复基序总数的21.87%,占总SSR的16.89%;此外,单核苷酸重复型SSR为A/T和C/G,占总SSR的3.29%;四核苷酸重复型SSR以ACAT/ATGT为主,有65个,占四核苷酸重复基序总数的84.41%;五核苷酸重复型SSR为ACAAA和TGGGC,分别仅有1个;六核苷酸重复型SSR以ACATAT/ATATGT最多,有8个,占总数的11.59%。

表3 苦荞全基因组SSR基序中不同重复基序出现的频率Table 3 Occurrence frequency of different microsatellites motifs of tartary buckwheat
2.2 苦荞基因组微卫星长度分析及变异
苦荞基因组SSR序列长度变化范围为12~476bp,平均长度23.14bp(图1)。长度为15bp的SSR序列所占比例最大,为40.73%,其次是长度为18bp的SSR序列,占比16.10%,第三是长度为12bp的SSR序列,占比7.56%(图1)。重复序列长度在12~19bp的占比71.71%,长度≥20bp占比28.29%。

图1 苦荞基因组不同长度SSR的出现频率Fig.1 Frequency of SSRs with different length in tartary buckwheat genome
图2显示,除五核苷酸重复型SSR外,不同长度重复单元的SSR序列长度均呈现随着重复次数的增多,SSR丰度降低的趋势。单核苷酸重复型SSR序列的长度变化范围12~92bp,平均长度为18.22bp,(A/T)n序列的平均长度18.74bp略大于(C/G)n序列平均长度16.18bp;二核苷酸重复型SSR序列的长度变化范围最大,为12~476bp,平均长度为35.15bp,其中以(AT/TA)n序列的平均长度最大,为38.67bp,(AG/CT)n序列的平均长度最小,为13.38bp;三核苷酸重复型SSR序列的长度变化范围15~66bp,平均长度为17.84bp,其中(ACC/GGT)n序列的平均长度最大,为21.72bp,(CCG/CGG)n序列的平均长度最小,为16.14bp。

图2 不同长度重复单元SSR序列长度变异情况Fig.2 Variation in sequence length of different repeat types of SSR
2.3 苦荞基因组SSR引物的有效性检测
利用Primer 3.0模块进行SSR引物批量设计,共设计479对引物,经检测有386对引物可扩增出目的条带,有效比例为80.58%。利用来源地不同表型差异大的5份苦荞资源和3份甜荞资源对其中的200对引物进行多态性检测,有56对SSR引物扩增出了清晰的多态性条带,其中17对在苦荞资源具有多态性,48对在甜荞资源中具有多态性,9对引物同时在苦荞资源和甜荞资源中具有多态性(表4,图3)。

图3 引物34和39在5份苦荞材料和3份甜荞材料中的多态性Fig.3 Polymorphisms of primer 34 and primer 39 in five tartary buckwheat germplasms and three common buckwheat germplasms
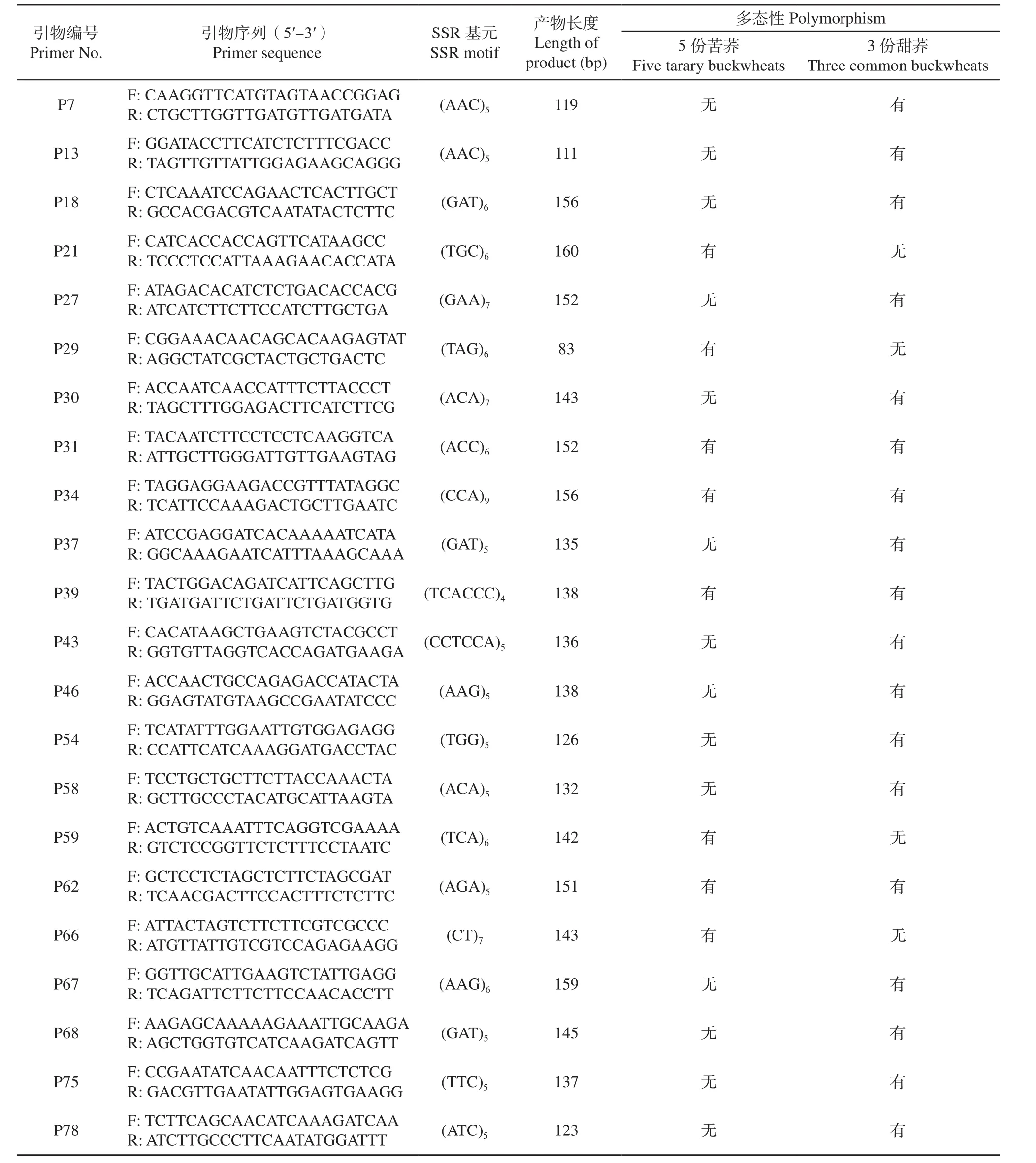
表4 56对SSR引物在8份荞麦材料中扩增产物的多态性分析Table 4 Polymorphic analysis for PCR amplicons of 56 SSR primer pairs in eight buckwheat genotypes

续表4 Table 4 (continued)
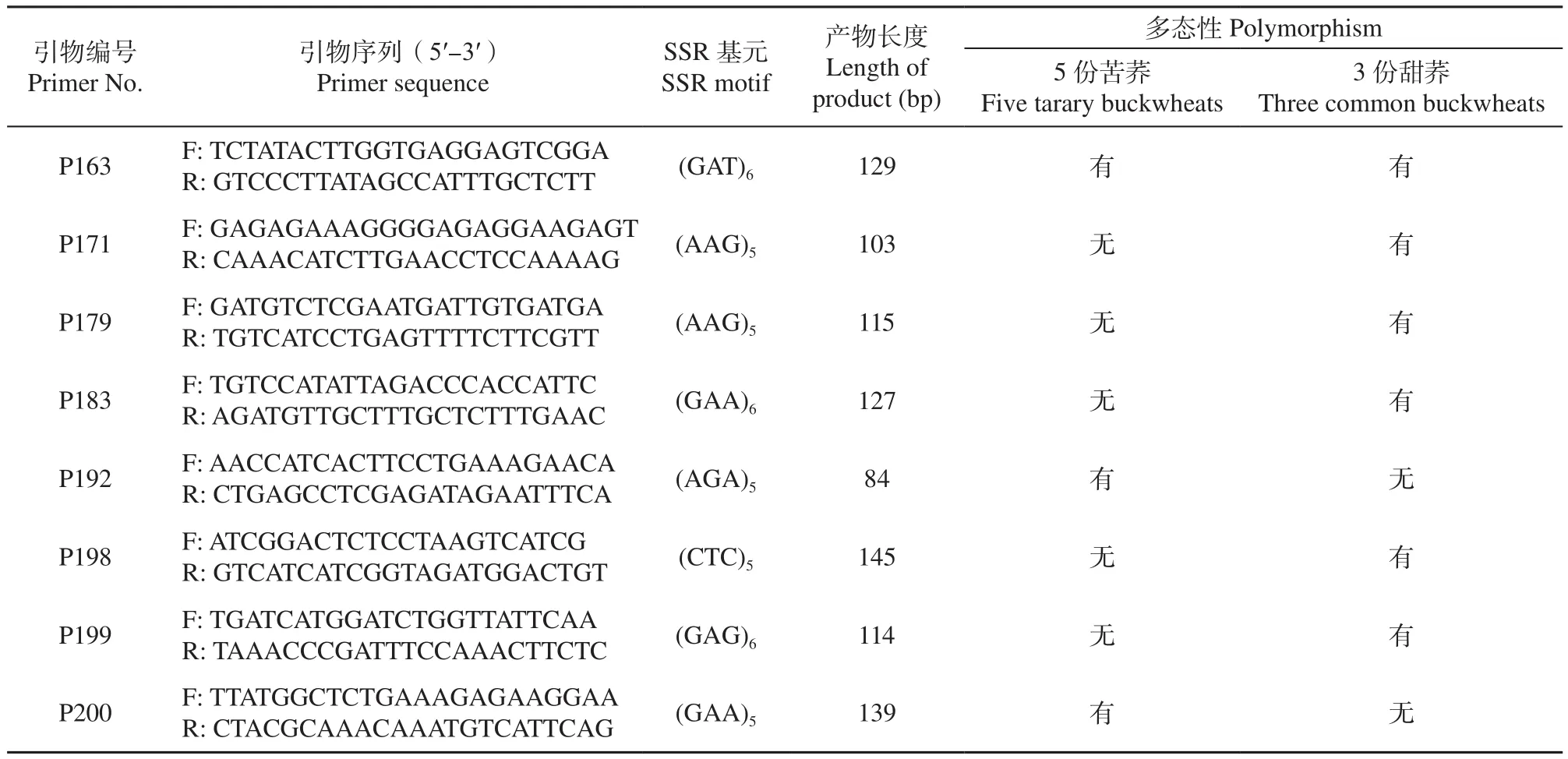
续表4 Table 4 (continued)
3 讨论
3.1 苦荞全基因组SSR的分布特征
本研究应用苦荞全基因组数据检测SSR位点,共检测序列34 554条,共检测到SSR位点1 640个,包含SSR位点的序列1 196条,SSR位点发生频率3.46%,平均每21.3kb出现1个SSR位点,低于苦荞EST-SSR位点的平均1.73kb出现1个SSR位点[20],这可能与数据量大小、转录组Unigene序列数量和长度以及设定的SSR搜索标准等因素相关[28],苦荞EST-SSR对单核苷酸重复位点筛选的标准设定在10次及以上,使得其筛选到的单核苷酸重复类型数量最多,有1 407个,占总数的52.11%,而本研究将该标准设定的重复次数为12次及以上,得到的单核苷酸重复数仅有54个,占总数的3.29%。
苦荞基因组上SSR种类较为丰富,1~6核苷酸均有分布,但数量上差异较大。从SSR重复碱基类型上看,苦荞的三核苷酸重复型(63.29%)和二核苷酸重复型(24.39%)最多,这与水稻[29]、玉米[30]和棉花[31]的结果一致,表明苦荞进化水平相对较高。从SSR重复基序结构上看,二核苷酸重复型SSR以(AT/TA)n为主,这与苦荞转录组EST-SSR[21]和普通荞麦转录组EST-SSR分析结果一致[19],也与花生[32]和烟草[33]基因组SSR研究结果相同,与水稻[29]、玉米[30]、大豆[34]和小麦[35]中以AT/GC出现的频数最高有所不同;三核苷酸重复型SSR以(AAG/CTT)n为主,这与双子叶植物中以AAG/CTT三核苷酸主要重复类型的研究结果相同,也与苦荞EST-SSR[20]、普通荞麦EST-SSR[22]和拟南芥基因组的研究结果相同,与水稻[29]和玉米[30]等的研究结果不同。不同物种重复基序主导类型的差异可能与物种基因组或转录组序列的特异性以及EST数据来源和数量等有关。
多态性是评价SSR分子标记可用性的重要指标,低级SSR重复基序往往呈现较高的多态性,当SSR长度≥20bp时多态性较高,长度在12~20bp之间的SSR多态性中等[36-38]。苦荞中单、二和三核苷酸重复序列占90.97%,SSR序列长度变化范围为12~476bp,平均长度23.14bp,长度均在12bp以上,其中长度≥20bp的共464条,占28.29%,这些SSR位点变异较大,多态性较丰富,有利于SSR引物的开发。
3.2 SSR引物多态性
本研究用5份苦荞和3份甜荞对200对合成SSR引物进行了多态性分析,共有56对引物表现出多态性,占比28%,比苦荞EST-SSR[20]多态性引物比例32.97%稍低,比韩瑞霞等[18](10.8%)、Ma等[15](7.4%)和Konishi等[14](26.7%)得到的苦荞和甜荞多态性引物比例高。本研究开发的SSR引物,在苦荞资源中的多态性比例低于甜荞的多态性比例,这可能与供试材料的数量和材料本身之间的差异性有关,一方面是由于选择的苦荞材料数量较少,只涵盖了部分苦荞代表性状,另一方面甜荞资源TQ2为普通栽培甜荞与野生等花柱甜荞经过杂交和回交的方式得到的自交可育甜荞新类型品种,这使得该材料表现出较高的多态性。后期可选择包含更多的不同类型资源的核心种质进行多态性SSR引物的进一步筛选。
有研究表明,SSR引物在植物种属间具有极高的通用性[39-40],甜荞和苦荞是荞麦属的2个栽培种,前人得到的荞麦SSR引物在荞麦的近缘种中也表现出不同程度的通用性[6,14-15],本研究结果表明基于苦荞全基因组SSR位点开发的部分引物在甜荞中也适用,可同时用于两者的相关遗传分析。
4 结论
本研究根据苦荞全基因组测序数据,对1~6核苷酸重复的SSR位点进行了查找和序列特征分析。结果显示,苦荞基因组SSR序列长度变化范围为12~476bp,平均长度23.14bp,以三核苷酸重复型SSR最多,五核苷酸重复型最少。出现频率较高的重复基序为AT/TA、AAG/CTT、ACC/GGT和ATC/GAT。根据不同类型SSR位点设计合成引物并对其进行了有效性和多态性检测,有56对引物具有多态性,其中9对同时在苦荞种质和甜荞种质中产生多态性条带。开发的SSR分子标记可用于荞麦遗传多样性分析、连锁图谱构建和品种鉴定等研究。

