基于GRP78-ATF6-CHOP通路研究雷公藤多苷对坏死性小肠结肠炎新生大鼠的影响*
高鹏,周凤蕊,刘俊华,周川
1.郑州市第六人民医院,河南 郑州450015;2.郑州大学第二附属医院,河南 郑州450000
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是临床常见的新生儿急重症,尤其是早产儿、低体质量儿发病率更高,已成为导致新生儿死亡的重要疾病之一[1-3]。NEC以小肠、结肠弥漫性或局部坏死为典型特征,至今尚无有效的治疗手段,探讨其发病机制,寻找有效干预手段对改善NEC预后有重要临床意义。研究表明,除肠道菌群紊乱外,肠道促炎及抗炎因子失衡与NEC发生、发展关系密切[4-5]。随着对中医药研究的深入,发现中药在抗炎、调节机体免疫方面发挥着重要作用。雷公藤是临床常用的活血化瘀、解毒消肿药物,其主要活性成分雷公藤多苷已被证实具有抗炎和免疫调节作用[6-8]。雷公藤多苷常用于治疗溃疡性结肠炎、类风湿性关节炎等炎症性疾病[9-10],但其对NEC的研究较少。本研究应用新生大鼠人工喂养联合缺氧冷刺激的方法建立NEC模型,观察不同剂量的雷公藤多苷对其肠道菌群的影响,并探讨具体的调控机制,为临床新生儿NEC的治疗提供依据。
1 材料
1.1 动物SPF级SD新生大鼠55只,雌雄不限,1~2日龄,体质量5~10 g,由郑州大学实验动物中心提供,许可证号:SCXK(豫)2018-0001。饲养于12 h/12 h明暗交替,24~26℃,相对湿度(55±1)%条件下。实验操作符合动物伦理学,伦理号:2019005703127。
1.2 药物及试剂雷公藤多苷片(江苏美通制药有限公司,批号:20190320);雅培婴儿配方奶粉、雅培蛋白粉(美国雅培公司,批号分别为:57713T26、61485C15);脂肪乳(德国费森尤斯卡比华瑞制药有限公司,批号:20203927);白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)酶联免疫吸附(ELISA)试剂盒(美国R&D公司,批号分别为:VAL601、M600B、ML-Elisa-1421);BCA蛋白定量分析试剂盒(美国Thermo公司,批号:23209);兔抗大鼠葡萄糖调节蛋白78(GRP78)单抗、兔抗大鼠激活转录因子6(ATF6)多抗、兔抗大鼠增强子结合蛋白同源蛋白(CHOP)单抗(美国Abcam公司,批号分别为:ab21685、ab203119、ab194533);山羊抗兔GRP78、ATF6、CHOP单抗(美国Abcam公司,批号分别为ab227865、ab37149、ab265760)。
1.3 仪器SM2235型徕卡切片机(德国徕卡显微系统贸易有限公司),3550UV型酶标仪、Powerpac Universal通用型电泳仪(美国Bio-rad公司)。
2 方法
2.1 NEC模型建立取55只新生大鼠,出生48 h后与母鼠分离,放置保育箱中,给予配方奶(雅培婴儿配方奶粉4.741 g+雅培蛋白粉9.5 g+200 g·L-1的脂肪乳48.8 mL,双蒸水补充至100 mL)喂养。首次给予0.2 mL,每3 h给予1次,随后每24 h增加0.1 mL,连续喂养3 d。随机选取45只新生大鼠每天早晚人工喂养后给予缺氧+冷刺激[11]:新生鼠放入自制缺氧箱,控制N2流量为15 L·min-1,测氧仪显示O2浓度为0时开始计时,维持90 s后关闭输N2阀门,立即取出新生鼠,放置于4℃冰箱中,持续10 min,连续3 d,每天2次。以排黄绿色黏液稀便、体质量减轻为造模成功标志。10只新生大鼠仅母鼠分离、人工喂养,不作缺氧+冷刺激。
2.2 动物分组及干预取造模成功大鼠38只,采用体质量排序法随机分为4组,分为模型组9只、雷公藤多苷低剂量组9只、雷公藤多苷中剂量组10只,雷公藤多苷高剂量组10只;另10只仅母鼠分离、人工喂养的新生大鼠,设为对照组。造模结束次日,给予雷公藤多苷低剂量组、中、高剂量组新生大鼠分别灌胃9 mg·kg-1、18 mg·kg-1、27 mg·kg-1的雷公藤多苷片混悬液(灌胃前用生理盐水配制为0.1 mL的混悬液),其中雷公藤多苷剂量是按照人与大鼠体表面积换算的等效剂量[12],对照组和模型组灌胃0.1 mL的生理盐水,每天1次,连续7 d。
2.3 标本采集末次灌胃结束后禁食12 h期间留取各组粪便样本1 g进行细菌学检查;禁食12 h后,脱颈法处死各组新生大鼠,立即剖腹取回盲部近端肠管约2 cm,PBS冲洗干净后随机分为两部分,一部分置于4%的中性甲醛中固定备用,另一部分储存于液氮中保存备用。
2.4 肠道组织病理学检查取固定于4%的中性甲醛中的肠道组织,常规石蜡包埋,制作厚度为4μm的连续切片,取切片进行脱蜡、水化步骤,进行苏木精-伊红(hematoxylin eosin,HE)染色。于光学显微镜下观察病理改变,并采用双盲法进行肠组织损伤评分[11]:肠绒毛膜及组织结构正常,记0分;黏膜下和(或)固有层轻度分离,记1分;黏膜下和(或)固有层中度分离,黏膜下和(或)固有层水肿,记2分;黏膜下和(或)固有层重度分离,黏膜下和(或)固有层水肿,局部肠绒毛膜脱落,记3分;肠绒毛膜完全脱落且伴肠坏死,记4分。每张切片随机取3个视野评分,取平均值。
2.5 肠道菌群分析取各组粪便样本,稀释液1∶10进行稀释,在无菌玻璃片上均匀涂布1 cm×1 cm区域,自然晾干后,在酒精灯上烤片固定,进行常规革兰氏染色[13],于光学显微镜下(10×100倍)对细菌总数、革兰氏阳性(G+)杆菌、革兰氏阴性(G-)杆菌、G+球菌、G-球菌进行计数,每张切片随机取3个视野计数,取平均值。
2.6 检测肠组织中IL-1β、IL-6、TNF-α水平取储存于液氮中的肠组织50 mg,加入1 mL的磷酸盐缓冲液(PBS,pH 6.0),剪碎后进行超声匀浆,4℃离心半径12 cm,2 500 r·min-1离心15 min,取组织上清液,采用ELISA检测肠组织中IL-1β、IL-6、TNF-α水平,按照说明书步骤进行操作,于酶标仪上检测待测样本光密度值,并根据标准曲线计算待测样本浓度。
2.7 GRP78、ATF6、CHOP蛋白相对表达量的检测取储存于液氮中的肠组织50 mg,液氮中研磨,转移至离心管,加入1 mL的组织裂解液,冰上孵育30 min,4℃预冷离心机12 000 r·min-1离心15 min,取上清液,采用BCA法测定总蛋白量。取50μg样本进行SDS-PAGE,电泳分离后,将条带转移至硝酸纤维素膜上,封闭液室温封闭2 h,均加入1∶500稀释的一抗,4℃孵育过夜,TBST洗膜3次,每次10 min,加入1∶2 000稀释的二抗,室温孵育2 h,暗室中显色。应用凝胶成像系统扫描,ImageJ软件分析各条带灰度值,计算GRP78、ATF6、CHOP条带灰度值与内参GAPDH灰度值的比值。
2.8 统计学方法采用SPSS 20.0统计软件分析数据,计量资料均以均数±标准差(±s)表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用SNK-q检验。以P<0.05为差异有统计学意义。
3 结果
3.1 新生大鼠一般情况对照组新生大鼠进奶量、排便、活动情况等均正常,试验期间无死亡;模型组新生大鼠出现进奶量减少、消瘦、懒动、反应迟钝、腹胀、腹泻、排黄绿色黏液稀便等情况;雷公藤多苷各剂量组上述情况均有所改善,且雷公藤多苷高剂量组改善最为明显。
3.2 肠组织病理学观察及组织损伤评分比较对照组大鼠肠黏膜上皮连续、完整,结构正常;模型组绒毛水肿、脱落、结构消失,固有层及黏膜下层大量炎性细胞浸润;雷公藤多苷各剂量组绒毛水肿、脱落现象减轻,结构趋于正常,炎性细胞浸润量减少,雷公藤多苷高剂量组上述病变最轻,但仍有少量炎性细胞浸润。对照组、模型组和雷公藤多苷低、中、高剂量组肠组织损伤评分分别为(0.41±0.08)分、(3.20±0.62)分、(2.51±0.42)分、(2.15±0.34)分、(1.67±0.21)分,与对照组比较,模型组肠组织损伤评分均升高(t=14.145,P<0.001);与模型组比较,雷公藤多苷低、中及高剂量组肠组织损伤评分均降低(t=2.764、5.087、7.368,P=0.014、<0.001、<0.001);与雷公藤多苷低剂量组比较,雷公藤多苷中、高剂量组肠组织损伤评分均降低(t=2.636、5.606,P=0.017、<0.001),且雷公藤多苷高剂量组低于中剂量组(t=3.007,P=0.008)。见图1。
3.3 肠杆菌总数、肠球菌总数及杆/球菌比值比较与对照组比较,模型组肠杆菌总数、杆/球菌比值降低,肠球菌总数明显升高(P<0.05);与模型组比较,雷公藤多苷低、中、高剂量组肠杆菌总数、杆/球菌比值升高,肠球菌总数明显降低(P<0.05);与雷公藤多苷低剂量组比较,雷公藤多苷中、高剂量组肠杆菌总数、杆/球菌比值升高,肠球菌总数明显降低(P<0.05);与雷公藤多苷中剂量组比较,雷公藤多苷高剂量组肠杆菌总数、杆/球菌比值升高,肠球菌总数降低(P<0.05)。见表1。
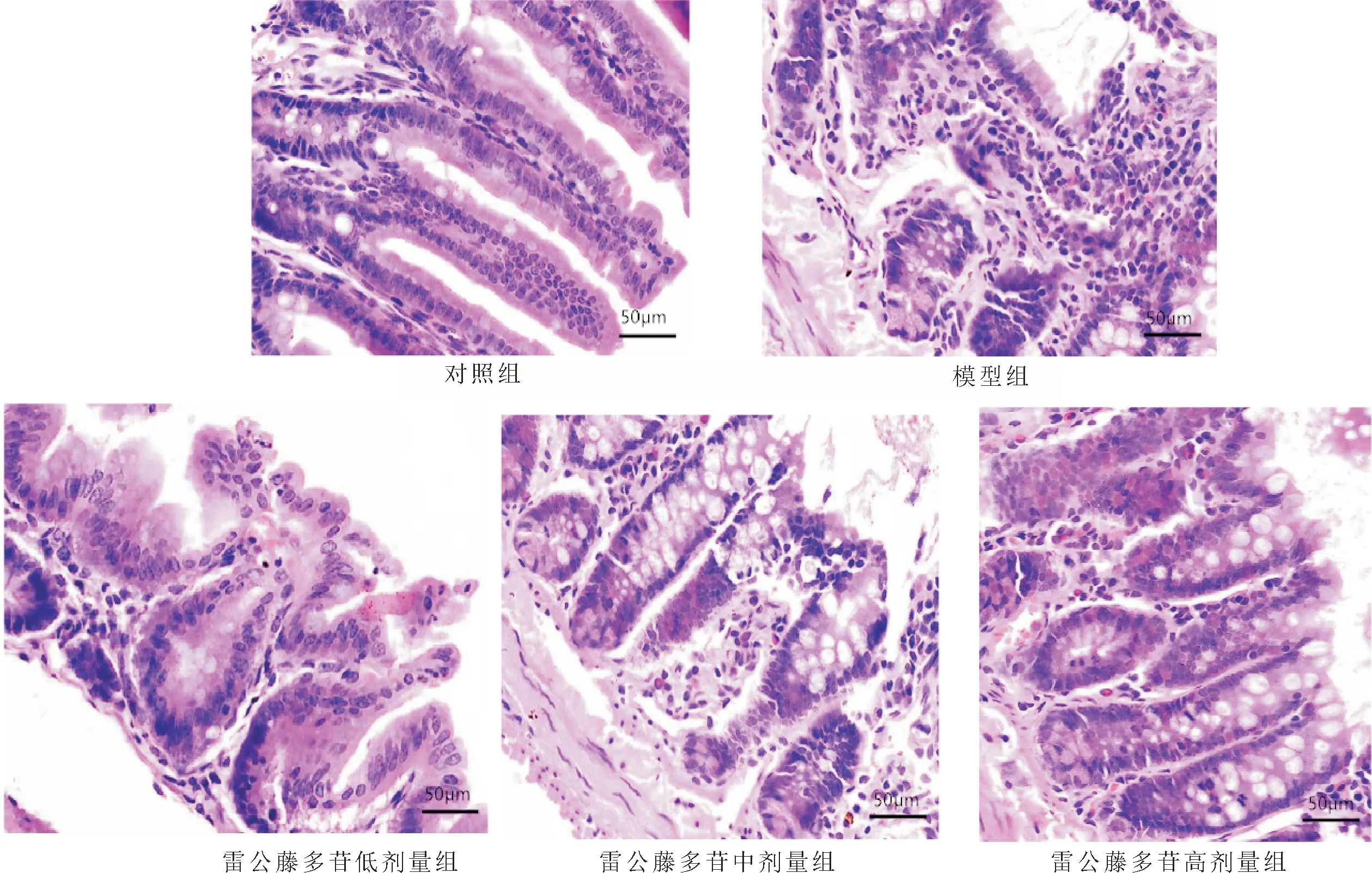
图1 肠组织病理学观察(HE,×200)
表1 肠杆菌总数、肠球菌总数及杆/球菌比值比较 (±s)

表1 肠杆菌总数、肠球菌总数及杆/球菌比值比较 (±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与雷公藤多苷低剂量组比较,△P<0.05;与雷公藤多苷中剂量组比较,▲P<0.05
组别n 肠杆菌总数/个 肠球菌总数/个 杆/球菌比值对照组10 181.59±17.36 65.70±7.31 2.76±0.24 模型组9 110.44±9.58*205.38±19.88*0.54±0.08*雷公藤多苷低剂量组 9 125.27±13.07# 180.01±19.20#0.70±0.09#雷公藤多苷中剂量组 10 141.08±14.22#△ 158.36±17.35#△0.89±0.11#△雷公藤多苷高剂量组 10 156.31±15.94#△▲122.47±15.32#△▲ 1.28±0.16#△▲F值34.980 106.974 346.237 P值<0.001<0.001<0.001
3.4 肠道G+杆菌、G+球菌占总菌群数比率比较与对照组比较,模型组G+杆菌比率明显降低,G+球菌比率明显升高(P<0.05);与模型组比较,雷公藤多苷低、中、高剂量组G+杆菌比率明显升高,G+球菌比率明显降低(P<0.05);与雷公藤多苷低剂量组比较,雷公藤多苷中、高剂量组G+杆菌比率明显升高,G+球菌比率明显降低(P<0.05);与雷公藤多苷中剂量组比较,雷公藤多苷高剂量组G+杆菌比率明显升高,G+球菌比率明显降低(P<0.05)。见表2。
3.5 肠组织中IL-1β、IL-6、TNF-α水平比较与对照组比较,模型组IL-6水平明显降低,IL-1β、TNF-α明显升高(P<0.05);与模型组比较,雷公藤多苷低、中、高剂量组IL-6水平明显升高,IL-1β、TNF-α明显降低(P<0.05);与雷公藤多苷低剂量组比较,雷公藤多苷中、高剂量组IL-6水平明显升高,IL-1β、TNF-α明显降低(P<0.05);与雷公藤多苷中剂量组比较,雷公藤多苷高剂量组IL-6水平明显升高,IL-1β、TNF-α明显降低(P<0.05)。见表3。
表2 肠道G+杆菌、G+球菌占总菌群数比率比较 (±s,%)
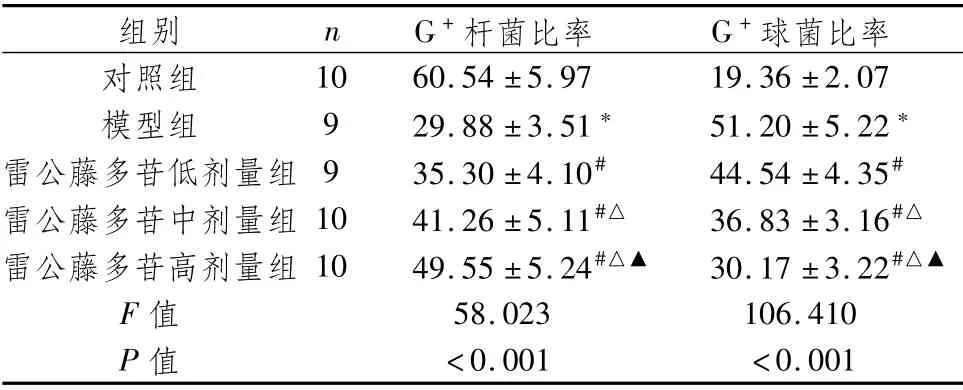
表2 肠道G+杆菌、G+球菌占总菌群数比率比较 (±s,%)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与雷公藤多苷低剂量组比较,△P<0.05;与雷公藤多苷中剂量组比较,▲P<0.05
组别n G+杆菌比率G+球菌比率对照组10 60.54±5.97 19.36±2.07模型组9 29.88±3.51*51.20±5.22*雷公藤多苷低剂量组 9 35.30±4.10#44.54±4.35#雷公藤多苷中剂量组10 41.26±5.11#△36.83±3.16#△雷公藤多苷高剂量组10 49.55±5.24#△▲30.17±3.22#△▲F值58.023 106.410 P值<0.001<0.001
表3 肠组织中IL-1β、IL-6、TNF-α水平比较 (±s,ng·L-1)

表3 肠组织中IL-1β、IL-6、TNF-α水平比较 (±s,ng·L-1)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与雷公藤多苷低剂量组比较,△P<0.05;与雷公藤多苷中剂量组比较,▲P<0.05
组别n IL-1βIL-6 TNF-α对照组10 52.33±7.21 105.91±8.30 26.15±6.77 模型组9 262.07±20.66*26.32±3.11*315.49±21.83*雷公藤多苷低剂量组9 201.54±18.73#51.64±6.54#231.02±20.26#雷公藤多苷中剂量组 10 168.78±15.21#△60.27±6.34#△175.10±19.37#△雷公藤多苷高剂量组 10 131.19±15.09#△▲72.33±6.75#△▲94.37±10.22#△▲F值232.762 193.150 442.447 P值<0.001<0.001<0.001
3.6 肠组织中GRP78、ATF6、CHOP蛋白相对表达量比较与对照组比较,模型组GRP78、ATF6、CHOP蛋白相对表达量均明显升高(P<0.05);与模型组比较,雷公藤多苷低、中、高剂量组GRP78、ATF6、CHOP蛋白相对表达量均明显降低(P<0.05);与雷公藤多苷低剂量组比较,雷公藤多苷中、高剂量组GRP78、ATF6、CHOP蛋白相对表达量均降低(P<0.05),且雷公藤多苷中剂量组低于高剂量组。见表4,图2。
表4 肠组织中GRP78、ATF6、CHOP蛋白相对表达量比较 (±s)

表4 肠组织中GRP78、ATF6、CHOP蛋白相对表达量比较 (±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与雷公藤多苷低剂量组比较,△P<0.05;与雷公藤多苷中剂量组比较,▲P<0.05
GRP78 ATF6 CHOP对照组组别n 10 0.41±0.06 0.38±0.04 0.14±0.03 模型组9 2.06±0.18*1.49±0.12*1.35±0.16*雷公藤多苷低剂量组 9 1.11±0.11#1.10±0.11#1.13±0.12#雷公藤多苷中剂量组 10 0.85±0.09#△0.83±0.08#△0.92±0.08#△雷公藤多苷高剂量组 10 0.62±0.07#△▲0.60±0.07#△▲ 0.65±0.09#△▲F值326.753 231.944 197.043 P值 <0.001<0.001<0.001

图2 肠组织中GRP78、ATF6、CHOP蛋白表达
4 讨论
NEC是新生儿危重症,多在出生后3周内发病,以肠道局部坏死为临床特征,易导致肠穿孔[14]。外科手术结合常规对症治疗是主要干预手段,但治疗效果仍需进一步提高[15-16]。目前NEC发病机制尚未完全阐明,认为与早产、人工喂养、肠道菌群紊乱等多种因素有关,阐明NEC发病机制并寻找有效治疗方法有重要意义[17-18]。雷公藤多苷是中药雷公藤的有效活性成分,可通过调节体液免疫、细胞免疫参与机体炎症反应[19]。研究雷公藤多苷对NEC新生大鼠的干预效果及作用机制,可为雷公藤多苷进一步应用于临床提供依据。
临床中手术切除的新生儿肠道组织标本,因伴有严重坏死及非特异性炎症病变,不适合对疾病早期病变的研究[20]。人工喂养联合缺氧冷刺激复制NEC模型,其肠道损伤病理改变过程与人类相似[21],本研究应用该方法建立NEC新生大鼠模型。结果显示造模大鼠出现腹胀、腹泻、排黄绿色黏液稀便等NEC典型症状,肠道病理改变与临床相似。机体肠道菌群多种多样,如双歧杆菌属、乳杆菌属等G+杆菌等生理性优势菌群,肠球菌、链球菌等G+球菌及拟杆菌、大肠埃希菌等G-杆菌,属条件致病菌,另外葡萄球菌、假单胞菌等多属于G-杆菌和G+球菌,属有害病原菌[22-23]。胎儿肠道无菌,新生儿在出生数小时内肠道细菌迅速定植和生长,达到平衡状态,使杆球菌比值维持在3左右,喂养方式、缺氧、寒冷等刺激因素均可引起肠道菌群定植紊乱[24]。本研究中模型组肠道杆球菌比值约0.54,优势菌群G+杆菌比率降低、条件致病菌或病原菌G+球菌比率升高,应用不同剂量雷公藤干预后杆球菌比值、G+杆菌比率均得到显著提高,G+球菌比率降低,提示NEC新生大鼠的肠道菌群紊乱现象得到纠正。此外,本研究应用不同剂量雷公藤多苷干预后,各干预组较模型组肠组织损伤评分、肠组织IL-1β、TNF-α水平呈剂量依赖性降低,而肠组织IL-6水平呈剂量依赖性升高,说明雷公藤多苷有助于调节NEC新生大鼠的肠道炎症反应。研究显示,肠道菌群紊乱后,条件致病菌及病原菌产生的毒素可引起黏膜完整性破坏、炎症细胞浸润等一系列病理改变,肠道发生严重炎症病变[25]。艾燕等[26]研究表明,雷公藤多苷可通过抑制肠组织中TNF-α等促炎因子水平发挥治疗溃疡性结肠炎大鼠炎症反应作用;钦丹萍等[27]研究显示,雷公藤多苷可有效缓解克罗恩病、溃疡性结肠炎患者肠道炎症反应,与本研究结果相似。NEC发病后肠黏膜完整性被破坏,病原菌异位,引起内源性促炎介质大量释放,雷公藤通过抑制促炎介质释放,促进抗炎介质分泌,发挥保护肠黏膜完整性作用。
本研究中,雷公藤多苷各剂量组肠组织中GRP78、ATF6、CHOP蛋白相对表达量呈剂量依赖性降低,说明雷公藤多苷可能通过抑制GRP78-ATF6-CHOP通路发挥调控作用。GRP78是主要分布于内质网中的热休克蛋白,参与内质网应激(endoplasmic reticulum stress,ESR)稳态调节[28]。生理状态下,GRP78与下游ATF6结合处于非激活状态,当ESR启动后,两者发生解离,ATF6随之活化进入细胞核,激活位于下游的靶基因CHOP转录和翻译,启动细胞凋亡等过程[29]。喂养不当、缺氧等多种高危因素作用下,肠道ESR增加,GRP78-ATF6-CHOP通路激活,从而启动细胞凋亡通路,加之肠道微生态失衡释放大量肠毒素,进一步加剧肠道上皮细胞凋亡,促进肠组织损伤[30]。由此可知,雷公藤多苷可能通过抑制GRP78-ATF6-CHOP通路,缓解肠组织上皮细胞凋亡现象,从而发挥保护NEC肠组织作用。
综上所述,雷公藤多苷可有效改善NEC新生大鼠的肠道菌群紊乱现象,且可能通过抑制GRP78-ATF6-CHOP通路发挥保护肠组织的作用,为临床雷公藤多苷用于NEC的防治提供理论参考。

